cgVEGF164基因对小鼠毛囊生长的影响
张豪,张志鹏,郭晓东,马敏,敖月,刘旭,马小燕,梁浩,郭旭东
基因对小鼠毛囊生长的影响
张豪1,张志鹏2,郭晓东1,马敏1,敖月1,刘旭1,马小燕1,梁浩1,郭旭东1
1. 内蒙古大学,省部共建草原家畜生殖调控与繁育国家重点实验室,呼和浩特 010070 2. 集宁师范学院,乌兰察布 012000
血管内皮生长因子(vascular endothelial growth factor, VEGF)是一种二聚体糖蛋白,能够诱导毛囊血管内皮细胞的增殖和迁移,调节毛囊周围毛细血管生成,进而影响毛囊的生长发育。已知是绒山羊基因的一种主要剪接变体,但基因是否具有调控毛囊生长发育的作用目前尚不清楚。为初步探究基因对毛囊生长的影响及其机制,本研究通过原核显微注射制备转基因过量表达小鼠。通过HE染色法比较转基因小鼠和非转基因对照小鼠毛囊的直径和密度,利用Western Blot检测小鼠背部皮肤中信号蛋白ERK1/2、AKT1、LEF1的磷酸化水平。本研究成功获得5只阳性cg转基因小鼠(雌雄比为4:1,阳性率8.5%);与非转基因对照小鼠相比,转基因小鼠毛囊直径增大、密度增加;经检测转基因小鼠中ERK1/2、AKT1、LEF1的磷酸化水平均上调。结果表明,基因具有促进小鼠毛囊生长的作用,推测该功能可能与cgVEGF164影响ERK1/2、AKT1和LEF1等信号蛋白的磷酸化有关。
;转基因小鼠;毛囊生长;磷酸化
毛囊的性状和结构决定动物毛发的品质,研究毛囊生长调控机制对于提高产绒动物产绒量至关重要。毛囊生长所需的营养物质以及调控生长所需的各类细胞因子均由其周围血管(循环系统)提供,因而充足的血液供应是毛囊细胞生长分化的基础。哺乳动物的毛囊通常呈现周期性变化,包括生长期、退行期和休止期[1,2]。研究显示,毛囊周围的毛细微血管会随着毛囊周期的变化而变化,毛细微血管在毛囊生长期比较发达,进入退行期后逐渐退化[3~5]。
血管内皮生长因子(vascular endothelial growth factor, VEGF)是一种由二硫键连接而成的二聚体糖蛋白,能够促进血管再生和调节血管渗透性[6,7]。研究证实,VEGF通过与血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)相互作用,促进血管内皮细胞的增殖和迁移[8,9]。皮肤中基因的表达水平在毛囊生长期上调,进入退行期后逐渐降低,在休止期则基本消失[4,6]。在小鼠毛囊结构中,基因主要在外根鞘和毛乳头中表达[10],进而诱导毛囊周围毛细血管的形成,促进外根鞘和毛乳头细胞的增殖[11,12],增大毛囊直径和毛干长度[13]。
由于mRNA剪切方式的不同,在人中已发现7种mRNA剪接变体,包括、、、、、和[14~16]。已知是绒山羊基因的一种主要剪接变体,在绒山羊脑、心脏、睾丸、胰腺、脾、肾和肺中都有表达,与人源基因的同源性高达94%[17]。已有研究证实基因能够促进毛发生长[18~20],而基因是否具有调控毛囊生长发育的作用目前尚不清楚。本研究旨在通过原核显微注射法,获得转基因小鼠,比较转基因小鼠与非转基因对照小鼠毛囊的直径和数量以及相关信号蛋白ERK1/2、AKT1、LEF1磷酸化水平的变化,探讨外源基因对毛囊生长的影响及调节机制,为利用现代生物学技术手段提高产绒动物的产绒量提供实验依据。
1 材料与方法
1.1 材料
BDF1雌鼠、CD-1雄鼠、C57小鼠均由内蒙古大学国家清洁级实验动物繁育室提供。所有研究符合内蒙古大学动物伦理委员会的规定并授权。K14-cgVEGF164载体由内蒙古大学王志钢教授提供[17],其启动子为Keratin 14 (K14),外源基因为。
1.2 注射用外源基因的制备
用限制性内切酶Ⅱ对K14-cgVEGF164质粒载体进行线性化酶切,获得线性化K14-cgVEGF164质粒载体。用乙醇沉淀法对线性化K14-cgVEGF164质粒载体进行纯化,最后用TE缓冲液溶解并调整浓度为1.5 ng/µL。用分光光度计测定值,值在1.7~1.9之间才可注射。
1.3 原核显微注射
原核显微注射法制备转基因小鼠参考文献[21]中的方法。将6~7周龄性成熟的BDF1母鼠与CD1公鼠合笼,20 h后取见栓母鼠的受精卵。将1×10-6µL左右含K14-cgVEGF164质粒载体的注射液注入胚胎雄原核,注射完毕后将胚胎移入KSOM培养液,放入CO2培养箱。30 min后选取25~30枚注射后存活胚胎移入经麻醉处理的假孕母鼠输卵管壶腹部。移植后将假孕母鼠放置于保温板上待其苏醒后放回鼠房,怀孕成功母鼠约19天后分娩产仔。
1.4 PCR检测
根据K14-cgVEGF164质粒载体的序列信息,设计一对用于检测外源基因整合的PCR引物。引物信息:
F:5'-CAGGGTCCGATGGGAAAGTGTA-3';
R:5'-TGCTGGCTTTGG TGAGGTTTGA-3'。
扩增产物为675 bp,产物横跨K14启动子和基因。待出生幼鼠长至3周时,剪取约0.5 cm尾尖提取基因组DNA,进行PCR鉴定,确定转基因阳性小鼠。PCR扩增条件:95℃预变性10 min,95℃变性30 s,60℃复性42 s,72℃延伸45 s,共30个循环;最后再72℃延伸7 min。扩增产物经1%琼脂糖凝胶电泳检测。
1.5 qRT-PCR分析
取10周龄转基因小鼠为实验组,保留同窝的阴性小鼠为非转基因对照组。脱毛后剪取背部皮肤组织,液氮研磨后加入800 µL RNAiso Plus,按RNA抽提试剂盒说明书提取总RNA,利用反转录试剂盒(TaKaRa,日本)合成cDNA。qRT-PCR扩增体系为20 µL,包括:SYBR Premix ExⅡ (2×) 10 µL,上、下游引物各0.4 μL,Rox Reference Dye (50×) 0.4 µL,ddH2O 6.8 µL,cDNA 2 µL。qRT-PCR 扩增条件:95℃预变性30 s;95℃变性10 s,60℃延伸30 s,40个循环,每个样品进行3次重复。根据每个样品与内参基因所得的值,利用2-ΔΔCt公式分析目的基因mRNA的相对表达量。目的基因cg和内参基因的扩增引物见表1。
1.6 Western Blot检测
取转基因小鼠和同窝非转基因对照小鼠皮肤组织,放于1.5 mL离心管内剪碎,RIPA裂解液裂解细胞,收集蛋白,聚丙烯酰胺凝胶电泳后转PVDF膜。封闭后,相应一抗(VEGF164 ab53465、α-tubulin ab15246、ERK1/2 ab17942、P-ERK1/2 ab50011、AKT1 ab32505、P-AKT1 ab66138、LEF1 ab137872、P-LEF1 ab74067均购自美国Abcam公司)4℃孵育过夜,羊抗兔二抗(ab6721购自美国Abcam公司)室温孵育1 h。最后利用Tanon 5200全自动化学发光成像分析系统进行曝光处理。
1.7 HE染色与免疫荧光
选取转基因小鼠和同窝非转基因对照小鼠的背部组织进行固定、脱水透明、浸蜡包埋、切片与贴片、脱蜡、苏木精与伊红染色。VEGF164一抗(1∶200)过夜孵育,羊抗兔二抗(ab6717购自美国Abcam公司) (1∶1000)孵育1 h进行免疫荧光染色。
1.8 数据分析
mRNA和VEGF164蛋白的相对表达量,毛囊的直径、密度,ERK1/2、AKT1、LEF1磷酸化水平等数据均以平均数和平均数的标准差表示,采用GraphPad Prism 6软件进行统计学分析,所有数据均进行3次以上重复实验。>0.05表示没有统计学差异,用“N.S.”(No significance)表示;<0.05表示差异显著,<0.01表示差异极显著,具有统计学意义。

表1 Real-time PCR扩增引物
2 结果与分析
2.1 cgVEGF164转基因小鼠的鉴定
本研究共移植原核注射胚胎296枚,获得59只仔鼠,经PCR法初步鉴定共获得5只转基因小鼠(图1A),其编号分别为878号、890号、1008号、1018号和1021号,阳性率为8.5%。将F0代转基因小鼠和野生型C57小鼠交配,获得F1代小鼠。将F1代转基因小鼠自交获得F2代转基因小鼠。出生仔鼠用与原代小鼠相同的鉴定方法进行鉴定。所有F0代转基因阳性小鼠都能够将外源基因传递给子代(表2)。其中1008号小鼠共获得6只F2代转基因小鼠,其编号分别为1311、1313、1316、1317、1319和1322 (图1B)。
2.2 转基因小鼠cgVEGF164 mRNA及蛋白表达水平的检测
利用qRT-PCR、Western Blot和免疫荧光染色检测5只转基因小鼠与同窝非转基因对照小鼠皮肤mRNA及蛋白的相对表达量。结果显示,890、1008、1018、1021号转基因阳性小鼠中mRNA及VEGF164蛋白的相对表达量均高于同窝非转基因对照小鼠,而878号转基因阳性小鼠中mRNA及VEGF164蛋白的相对表达量与其同窝非转基因对照小鼠没有显著性差异(图2,A~D)。890号转基因阳性小鼠mRNA相对表达量最高,是同窝对照小鼠886号的6.25倍(图2A);1008号转基因阳性小鼠VEGF164蛋白表达量最高,是同窝对照小鼠1013号的1.68倍(图2,B和C)。经免疫荧光染色,发现VEGF164蛋白主要分布于毛囊球部(图2D)。
2.3 转基因小鼠cgVEGF164 mRNA组织表达谱检测及表型分析
为探究在转基因小鼠各组织中的表达水平,本研究将1008号转基因小鼠F2代作为实验组,其同窝的非转基因小鼠作为对照组,观察实验组与对照组小鼠表型的变化,并利用qRT-PCR检测转基因和非转基因小鼠各组织中mRNA表达水平。结果表明,与非转基因对照小鼠相比,8周龄转基因小鼠的表型无异常变化,生长状况良好(图3A)。转基因小鼠脑、脂肪、肌肉、肝脏、肺、脾脏、肾脏、心脏、胃、大肠、小肠、睾丸、卵巢等组织中mRNA的相对表达量均高于皮肤组织(图3B);与非转基因对照小鼠相比,在转基因小鼠脑、脂肪、肌肉、肝脏、肺、脾脏、肾脏、心脏、胃、大肠、小肠、睾丸、卵巢等组织中的表达量并没有显著升高(图3C),这可能与K14启动子是表皮特异启动子有关,表明外源基因对转基因小鼠其他组织的影响比较小。

图1 cgVEGF164转基因小鼠PCR鉴定结果
A:F0代转基因小鼠PCR鉴定结果。M:200 bp DNA marker;1:质粒阳性对照(K14-cgVEGF164 plasmids);2:空白对照(H2O);3, 4:非转基因对照小鼠;5~9:F0代转基因小鼠(对应编号分别为878、890、1008、1018、1021)。B:1008号小鼠F2代转基因小鼠PCR鉴定结果。M:200 bp DNA marker;10~15:F2代转基因小鼠(对应编号分别为1311、1313、1316、1317、1319和1322)。
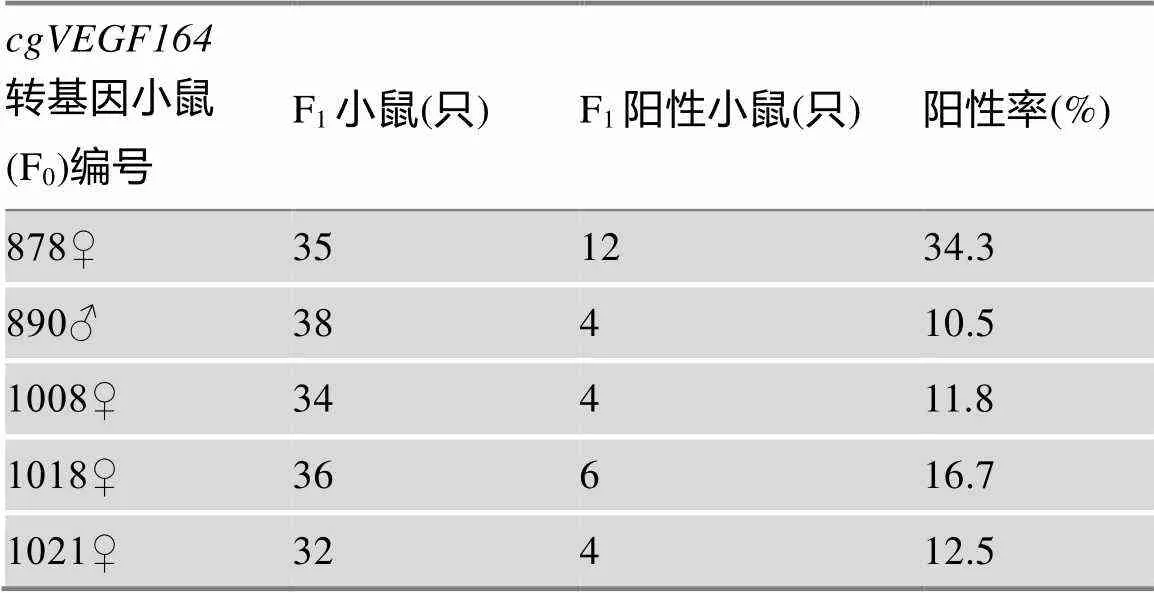
表2 cgVEGF164转基因小鼠传代统计
2.4 cgVEGF164基因对小鼠毛囊生长的影响
本研究将1008号转基因小鼠F2代作为实验组,其同窝非转基因小鼠作为对照组,待小鼠生长到10周龄时,将两组小鼠背部剃毛后,取背部组织制备组织切片,经HE染色后观察。结果显示,与非转基因对照小鼠相比,转基因小鼠的毛囊直径明显增大(图4A),毛囊密度显著升高(图4B)。转基因小鼠毛囊深入真皮层,而非转基因对照小鼠毛囊在真皮层比较浅的位置(图4C)。

图2 转基因小鼠cgVEGF164 mRNA及蛋白表达水平检测
A:转基因小鼠与非转基因对照小鼠mRNA表达量的对比;B:转基因小鼠与非转基因对照小鼠Western Blot结果;C:转基因小鼠与非转基因对照小鼠Western Blot结果的灰度值分析;D:转基因小鼠与非转基因对照小鼠VEGF164蛋白免疫荧光染色。图中绿色荧光为VEGF164染色,蓝色荧光为DAPI染色。N.S.表示>0.05,没有统计学差异;*表示<0.05,差异显著;**表示<0.01,差异极显著。
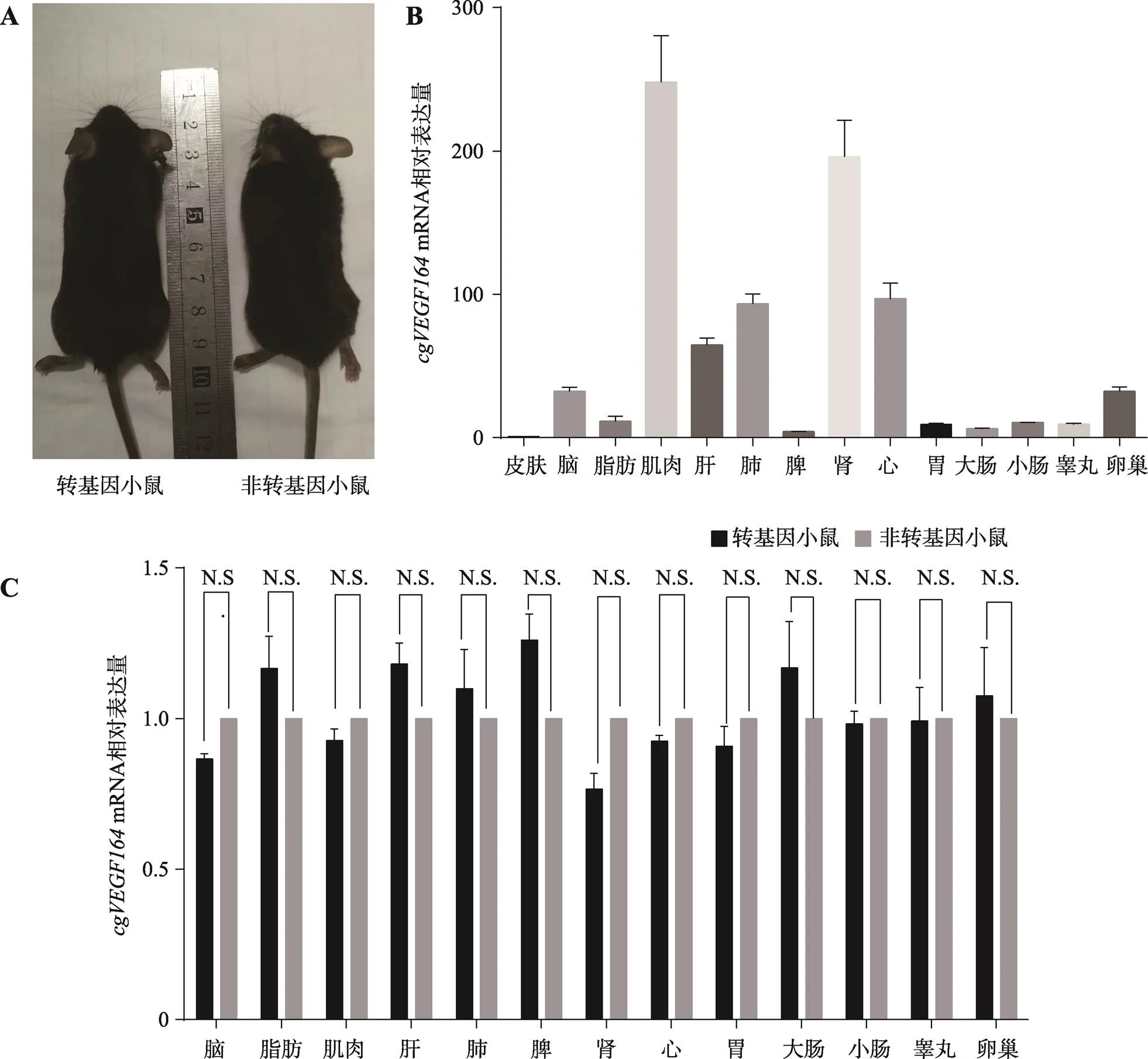
图3 转基因小鼠表型观察及各组织中cgVEGF164 mRNA相对表达量
A:转基因小鼠与非转基因小鼠的表型观察;B:转基因小鼠各组织表达谱;C:转基因小鼠与非转基因小鼠mRNA在各组织中相对表达量。N.S表示>0.05,没有统计学差异。
2.5 VEGF下游信号通路蛋白的检测
利用Western Blot方法检测转基因小鼠与非转基因对照小鼠VEGF下游蛋白ERK1/2、P-ERK1/2、AKT1、P-AKT1、LEF1、P-LEF1的相对表达量,α-tubulin作为内参蛋白,结果如图5A所示。通过灰度值计算P-ERK1/2、P-AKT1、P-LEF1分别占ERK1/2、AKT1、LEF1表达量的百分比,结果发现转基因小鼠中P-ERK1/2/ERK1/2、P-AKT1/AKT1、P-LEF1/ LEF1分别为44%、51%、11%,均高于对照组18%、11%、8% (图5B)。
3 讨论
转基因动物是指通过转基因技术将外源基因整合到动物的基因组中,从而使外源基因在动物体内表达并且可以稳定遗传[22]。建立转基因动物模型,对研究外源基因在动物体内的功能和表达调控机制具有至关重要的作用[23,24]。本研究利用原核显微注射技术制作转基因小鼠模型,旨在研究基因对小鼠毛囊生长的影响。经PCR初步鉴定,确定5只小鼠成功转入了基因(编号分别是878、890、1008、1018、1021),阳性率为8.5%。经qRT-PCR和Western Blot进一步检测分析,获得4只高表达的转基因阳性小鼠(编号分别是890、1008、1018、1021)。878号小鼠虽然成功转入了基因,但其mRNA和蛋白表达量不高于非转基因对照小鼠,推测原因可能是由于本研究中构建的转基因表达载体属于随机整合载体,外源基因虽然发生了基因组整合,但其转录和蛋白质表达效率将受到整合位点的影响而不可预测。由于K14启动子是表皮特异启动子,因而与非转基因对照小鼠相比,基因在转基因小鼠脑、脂肪、肌肉、肝脏、肺、脾脏、肾脏、心脏、胃、大肠、小肠、睾丸、卵巢等组织中的表达量并没有显著升高。
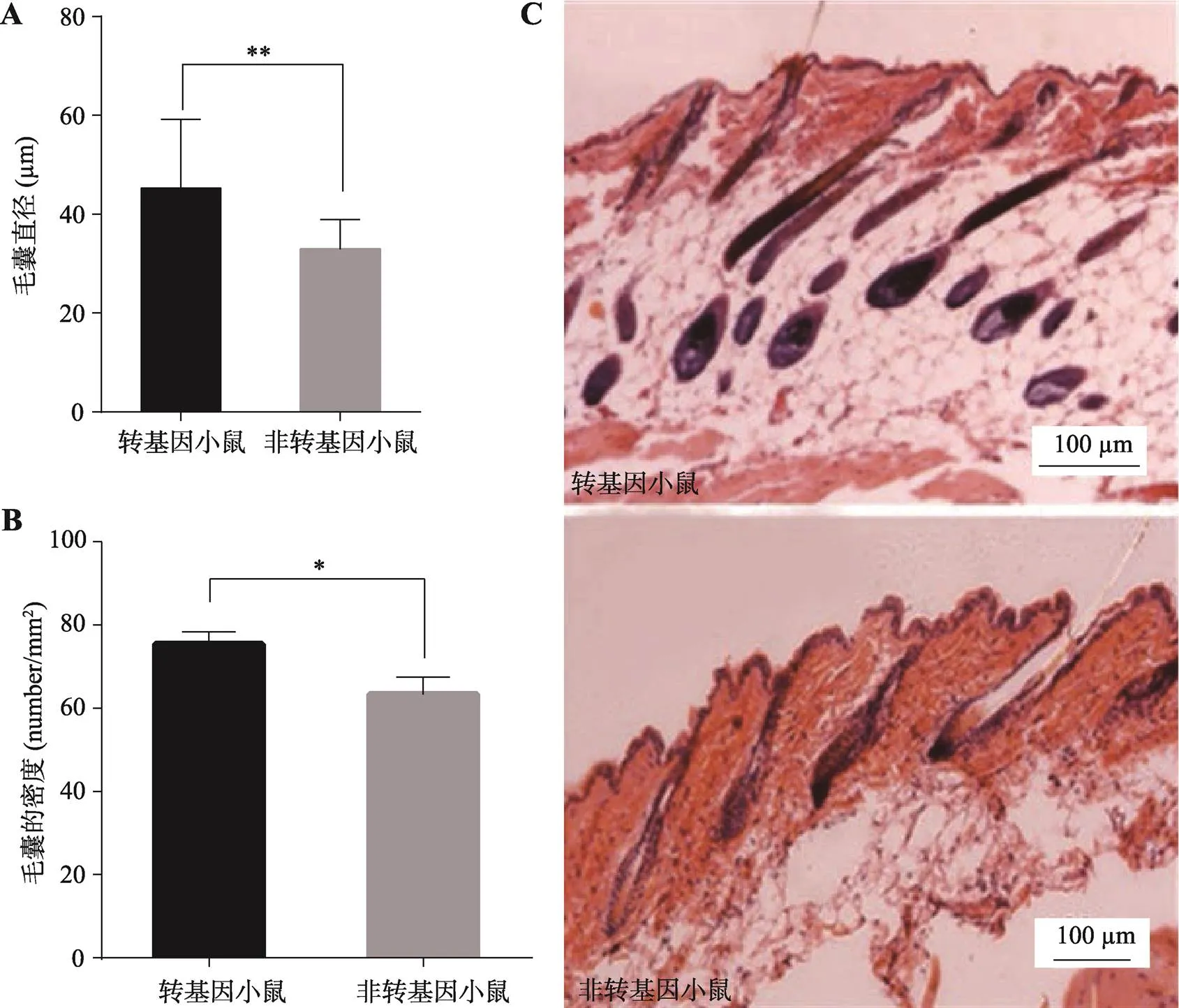
图4 转基因小鼠皮肤组织切片观察
A:转基因小鼠与非转基因对照小鼠毛囊直径;B:转基因小鼠与非转基因对照小鼠毛囊密度;C:转基因小鼠和非转基因对照小鼠石蜡切片HE染色图(纵切)。*表示<0.05,差异显著;**表示<0.01,差异极显著。

图5 VEGF下游信号通路蛋白的检测
A:ERK1/2、P-ERK1/2、AKT1、P-AKT1、LEF1、P-LEF1的Western Blot检测;B:P-ERK1/2、P-AKT1、P-LEF1分别占ERK1/2、AKT1、LEF1表达量的百分比。*表示<0.05,差异显著;**表示<0.01,差异极显著。
基因编码一段由190个氨基酸构成的多肽,其N端的26个氨基酸序列与人源的N端完全相同,属信号肽序列,推测该序列与其分泌功能有关[25,26]。VEGF是血管再生的关键因子,通过促进毛囊周围毛细血管的生长,进而影响毛发生长和毛囊周期[27]。本研究使用HE染色法对小鼠背部组织切片进行染色观察,结果发现,与非转基因对照小鼠相比转基因小鼠毛囊的直径和密度均增加,毛囊深入真皮层,表明基因具有促进毛囊生长的作用。
为进一步探究基因参与小鼠毛发生长的调节机制,本研究通过检测信号蛋白ERK1/2、AKT、LEF1的磷酸化水平初步确定cgVEGF164与MAPK/ERK1/2、PI-3K-AKT1/PAK和Wnt/β-catenin/ LEF1等信号通路的联系。ERK1/2、AKT1、LEF1是与VEGF信号通路相关的下游信号蛋白,在促进毛发生长和调节毛囊周期中扮演重要角色。ERK1/2是MAPK家族成员之一,参与VEGF调节表皮细胞的增殖[1,12,28,29]。AKT也是MAPK家族成员之一,能够与VEGFR作用促进表皮细胞的存活和增殖[15,30]。LEF1是Wnt途径中主要成员之一,与β-catenin蛋白结合作用于VEGF,调控毛囊周期促进毛发再生[31~33]。研究结果显示,转基因小鼠背部上皮中ERK1/2、AKT1、LEF1磷酸化水平均高于非转基因对照小鼠,由此我们推断基因通过促进RK1/2、AKT1、LEF1磷酸化调控毛囊的生长。但是,毛囊的生长是多种生物因子综合作用的结果,基因调控毛囊生长的分子机制还需要进一步深入研究。
[1] Hardy MH. The secret life of the hair follicle., 1992, 8(2): 55–61.
[2] Stenn KS, Paus R. Controls of hair follicle cycling., 2001, 81(1): 449–494.
[3] Paus R, Cotsarelis G. The biology of hair follicles., 1999, 341(7): 491–497.
[4] Yano K, Brown LF, Detmar M. Control of hair growth and follicle size by VEGF-mediated angiogenesis., 2001, 107(4): 409–417.
[5] Mecklenburg L, Tobin DJ, Müller-Röver S, Handjiski B, Wendt G, Peters EMJ, Pohl S, Moll I, Paus R. Active hair growth (Anagen) is associated with angiogenesis., 2000, 114(5): 909–916.
[6] Carmeliet P, Ferreira V, Breier G, Pollefeyt S, Kieckens L, Gertsenstein M, Fahrig M, Vandenhoeck A, Harpal K, Eberhardt C, Declercq C, Pawling J, Moons L, Collen D, Risau W, Nagy A. Abnormal blood vessel development and lethality in embryos lacking a single VEGF allele., 1996, 380(6573): 435–439.
[7] Ferrara N, Carver-Moore K, Chen H, Dowd M, Lu L, O'Shea KS, Powell-Braxton L, Hillan KJ, Moore MW. Heterozygous embryonic lethality induced by targeted inactivation of the VEGF gene., 1996, 380(6573): 439–442.
[8] Olsson AK, Dimberg A, Kreuger J, Claesson-Welsh L. VEGF receptor signalling - in control of vascular function., 2006, 7(5): 359–371.
[9] Holmes K, Roberts OL, Thomas AM, Cross MJ. Vascular endothelial growth factor receptor-2: Structure, function, intracellular signalling and therapeutic inhibition., 2007, 19(10): 2003–2012.
[10] Man XY, Yang XH, Cai SQ, Bu ZY, Wu XJ, Lu ZF, Zheng M. Expression and localization of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 in human epidermal appendages: a comparison study by immunofluorescence., 2009, 34(3): 396–401.
[11] Li W, Lu ZF, Man XY, Li CM, Zhou J, Chen JQ, Yang XH, Wu XJ, Cai SQ, Zheng M. VEGF upregulates VEGF receptor-2 on human outer root sheath cells and stimulates proliferation through ERK pathway., 2012, 39(9): 8687–8694.
[12] Li W, Man XY, Li CM, Chen JQ, Zhou J, Cai SQ, Lu ZF, Zheng M. VEGF induces proliferation of human hair follicle dermal papilla cells through VEGFR-2-mediated activation of ERK., 2012, 318(14): 1633– 1640.
[13] Fujie T, Katoh S, Oura H, Urano Y, Arase S. The chemotactic effect of a dermal papilla cell-derived factor on outer root sheath cells., 2001, 25(3): 206–212.
[14] Houck KA, Ferrara N, Winer J, Cachianes G, Li B, Leung DW. The vascular endothelial growth factor family: identification of a fourth molecular species and characterization of alternative splicing of RNA., 1991, 5(12): 1806–1814.
[15] Tischer E, Mitchell R, Hartman T, Silva M, Gospodarowicz D, Fiddes JC, Abraham JA. The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing., 1991, 266(18): 11947–11954.
[16] Detmar M, Brown LF, Schön MP, Elicker BM, Velasco P, Richard L, Fukumura D, Monsky W, Claffey KP, Jain RK. Increased microvascular density and enhanced leukocyte rolling and adhesion in the skin of VEGF transgenic mice., 1998, 111(1): 1–6.
[17] Bao WL, Yang JF, Li B, Liu JE, Wang X, Guo XD, Wang ZG, Hou X, Liu DJ. Cloning and characterization of VEGF164 gene cDNA and analysis of its Tissue-specific expression in inner mongolia cashmere Goat., 2011, 51(2): 115–120.鲍文蕾, 杨娇馥, 李彬, 刘俊娥, 王潇, 郭旭东, 王志钢, 侯鑫, 刘东军. 内蒙古白绒山羊VEGF164基因cDNA克隆及组织表达特异性分析. 生物技术通报, 2011, (2): 115–120.
[18] Wu XJ, Zhu JW, Jing J, Xue D, Liu H, Zheng M, Lu ZF. VEGF165 modulates proliferation, adhesion, migration and differentiation of cultured human outer root sheath cells from central hair follicle epithelium through VEGFR-2 activation., 2014, 73(2): 152–160.
[19] Zheng X, Xu S, Quan R. Experimental study on vascular endothelial growth factor 165 gene-modified rat hair follicle stem cells mediated by lentiviral vector., 2014, 28(2): 155–161.
[20] Quan R, Du W, Zheng X, Xu S, Li Q, Ji X, Wu X, Shao R, Yang D. VEGF165 induces differentiation of hair follicle stem cells into endothelial cells and plays a role inangiogenesis., 2017, 21(8): 1593–1604.
[21] Plück A, Klasen C. Generation of chimeras by microinjection., 2009, 561: 199–217.
[22] Miquerol L, Beyer S, Kelly RG. Establishment of the mouse ventricular conduction system., 2011, 91(2): 232–242.
[23] Gama Sosa MA, de Gasperi R, Elder GA. Animal transgenesis: an overview., 2010, 214(2–3): 91–109.
[24] Manson JC, Tuzi NL. Transgenic models of the transmissible spongiform encephalopathies., 2001, 3(12): 1–15.
[25] Kozlowska U, Blume-Peytavi U, Kodelja V, Sommer C, Goerdt S, Majewski S, Jablonska S, Orfanos CE. Expression of vascular endothelial growth factor (VEGF) in various compartments of the human hair follicle., 1998, 290(12): 661–668.
[26] Bao W, Yin J, Liang Y, Guo Z, Wang Y, Liu D, Wang X, Wang Z. recombinant Goat VEGF164 increases hair growth by painting process on the skin of shaved mouse., 2014, 27(9): 1355–1359.
[27] Ozeki M, Tabata Y.promoted growth of mice hair follicles by the controlled release of growth factors., 2003, 24(13): 2387–2394.
[28] Lecouter J. The biology of VEGF and its receptors., 2003, 9(6): 669–676.
[29] Takahashi T, Ueno H, Shibuya M. VEGF activates protein kinase C-dependent, but Ras-independent Raf-MEK-MAP kinase pathway for DNA synthesis in primary endothelial cells., 1999, 18(13): 2221–2230.
[30] Fujio Y, Walsh K. Akt mediates cytoprotection of endothelial cells by vascular endothelial growth factor in an anchorage-dependent manner., 1999, 274(23): 16349–16354.
[31] Hwang J, Mehrani T, Millar SE, Morasso MI. Dlx3 is a crucial regulator of hair follicle differentiation and cycling., 2008, 135(18): 3149–3159.
[32] Zhao Y, Qiu F, Xu S, Yu L, Fu G. Thymosin β4 activates integrin-linked kinase and decreases endothelial progenitor cells apoptosis under serum deprivation., 2011, 226(11): 2798–2806.
[33] Cadigan KM, Nusse R. Wnt signaling: a common theme in animal development., 1997, 11(24): 3286–3305.
The effect ofon the growth of murine hair follicles
Hao Zhang1, Zhipeng Zhang2, Xiaodong Guo1, Min Ma1, Yue Ao1, Xu Liu1, Xiaoyan Ma1, Hao Liang1, Xudong Guo1
Vascular endothelial growth factor (VEGF) is a dimeric glycoprotein that induces proliferation and migration of vascular endothelial cells as well as regulation of capillary formation around hair follicles which affects the growth and development of hair follicles.is a major splice variant of the cashmere goatgene, but its regulation on hair follicles is rarely known. In order to investigate the role ofon the growth of murine hair follicles, we produced keratin 14 promoter-driventransgenic micepronuclear microinjection. Firstly, the diameter and density of hair follicles of transgenic mice were compared with non-transgenic control mice in paraffin sections stained by hematoxylin-eosin (H&E). Then, protein expression levels and the phosphorylation of ERK1/2, AKT1 and LEF1 were examined by Western blot. There are five positive individuals among the neonatal mice (positive rate is 8.5%). Compared with non-transgenic control mice, the diameter and density of hair folliclesintransgenic mice are both obviously increased. The expression levels of P-ERK1/2/ERK1/2, P-AKT1/AKT1 and P-LEF1/LEF1 are significantly higher in transgenic mice than those in non-transgenic control mice. Based on these results, we conclude that cgVEGF164 as a growth factor can improve the growth of hair follicles which might be mediated by increasingthe levels of ERK1/2, AKT1, and LEF1 protein phosphorylation.
; transgenic mice;hair follicle growth; phosphorylation
2018-10-17;
2018-12-12
国家高技术研究发展计划(863计划)项目(编号:2013AA102506)和国家自然科学基金项目(编号:31160228)资助[Supported by the National High Technology Research and Development Program of China (863Program) (No.2013AA102506) and the National Natural Science Foundation of China (No.31160228)]
张豪,硕士研究生,专业方向:生殖生物学与生物技术。E-mail: 1299842592@qq.com
张志鹏,硕士研究生,专业方向:生殖生物学与生物技术。E-mail: 1910240599@qq.com
张豪和张志鹏并列第一作者。
郭旭东,副研究员,硕士生导师,研究方向:生殖生物学与生物技术。E-mail: xudguo@163.com
梁浩,博士,研究方向:生殖生物学与生物技术。E-mail: liangkaihao@aliyun.com
10.16288/j.yczz.18-136
2019/1/14 13:15:20
URI: http://kns.cnki.net/kcms/detail/11.1913.R.20190114.1315.002.html
(责任编委: 卢大儒)

