在线固相萃取-液相色谱法直接测定水中超痕量多环芳烃
王 超, 黄肇章, 邢占磊, 陈 烨, 于建钊, 刘 方, 袁 懋
(1. 中国环境监测总站, 北京 100012; 2. 广州市环境监测中心站, 广州 510091;3. 赛默飞世尔科技有限公司, 北京 100080)
多环芳烃(PAHs)对人体具有较强的致癌作用[1],是水体中重点监测和控制的有机污染物。美国将16种PAHs列为优先控制的有毒污染物,并基于人体摄入水和鱼类/贝类产生的健康风险,确定苯并[a]芘(B(a)P)的水质基准值(water quality criteria)为0.000 12 μg/L[2],规定饮用水中B(a)P的标准限值为0.2 μg/L[3]。欧盟和世界卫生组织(WHO)分别规定饮用水中B(a)P的标准限值为0.010 μg/L和0.7 μg/L[4,5]。现阶段我国对地表水中PAHs的控制要求(GB 3838-2002)要严于国外,规定B(a)P的标准限值为2.8 ng/L,对生活饮用水中B(a)P和PAHs总量的标准限值(GB 5749-2006)分别为10 ng/L和2 000 ng/L。
水体中PAHs的含量往往较低(ng/L水平),而且分析过程中易受实验室环境的污染,因此对于分析方法的灵敏度和抗污染能力等要求很高。目前分析水中PAHs常用的富集和净化方法是液液萃取、固相萃取、固相微萃取等,常用的仪器检测方法是液相色谱法(LC)、气相色谱-质谱法(GC-MS)等[6-8]。PAHs的分析方法常需要消耗大量水样及有机溶剂,整个分析过程操作复杂,费时费力,且方法容易受到污染,产生假阳性结果。在线固相萃取法所需水样少,有机溶剂用量少,水样前处理和分析测试一体化,自动化程度高,省时省力,可有效避免实验过程中的污染,在对水样的分析测试中具有广阔的应用前景[9-13]。关于水中PAHs的分析,采用在线固相萃取-LC的报道较少。陈静等[9]建立了在线固相萃取-LC检测水中20种PAHs的分析方法,并用于自来水样品的分析测试,但该方法的检出限(LOD)较高(0.010~0.72 μg/L),尤其是B(a)P的检出限为0.035 μg/L,分别是我国地表水和饮用水中B(a)P标准限值的12.5倍和3.5倍,无法满足实际监测分析的需求。
本研究建立了在线固相萃取-LC检测水体中16种PAHs的方法,并应用于自来水、河流水和湖泊水的分析测试,可有效满足我国水中16种PAHs的实际监测需求。
1 实验部分
1.1 仪器、试剂与材料
液相色谱(U3000,美国赛默飞世尔科技公司),配有在线脱气机、双三元梯度泵、自动进样器(带大体积进样组件)、柱温箱(带两位六通阀)、二极管阵列检测器(DAD)和荧光检测器(FLD);高纯水发生器(Direct 8,法国密理博公司);高速离心机(湖南湘仪实验室仪器开发有限公司)。
16种PAHs混合标准品包括萘(NAP)、苊烯(ACL)、氢苊(ACE)、芴(FLU)、菲(PHE)、蒽(ANT)、荧蒽(FLT)、芘(PYR)、苯并[a]蒽(B(a)A)、屈艹(CHR)、苯并[b]荧蒽(B(b)F)、苯并[k]荧蒽(B(k)F)、B(a)P、二苯并[ah]蒽(DBA)、苯并[ghi]苝(BPY)、茚[1,2,3-cd]芘(IND),质量浓度均为200 mg/L,购自美国AccuStandard公司;乙腈和甲醇(色谱纯)购自德国默克公司。
1.2 实验条件
1.2.1标准溶液的配制
取16种PAHs混合标准品,用甲醇逐级稀释,分别得到0.04、0.4、4.0和16 μg/L的混合标准储备液;取一定量的混合标准储备液,加入6 mL洁净矿泉水和4 mL甲醇,分别配制1.0、5.0、10、20、40、80和200 ng/L的混合标准工作液。
1.2.2样品前处理
取10 mL水样,置于聚丙烯离心管中,以10 000 r/min离心10 min,去除悬浮颗粒物,移取6 mL上清液,加入4 mL甲醇,混匀,取一定体积的混合溶液,置于10 mL棕色进样小瓶中,待分析。
1.2.3在线固相萃取-液相色谱分析
在线固相萃取条件:Acclaim PA II固相萃取小柱(50 mm×4.6 mm, 3 μm,美国赛默飞世尔科技公司);进样体积为2 mL;流动相为(A)二次去离子水和(B)乙腈。泵梯度条件为0~3 min, 5%B, 1 mL/min; 3~25 min, 100%B, 0.4 mL/min; 25~34 min: 5%B, 0.4 mL/min。在线固相萃取六通阀切换示意图见图1,六通阀切换条件为0~3 min时,六通阀为1-6位(position A); 3~6 min时,六通阀切换至1-2位(position B); 6~34 min时,六通阀切回至position A。

图 1 在线固相萃取的六通阀切换示意图Fig. 1 Six-way valve switch schematic diagram of online SPEPosition A: sample loading, SPE column balance and detection; position B: SPE column elution.
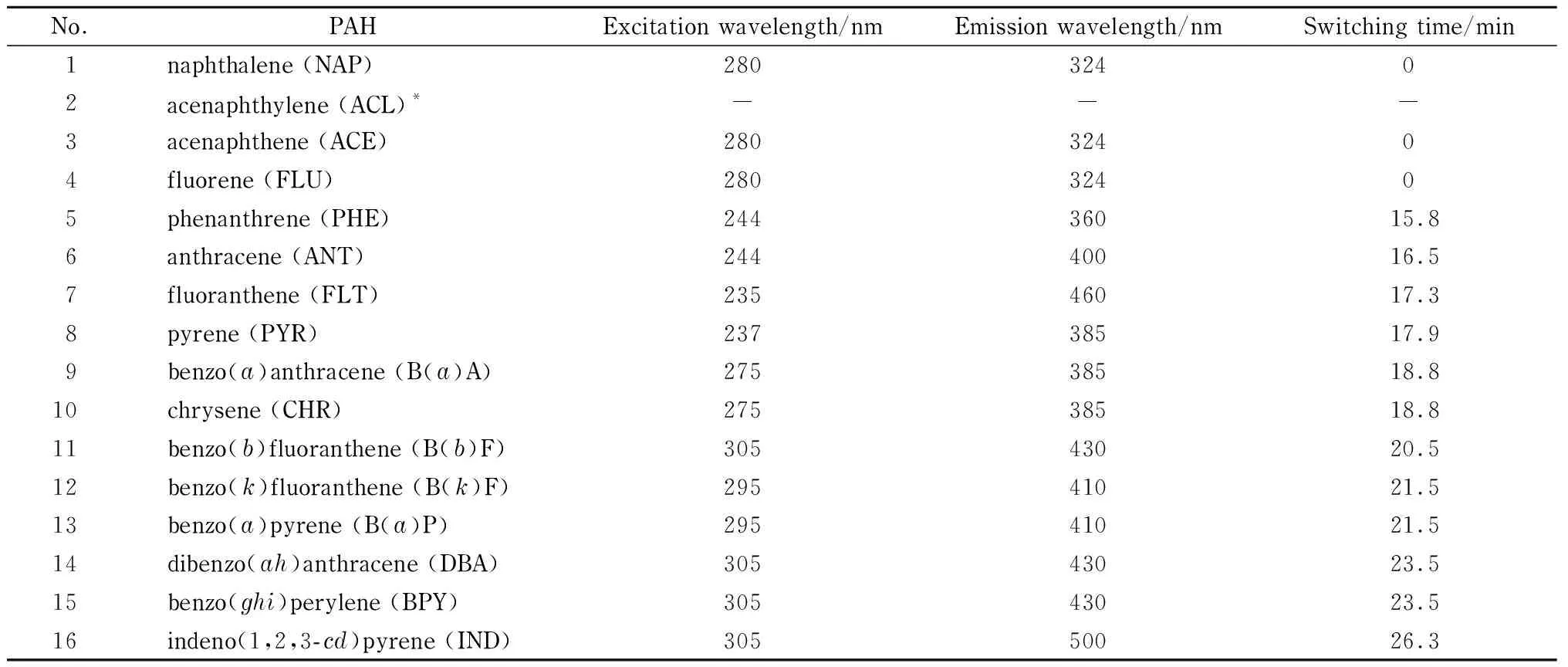
No.PAHExcitation wavelength/nmEmission wavelength/nmSwitching time/min1naphthalene (NAP)28032402acenaphthylene (ACL)*---3acenaphthene (ACE)28032404fluorene (FLU)28032405phenanthrene (PHE)24436015.86anthracene (ANT)24440016.57fluoranthene (FLT)23546017.38pyrene (PYR)23738517.99benzo(a)anthracene (B(a)A)27538518.810chrysene (CHR)27538518.811benzo(b)fluoranthene (B(b)F)30543020.512benzo(k)fluoranthene (B(k)F)29541021.513benzo(a)pyrene (B(a)P)29541021.514dibenzo(ah)anthracene (DBA)30543023.515benzo(ghi)perylene (BPY)30543023.516indeno(1,2,3-cd)pyrene (IND)30550026.3
*ACL was detected by UV detector.
液相色谱条件:色谱柱为Hypersil Green PAH分析柱(150 mm×3 mm, 3 μm,美国赛默飞世尔科技公司);柱温为20 ℃;流动相为(A)二次去离子水和(B)乙腈;流速为0.6 mL/min。梯度洗脱程序为0~10.0 min, 50%B; 10.0~17.0 min, 50%B~100%B; 17.0~27.0 min, 100%B; 27.0~27.1 min, 100%B~50%B;27.1~34.0 min, 50%B。紫外检测波长为220 nm。荧光检测条件见表1。
2 结果与讨论
2.1 在线固相萃取条件的优化
选择含有Acclaim Polar Advantage Ⅱ C18填料的固相萃取小柱富集水中的PAHs。该固相萃取小柱填料嵌合有极性基团,可兼容100%水相,保证使用寿命。实验比较了2种填料粒径均为3 μm的固相萃取小柱(50 mm×4.6 mm和33 mm×3.0 mm)的萃取效果。结果显示,采用50 mm×4.6 mm规格的固相萃取小柱时,PAHs的峰形较采用33 mm×3.0 mm时好,且考虑到50 mm×4.6 mm规格的固相萃取小柱的柱容量更高,可以萃取更高浓度的PAHs,因此选择50 mm×4.6 mm规格的固相萃取小柱。
实验比较了采用50%(v/v)乙腈水溶液洗脱时,不同洗脱时间(3、5和7 min)的洗脱效果。结果显示,在3种洗脱时间下,PAHs信号响应没有显著差异,说明经过3 min的洗脱,PAHs已从固相萃取小柱上完全洗脱。因此选择洗脱时间为3 min。
2.2 检测条件的优化
在优化的流动相洗脱条件下,实验比较了3种色谱柱对16种PAHs的分离情况,3种色谱柱分别为Hypersil Green PAH (150 mm×3 mm, 3 μm,美国赛默飞世尔科技公司)、Waters PAHs C18(250 mm×4.6 mm, 5 μm,美国Waters公司)和Waters BEH Shield RP18(150 mm×2.1 mm, 1.7 μm,美国Waters公司)。结果显示,采用Waters BEH Shield RP18色谱柱时,低环PAHs的峰形较差,推测是因为色谱柱的死体积较小,初始流动相乙腈的比例过高,通过降低初始流动相乙腈的比例依然无法改善色谱峰形;采用Waters PAHs C18色谱柱时,PAHs的峰宽相对较大,峰高相对较小,灵敏度较低;采用Hypersil Green PAH色谱柱时,PAHs的峰形尖锐,色谱响应较强,因此选为实验所用。
苊烯没有荧光信号,在220 nm波长下进行紫外检测,而其余15种PAHs具有较强的荧光响应信号,可通过荧光检测实现高灵敏分析。实验比较了标准方法HJ 647-2013、HJ 478-2009和文献[6]方法的荧光检测条件,结合PAHs的出峰情况,确定了PAHs的荧光检测条件(见表1)。
经过色谱条件的优化,实现了16种PAHs的基线分离和高灵敏检测,在线固相萃取-液相色谱分析过程仅需37 min。PAHs(200 ng/L)标准工作液的荧光检测图(除ACL)见图2。
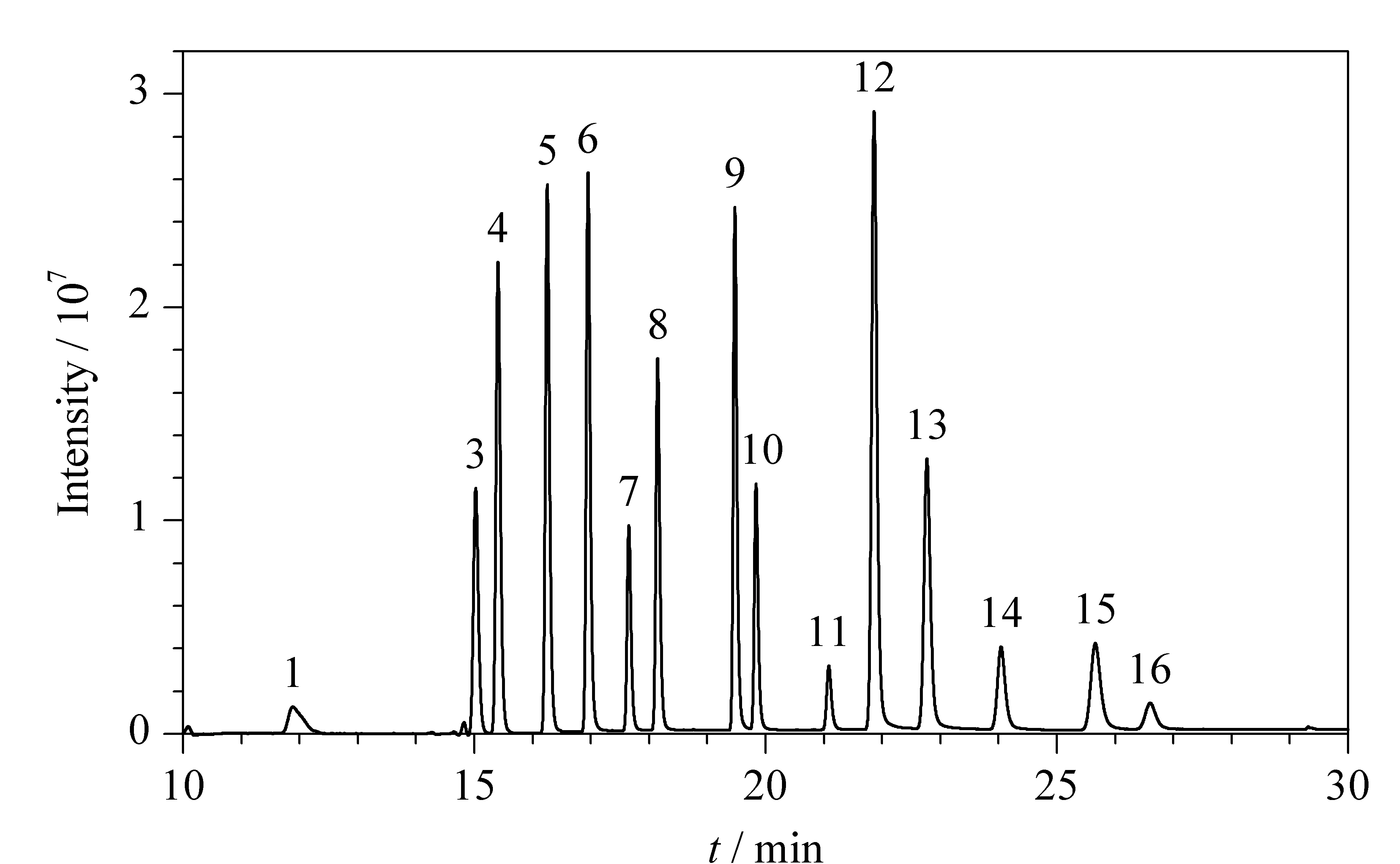
图 2 15种PAHs(200 ng/L)的荧光检测图Fig. 2 Chromatogram of the 15 PAHs (200 ng/L) by fluorescence detector ACL was detected by UV 220 nm with the retention time of 13.58 min. Peaks 1-16 were the same as that in Table 1.
2.3 前处理条件的优化
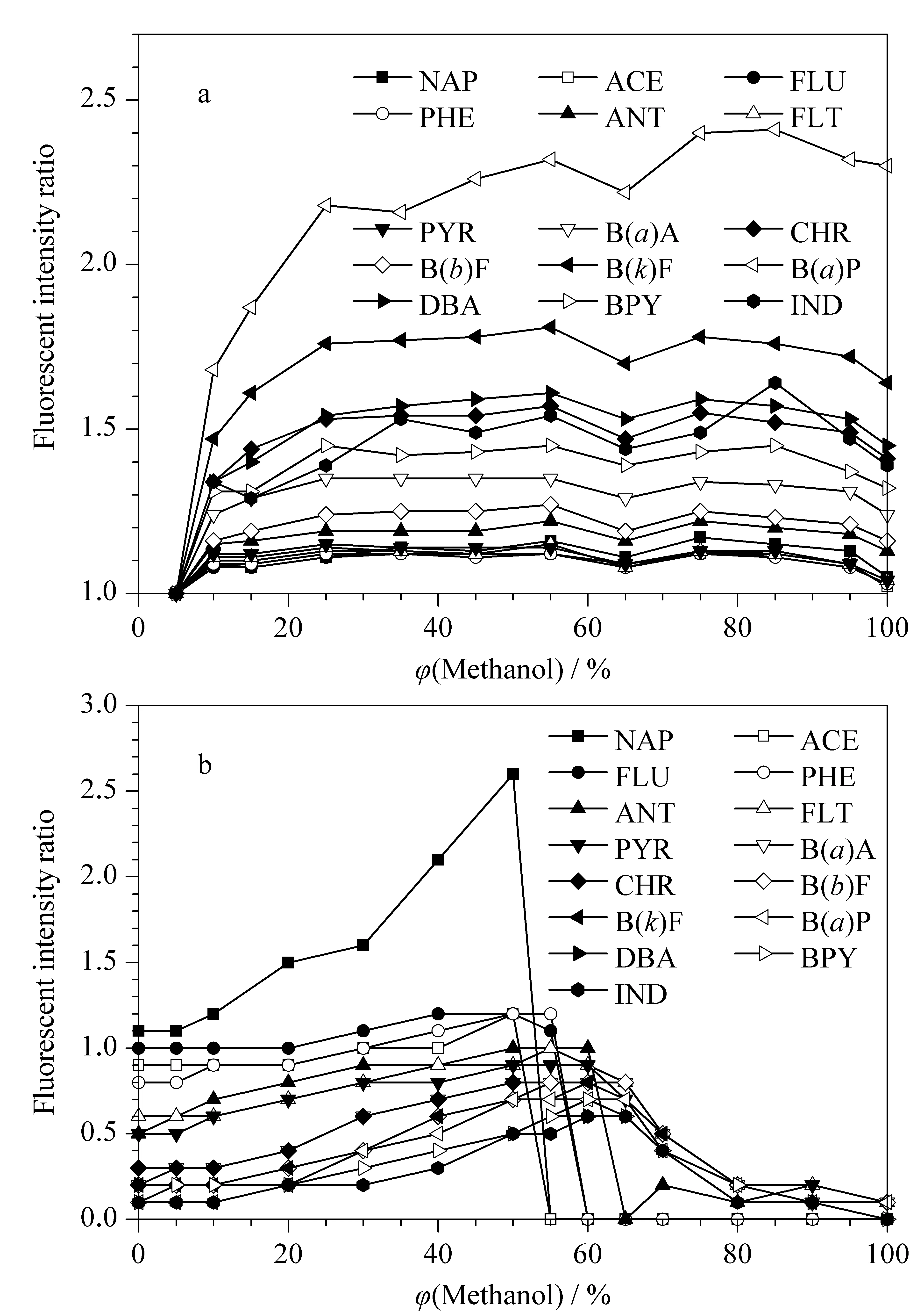
图 3 不同体积分数的甲醇对15种PAHs信号响应的影响Fig. 3 Effect of volume fraction of methanol on the fluorescent intensity of the 15 PAHs a. direct LC analysis without SPE; b. online SPE-LC analysis.
由于PAHs在水中的溶解度不高,尤其是高环PAHs,其溶解度较低,因此配制PAHs混合标准工作液时需在水中加入一定量的有机溶剂,促进PAHs溶解。采用含有不同体积分数甲醇的水溶液对PAHs标准溶液进行稀释,未经在线固相萃取,直接进行液相色谱分析,考察15种PAHs(不含ACL)的荧光信号响应强度(见图3a)。结果显示,甲醇的体积分数对NAP、ACE、FLU、PHE、ANT、FLT和PYR的信号响应影响不显著,对B(a)A、CHR、B(b)F、B(k)F、B(a)P、DBA、BPY和IND的信号响应有较大影响,其信号响应随甲醇体积分数的增加而增强,尤其是对B(a)P的影响最为明显;当甲醇的体积分数达到35%时,PAHs的信号总体上达到最大响应强度,说明PAHs得到充分溶解。
甲醇的体积分数除了影响标准工作液或加标样品配制时PAHs的溶解度,还会影响PAHs在固相萃取小柱上的保留情况。水样中甲醇的体积分数过高会使PAHs无法在固相萃取小柱上聚焦和保留,从而影响PAHs的峰形和回收率。配制含不同体积分数甲醇的PAHs(80 ng/L)加标水样,对15种PAHs(不含ACL)的信号强度进行归一化处理,比较其经在线固相萃取后的响应信号(见图3b)。结果显示,随着水样中甲醇体积分数的增加,ACE、FLU和PHE信号响应强度保持稳定(NAP峰形变差导致信号响应增加异常),当甲醇的体积分数达到50%时,这4种PAHs的色谱峰形较差,影响定量分析,继续增加甲醇的比例,4种PAHs的信号响应依次消失,说明它们未保留在固相萃取小柱上;而其余11种PAHs的信号响应强度随着甲醇体积分数增加而逐渐增加,当甲醇体积分数增加至55%时,11种PAHs达到最大信号强度,其中B(a)P信号响应强度增加到10倍以上,随着甲醇体积分数的继续增加,11种PAHs信号响应强度逐渐降低,说明11种PAHs在固相萃取小柱上的保留逐渐减小。
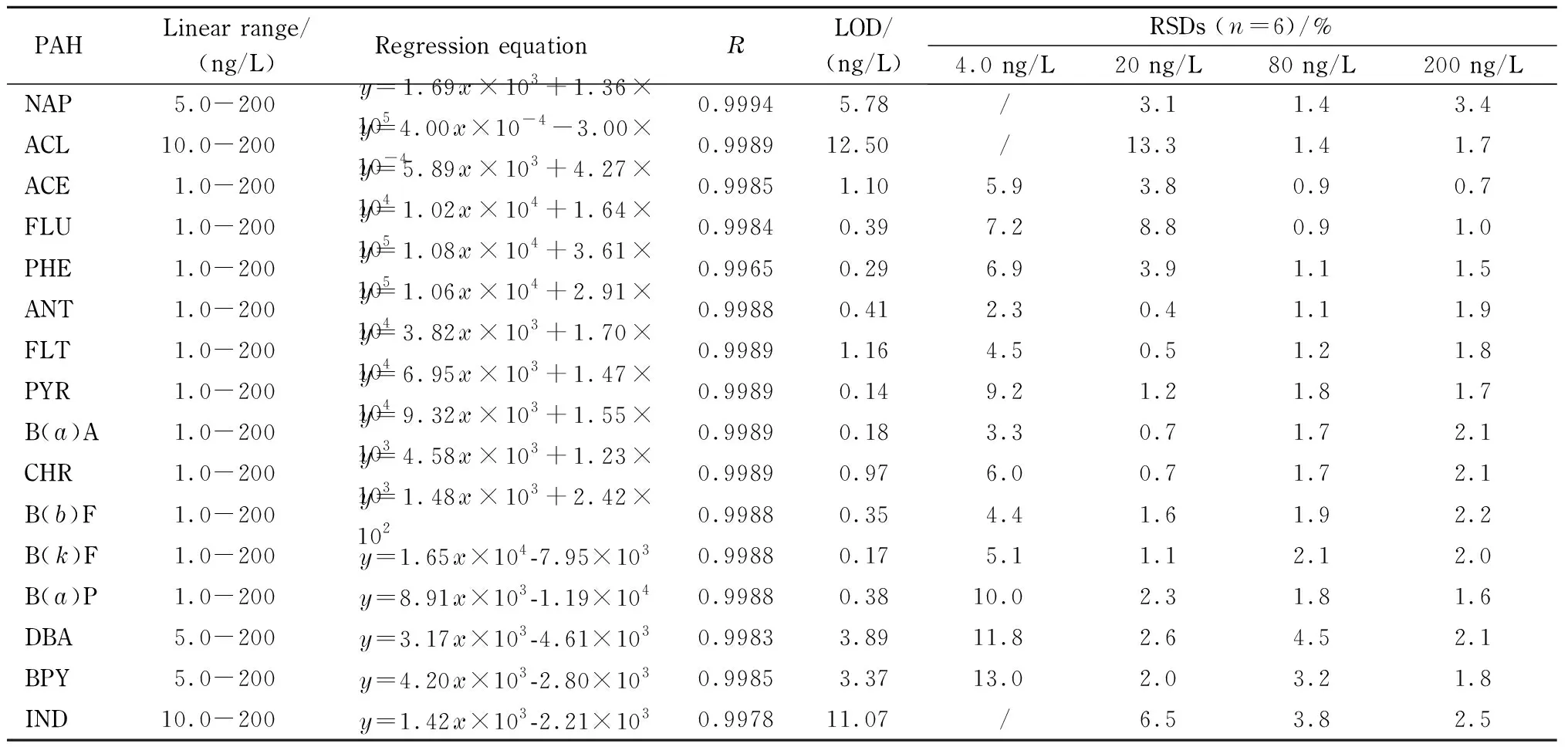
表 2 16种PAHs的线性范围、回归方程、相关系数、检出限和相对标准偏差
y: peak area;x: mass concentration, ng/L; /: no data.
综合考虑标准工作液的配制和实际水样的固相萃取,将甲醇的体积分数统一为40%。
为查看不同水样中PAHs的荧光信号强度,选取了4种类型的水样(二次去离子水、矿泉水、自来水、河流水),加入一定量的PAHs混合标准工作液和甲醇,得到含20 ng/L PAHs和40%(v/v)甲醇的水样溶液。比较4种水样中15种PAHs(不含ACL)信号响应强度的差异。结果显示,矿泉水、自来水和河流水中PAHs的荧光信号强度差异较小,但均高出二次去离子水信号强度的20%,其中B(a)P荧光信号强度高出近100%。推测由于水样中的离子对PAHs荧光信号有显著增强作用,二次去离子水中离子浓度远低于矿泉水、自来水和河流水。因此实验采用与实际水样类似的洁净矿泉水配制标准工作液,以降低系统误差,提高检测灵敏度。
2.4 方法学评价
对不同质量浓度(1.0、5.0、10、20、40、80和200 ng/L)的PAHs标准工作液进行分析,每个浓度水平重复分析2次,对PAHs的平均峰面积和相应的质量浓度进行线性拟合,得到标准工作曲线。如表2所示,16种PAHs在各自范围内呈良好线性,线性相关系数(R)均大于0.996。
对低浓度的PAHs标准工作液进行分析,并根据1.2.2节对实际水样的前处理操作,以3倍信噪比(S/N=3)对应的浓度乘以系数1.67获得方法的检出限。结果表明,16种PAHs的检出限为0.17~12.50 ng/L,其中B(a)P的检出限为0.38 ng/L,低于现行国家标准规定地表水(GB 3838-2002)和饮用水(GB 5749-2006)中B(a)P的限量值(2.8 ng/L和10 ng/L)。
分别配制质量浓度为4.0、20、80和200 ng/L的 PAHs标准工作液,重复进样6次,考察方法的重复性(见表2)。结果显示,16种PAHs在4.0、20、80和200 ng/L下的RSD分别为2.3%~13.0%、0.4%~13.3%、0.9%~4.5%和0.7%~3.4%(见表2),说明方法的重复性良好。
2.5 实际水样分析
分别采集某城市自来水、河流水和湖泊水,采用优化的方法进行分析。结果显示,在3种类型的水样中只检测出萘、氢苊、芴和菲,含量分别为54.8~69.7 ng/L、9.9~12.3 ng/L、13.6~19.5 ng/L和16.1~28.2 ng/L。
对湖泊水样进行了10、40和200 ng/L3个水平的加标回收试验,结果见表3。在10、40和200 ng/L加标水平下,16种PAHs的回收率分别为76.1%~99.5%、90.7%~115.6%和107.0%~134.9%, RSD分别为0.3%~16.6%、0.4%~9.7%和0.3%~0.9%(n=3)。
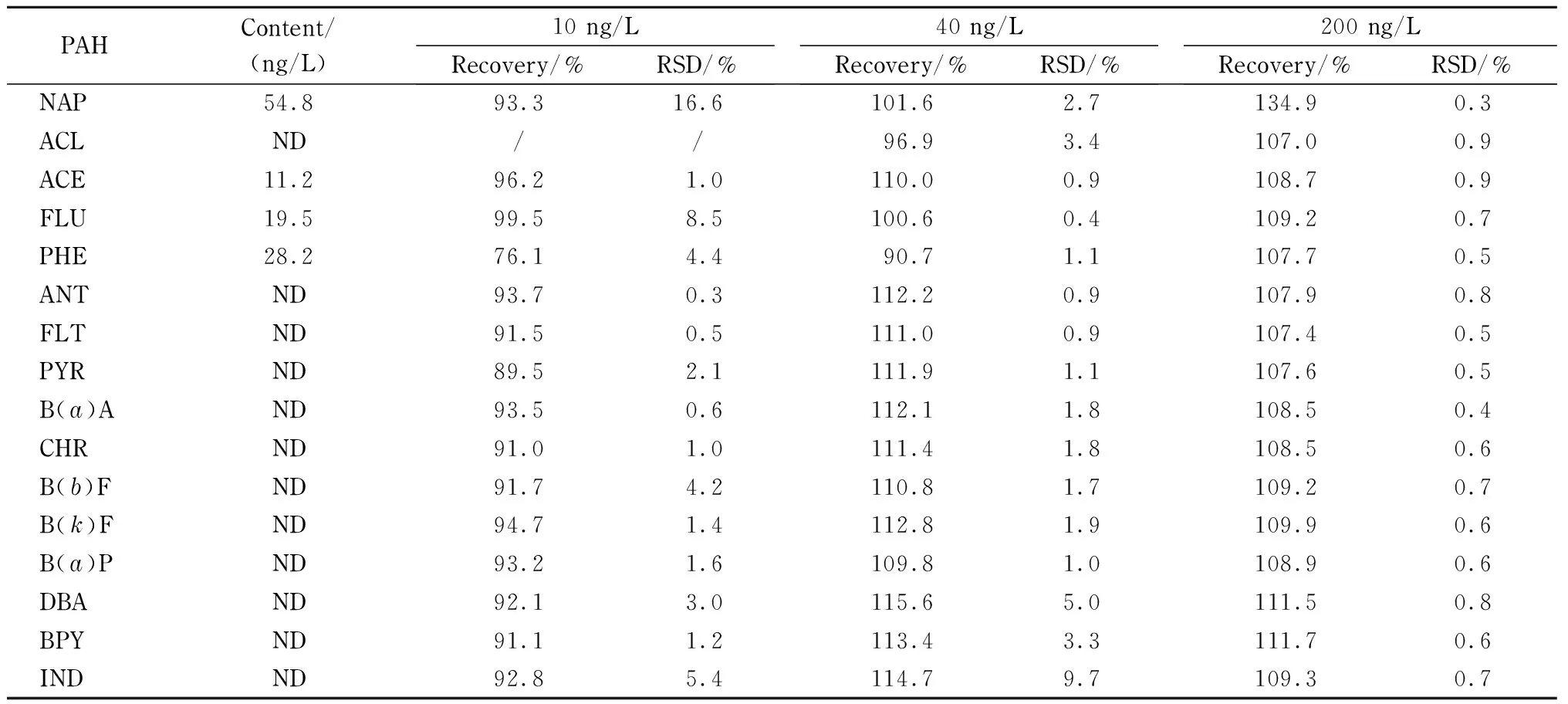
表 3 实际水样中16种PAHs的含量和加标回收率(n=3)
ND: less than LOD; /: no data.
为进一步考察该方法对含更低水平PAHs的实际水样的分析性能,尝试开展1 ng/L的加标回收试验。由于实际水样中存在部分含量相对较高的PAHs,并且部分PAHs的检出限相对较高,所以最后得到了B(a)A、CHR、B(b)F、B(k)F和B(a)P等5种PAHs的有效结果,加标回收率为62.5%~99.2%, RSD为1.4%~9.1%,其中B(a)P的加标回收率为71.8%~92.7%, RSD为3.9%,表明该方法适用于低浓度B(a)P的分析测试,可有效满足实际分析要求。
2.6 与其他方法的比较
水样中超痕量PAHs的分析需要较高的富集倍数才能达到满意的检出限。HJ 478-2009方法采用离线固相萃取方法富集水体中16种PAHs,所需水样10 L,固相萃取上样时间为33.3 h,富集倍数为20 000倍。陈静等[9]开发的在线固相萃取分析方法中B(a)P的检出限为35 ng/L。通过比较可以看出,本方法方便简单,耗时短,灵敏度高,可有效满足对水中超痕量PAHs的测定要求。
3 结论
本文建立了测定水中16种PAHs的在线固相萃取-液相色谱分析方法。该方法具有操作简便快速、节省溶剂、对人体毒害性小、方法稳定、灵敏度高、能有效降低背景污染等特点,可满足各类水体质量标准中PAHs,尤其是B(a)P的超痕量监测分析的要求,具有较大的实际应用前景。