《科学》2018年度十大科学突破
编译 方陵生
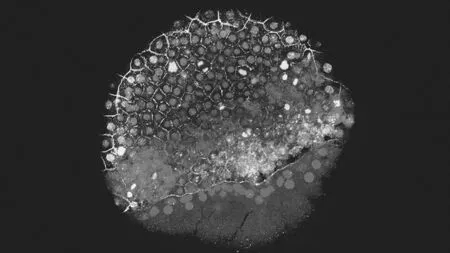
处于早期发育阶段的斑马鱼胚胎。荧光标记突出显示了决定成熟细胞类型的基因表达
新技术追踪细胞发育细节
科学家正在通过三种新技术追踪胚胎发育令人惊讶的细节。
从被称为“医学之父”的希腊名医希波克拉底的时代开始,生物学家就为一个细胞是如何发育成为拥有多个器官和数十亿细胞的成年动物而感到非常神奇和困惑。古希腊生物学家曾认为,是母亲呼吸时的湿气帮助细胞成长为婴儿,但现在我们知道,是DNA导致了细胞的增殖和分化过程。正如弦乐、铜管乐器、打击乐和木管乐器要依据乐谱来合奏一曲交响乐一样,如今多种生物技术正在揭示单个细胞是如何协同合奏出这样的“交响曲”的,包括基因会在何时开启,并如何提示细胞发挥它们各自的专门功能等等,通过各种新技术,科学家能够跟踪生物体和器官随着时间推移的变化,观察一个个细胞成长发育过程中的惊人细节。
推动这些进展的多项技术包括从活的生物体中分离出数千个完整细胞,对每个细胞中表达出来的遗传物质进行有效测序,通过计算机技术或对细胞进行标记来重建它们在空间和时间上的联系。这三项技术“将改变未来十年的研究”,德国柏林马克斯-德尔布吕克分子医学中心系统生物学家尼古拉斯·拉耶威斯基(Nikolaus Rajewsky)说道。
正是通过这种被称为单细胞测序(single-cell RNA-seq)的技术组合,细胞发育在过去几年里取得了显著的研究进展,并且于2017年出现了一个重要的转折点,当时有两组研究人员的研究表明,这项技术可发展到足以追踪细胞的早期发育。其中一组使用单细胞RNA-seq技术,对从果蝇胚胎中一次性提取的8 000个细胞的基因活性进行了测量;大约在同一时候,另一个研究小组对秀丽隐杆线虫幼虫的5万个细胞的基因活性进行了分析。研究数据表明,被称为转录因子的蛋白质,可引导细胞分化为特定的类型。
2018年,研究人员对脊椎动物胚胎进行了更广泛的分析。通过使用各种复杂的计算方法,他们将不同发育时间点采集的单细胞RNA-seq数据联系起来,揭示决定这些更复杂生物体形成不同细胞类型的一系列基因开启和基因关闭过程。一项研究揭示了斑马鱼的一个受精卵是如何形成25种不同类型细胞的,另一项研究对青蛙器官形成早期阶段的发育过程进行了监测,发现一些细胞开始专门化的时间比之前所认为的更早。“通过这些技术,解答了胚胎学中的一些基本问题。”哈佛大学干细胞生物学家伦纳德·佐恩(Leonard Zon)说道。
由于细胞必须从生物体中取出才能进行单细胞测序,仅凭这项技术是无法显示细胞是如何与相邻细胞相互作用或识别细胞后代的,但结合了将标记物植入早期胚胎细胞的技术,研究人员如今可以追踪活的生物体中的细胞及其后代的发育过程。一个研究小组成功地为早期胚胎基因中的各种遗传元素标上了不同颜色的荧光标记,这些荧光标记会随机进入细胞,为每个细胞谱系赋予不同的颜色。其他研究小组利用CRISPR基因编辑技术,用独特的条形码标识符为单个细胞基因组做上标记,这些标识会传递给它们所有的后代。基因编辑可以在保留原有突变的同时,在子代细胞中产生新的突变,科学家能够跟踪谱系分支和新的细胞类型形成的整个过程。
通过将这些技术与单细胞RNA-seq技术相结合,研究人员可以在监测单个细胞行为的同时,观察它们是如何融入生物体生长发育和构架演变展开过程的。利用这种方法,一个研究小组确定了斑马鱼大脑中100多种细胞类型之间的关系。研究人员使用CRISPR基因编辑技术标记早期胚胎细胞,分离出处于不同时间点的6万个细胞,然后对它们进行测序,跟踪斑马鱼胚胎发育过程中的基因活性。
其他研究小组也在应用类似的技术追踪器官、四肢或其他组织的发育过程,以及在这个过程中是如何出错并导致畸形或疾病的。
虽然这些技术不能直接用于人类胚胎发育的研究,但研究人员正在将其应用于人体组织和器官单个细胞基因活性的研究,并对细胞类型的特征进行描述。“人体细胞图谱”(Human Cell Atlas)计划在过去两年里一直致力于人体细胞的研究,识别每一种人体细胞类型,每一种类型在人体中的位置,以及这些细胞在形成组织和器官过程中的协同作用。目前,一项研究已识别出大部分肾脏细胞类型,包括那些容易癌变的细胞类型。另一项研究揭示了妊娠过程中母体和胎儿细胞之间的相互作用。欧洲53家研究机构和60家公司组成了一个名为“Life Time consortium”的组织,该组织提议利用单细胞RNA-seq技术进行多个方向的研究,以进一步理解随着机体组织向癌症、糖尿病和其他疾病发展的过程中,一个接一个的细胞究竟发生了什么。
关于细胞发育和疾病形成过程的“高分辨率影片”将越来越引人瞩目,网上发表的一些研究论文所涉已扩展到越来越复杂的生物体。研究人员希望未来能将单细胞RNA-seq技术与新的显微镜技术结合起来,以更细致地观察到每个细胞中独特分子的活动情况,以及邻近细胞的影响等。
单细胞革命方兴未艾,未来令人充满期待。
来自遥远星系的信使
来自遥远宇宙的信使加入了望远镜收集到光子的行列中,揭示了光所不能显示的东西,但这样的信使很罕见。“多信使天体物理学”始于被称为宇宙射线和引力波的高速粒子,这些粒子导致产生的时空涟漪,于2015年首次被探测到,并被《科学》杂志列为2016年度突破之首。2018年,另一个信使加入了这个行列:中微子,一种微小的、非常难以探测到的几乎没有质量的粒子。
中微子是星系外“将要消失的小精灵”,需要通过安置在南极地底下深处的光探测器来捕捉和记录中微子触发的微弱闪光——非常罕见的一种闪光,这个被称为冰立方的巨大探测器以前记录到许多中微子,其中一些来自银河系之外,但没有一个能确定其来自宇宙何处,2017年9月22日,一个中微子与冰中的一个原子核相撞,光传感器确定了它所来自的方向。
几天后,美国宇航局(NASA)的费米伽马射线太空望远镜在中微子来自的方向发现了一种被称为耀变体的强光源。耀变体是一个以超大质量黑洞为中心的星系的中心,它通过重力加热环绕它旋转的气体,导致其星际物质发出明亮的光芒,并从极度混乱的大漩涡中向外喷射粒子流。

研究人员可以肯定,探测到的爆发的耀变体正是中微子的来源,这是中微子望远镜首次发现的银河系外的中微子来源,这一发现不仅仅是证明了中微子的来源,产生伽马射线和中微子的耀变体也可能产生其他高能粒子,比如质子。这些超高能量的宇宙射线不时地轰击地球,但它们的来源一直成谜,现在,耀变体是最有可能的推测对象。
冰立方体团队正在等待更多稍纵即逝的银河系外信使的驾临,在迎来了这第一个星系外访客之后,该团队正在为部署一个体积是当前冰立方体10倍的探测器做准备。
确定分子结构变得更简单易行

电子显微镜载片上看到的分子结构。如今科学家可以利用微米大小的晶体(黑色)来确定分子结构
2018年10月,两个研究团队同时发表论文,公布了一种可在短短几分钟内确定有机小分子化合物结构的方法,传统方法需要几天、数周甚至好几个月的时间。
几十年来,绘制分子图谱的标准方法一直是利用一项被称为X射线晶体学的技术,先将一束X射线射向含有数百万个向同一个方向排列分子拷贝的晶体,然后,研究人员通过跟踪X射线从晶体上反弹的路径,识别单个原子以及在分子中的位置。分子结构对于理解生物分子的行为以及药物与它们的相互作用,其价值是无可估量的,但这项技术需要让晶体生长至一粒沙子的大小,对于一些物质来说,这可能是一个很大的障碍。
近年来,研究人员改进了衍射技术,用电子束代替X射线。电子束对准目标生物分子的片状二维晶体,通常是蛋白质。但在某些情况下,这些薄片会相互叠加在一起,形成一种三维晶体,普通的电子衍射对这样的晶体不起作用。
两个研究小组——一个来自美国,另一个来自德国和瑞士——发现他们可以使用这种意外产生的晶体,他们向旋转台上一个微小的3D晶体发射了一束电子束,跟踪衍射模式如何随着每一个微小的旋转发生的变化,利用这项技术可在几分钟内生成分子结构图,而其所需要的微小晶体只有X射线所需大小的十亿分之一。
这项新技术非常适合绘制一些小分子的结构图谱,如激素和潜在的药物,对从新药发现与合成,到设计用于研究和跟踪疾病的分子探针等都将产生深远影响。
冰河时代小行星撞击对地球气候的影响
这颗小行星像核弹一样猛烈撞击格陵兰岛西北部,瞬间将岩石蒸发,产生的冲击波波及整个北极地区,在地球上留下一个巨大的“疤痕”:一个被称为海华沙的31公里宽的撞击坑。飞机雷达在1公里厚的冰层下发现了这个撞击坑,2018年11月科学家报告了这一惊人发现。
海华沙是地球上最大的25个陨石坑之一,尽管其威力不能与6 600万年前杀死恐龙的希克苏鲁伯陨石坑相比,但海华沙陨石的撞击可能对全球气候产生了很大影响,撞击导致大量冰雪融化后涌入北大西洋,阻止了给欧洲西北部带来温暖的洋流传送带,导致气温骤降。
雷达图像显示海华沙陨石坑可以是比较新的,可追溯至10万年前。陨石坑深层冰层的扰动迹象表明,最近估计时间可能在1.3万年前,这次撞击与新仙女木事件可能有所联系,即上一个冰河时代解冻期持续升温过程中的一次突然降温,持续了千年之久的一次全球降温事件。
这次撞击的具体时间一直未能确定。格陵兰岛其他地方记录了过去10万年历史的冰芯样本未能发现小行星撞击留下的碎片。确切答案将取决于更多艰苦卓绝的工作,包括对冰层下的微小矿物晶体中的放射性年代进行普遍广泛的测量等。
如果借此能证明海华沙陨石撞击确实发生在13 000年前,那么这一事件与人类横扫新大陆、追逐北美乳齿象的时期相吻合。可以想象得到,当时的人类仰望天空中灼热的白色球体发出比太阳还要亮四倍的耀眼光芒时,会是如何的震惊。

小行星碎片落向格陵兰岛的计算机可视化图像
科学界性骚扰现象引起关注
2018年6月,美国国家科学院、工程院和医学院发布了一份具有里程碑意义的报告,内容涉及科学、工程和医学领域内对女性的性骚扰,这份报告或将成为一个分水岭。根据来自两所大型高校系统的最新统计数据,该研究得出结论称,超过50%的女性教职员工和20%至50%的女性学生,其职业生涯的不同阶段和所从事的不同的科研领域,都曾遭受过性骚扰,包括最普遍的形式——言语和非言语的性别歧视和敌意:遭到贬低,而不是受到引诱。多个研究机构对此采取了相应的行动。
一些研究机构在新闻事件曝光或受骚扰学生和员工提起正式诉讼的推动之下,有多位知名科学家在经调查证实了对其不当行为的指控后,被解雇或迫使其离开其所在的研究机构,另外一些研究宣布了关于这方面的一些政策变化。
9月,美国国家科学基金会(NSF)主任弗朗西·科尔多瓦(France C ó rdova)表示,在基金受助人接受性骚扰调查或者被发现犯有性骚扰罪期间,高校必须向资助者说明此人何时被暂停工作。同时,受调查者要接受来自NSF的“有针对性的严重后果”。
为社会未能保护性骚扰受害者而感到悲哀的科尔多瓦宣称,“这种对性骚扰极为忽视的现状必须结束。”同月,美国科学促进会(AAAS)通过了一项政策,根据这项政策,被证实为性骚扰者的美国科学促进会会员将被剥夺终身荣誉。2018年5月,美国国家研究院承诺将研究如何剥夺那些已被证明有骚扰行为者的显赫地位。

科学界对性骚扰的报道一直很少,而且基本上是被忽视的一个问题,但有迹象表明,这种情况将有所改变
对于批评者来说,改革的步伐还远远不够快。如范德堡大学神经系统科学家贝萨恩·麦克劳林(BethAnn McLaughlin)指出,美国国立卫生研究院(NIH)不要求大学报告因性骚扰而接受调查的受资助人,甚至不要求大学对其进行纪律处分。麦克劳林在一次公开演讲之前静默了46秒钟,她用这段静默时间“纪念从我们的领域内被赶出的数百名女性”。她在演讲中还指出,NIH每年向科学家和医生提供资金,却不询问他们是否违反了1972年提出的禁止性骚扰学生的相关法律条款。
发现远古人类“混血儿”
一块来自一位生活在5万多年前女性的骨头碎片揭示了两种已灭绝古人类之间的惊人联系。2012年在西伯利亚的一个洞穴中发现的这块骨头中提取的古代DNA显示,这名女子的母亲是尼安德特人,父亲是丹尼索瓦人。
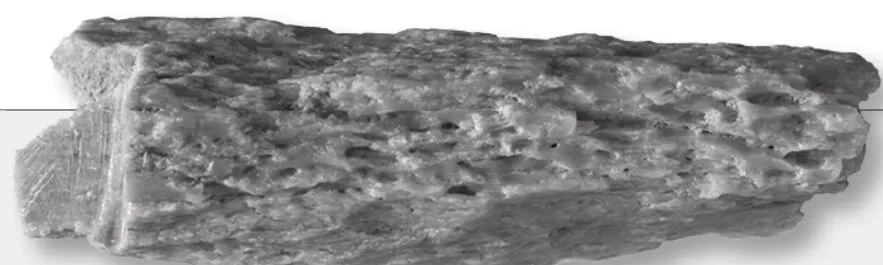
在俄罗斯丹尼索瓦山谷的一个洞穴里发现的一块骨头碎片
德国莱比锡马克斯·普朗克进化人类学研究所的研究人员对骨头的DNA进行测序后发现,这块骨头来自一名女性,她的基因组中包含了丹尼索瓦人和尼安德特人的基因,有可能因为她的父母本身是混血儿。但她的染色体对中包含了她将近一半基因的不同变体,即所谓的杂合等位基因,表明母系和父系染色体来自不同的人种。她的线粒体DNA几乎完全遗传自属于尼安德特人的母亲,因此研究人员得出结论认为,她是男性丹尼索瓦人和女性尼安德特人的第一代杂交后代。对基因组的进一步研究表明,她的父亲也有部分尼安德特人祖先的基因。
在另一项有说服力的发现中,这名女性的尼安德特人基因更接近于在克罗地亚发现的尼安德特人的基因,而不是更早居住在丹尼索瓦洞穴的尼安德特人的基因。研究论文的作者认为,这表明不同的尼安德特人群体曾多次在西欧和西伯利亚之间来回迁徙。显然,通过这样的迁徙过程,他们将自己的基因传播到了外界。但为什么丹尼索瓦人和尼安德特人仍然始终保持了他们各自的基因独特性?地理上的障碍可能起到了一定作用,但研究人员需要从不同地点获得更多的古代DNA,才能了解史前人类不同人种之间杂交的真正影响。
法医系谱学时代来临
2018年4月,美国警方宣布逮捕了历史上最残忍的杀人案件之一的金州杀人案的嫌疑人,20世纪70年代至80年代在加州发生的一系列强奸和谋杀事件之谜团终于尘埃落定,悬案告破是取得的一个惊人进展,而调查人员指认“金州杀手”的方式同样也令人眼界大开。他们将从一个犯罪现场提取的DNA档案上传到一个公开的DNA系谱数据库,通过发现嫌疑人的几个远亲,最终锁定了此案罪犯。此后,执法机构利用这一策略破获了约20起其他悬案,从而开创了一个新的领域:法医系谱学。

“金州杀手”约瑟夫·詹姆斯·迪安杰洛
像Ancestry和23andMe这样的私人DNA网站包含了数以百万计的个人资料,这些资料可以用来从共享的DNA片段中找到某个人的亲属,但警方需要拥有法庭指令才可以搜索这些资料。在“金州杀手”一案中,当局求助于一个名为GEDMatch的简单公开的在线数据库,任何人都可以向该数据库提交DNA检测结果。GEDMatch由德克萨斯州和佛罗里达州的两名业余系谱学家运营。调查人员将一份DNA档案上传到这个网站的数据库中,找到了犯罪嫌疑人的几个远亲,于是他们与一位系谱学家合作,利用公共记录建立了庞大的家族谱系,最终将目标锁定在了73岁的约瑟夫·詹姆斯·迪安杰洛(Joseph James DeAngelo)身上。测试显示犯罪现场的DNA与迪安吉洛留在汽车门把手和丢弃纸巾上的DNA都相匹配,由此锁定了此案的犯罪嫌疑人。
2018年秋天有遗传学家的报告称,60%的欧洲裔美国人在一个拥有100万个样本的数据库中会有一个第三代表亲或亲缘关系更接近的表亲,这个数据库的规模与GEDMatch差不多大,欧洲裔美国人占了这个网站用户的大多数。一旦这个数据库中的档案样本达到300万份,90%以上的白人个体就都可以通过类似的方法被搜索找到,哪怕他们本身从未做过DNA测试。但所有这些也让一些伦理学家和遗传学家感到担忧,他们担心对家族性遗传基因的搜索是否会构成对个人隐私的侵犯,甚至有可能会导致对嫌疑人的错误指认。
基因沉默药物获得批准
2018年,一种基于基因沉默机制的RNA干扰(RNAi)药物获得了监管机构的批准,跨出了期待已久的一步,这可能预示着针对致病基因的新一类药物即将问世。
20年前,两名美国遗传学家发现,短RNA分子可以附着在信使RNA上,从而中断基因的转换,这一进展为他们赢得了诺贝尔奖,但将其转化为药物的努力很快遇到了障碍。科学家们试着要让这些脆弱的RNA分子保持完整,并将其导向正确的组织,但结果一直不理想。直到2008年,位于马萨诸塞州坎布里奇的Alnylam制药公司的研究人员认为他们找到了解决方案:一种脂质纳米颗粒可以用来保护基因沉默的RNA并将其运送至肝脏,并有望能在那里通过阻断错误折叠蛋白质的产生来治疗一种被称为遗传性转甲状腺素蛋白淀粉样变性的罕见疾病,这种错误折叠蛋白质会导致心脏和神经损伤。
Alnylam研发总裁阿克谢·瓦伊什诺(Akshay Vaishnaw)表示,“我们以极大的热情迅速开发了这种药物。”但这种新的纳米颗粒未能释放足够多的RNA到肝细胞中,没有达到在所有患者体内有效敲除问题基因的效果。一种更有效的配方在人体试验中发挥了作用,并开发研制成为静脉注射药物Onpattro,该药物2018年获得了美国和欧盟监管机构的批准并进入市场。
研究另一种RNA小分子的以色列发育生物学家弗兰克·斯莱克(Frank Slack)说道,随着2016年基于基因沉默机制的RNAi药物的获批,许多RNAi研究人员现正将研究重心转移到一种新的药物传递方法上:将化学性能稳定的RNA连接到一种以肝脏为导向目标的糖分子上。Alnylam也已开发出一种类似方法,可针对肝脏以外的组织,如眼睛和中枢神经系统,让RNA在某些组织(包括心脏)中积累起来是一个挑战,但Alnylam的成功已为解决这个难题“打开了闸门”,斯莱克说。

短RNA分子附着在信使RNA上,阻止其转换为蛋白质
进入原始世界的“分子窗口”

狄更逊水母化石中所含有的胆固醇样分子的痕迹,这种分子是动物生命的标志
2018年,科学家从生活在5亿多年前的生物身上发现的分子痕迹,让他们对孕育了地球上最早的一些动物的神秘世界的埃迪卡拉生物群认识变得更加清晰,并将分子古生物化石的年代向前推进了数亿年。他们在一些已知最奇怪的动物化石中发现了脂肪分子的特征,这些神秘的生命形式被称为埃迪卡拉生物群,并且还发现了出现在化石纪录之前很久的海绵分子的证据。
70多年来,科学家一直对埃迪卡拉化石的形态感到困惑,它们有的像叶子或叶状体,有的看起来不像地球上曾经生活过的任何其他生物。这些生活在远古海洋中的生物是植物?还是动物?或者是消失了的完全不同的一种生命形式呢?
澳大利亚国立大学的研究人员想要知道,他们能否从一些特殊的化石中找到化学上的线索,这些化石虽然有5.5亿年的历史,但仍然保存着一层看上去像是有机物质的薄膜。这些化石来自俄罗斯西北部白海沿岸的一处悬崖,那里的岩石一直没有受到会抹去这些分子痕迹的高温高压环境的影响。
研究人员首先在一组名为Beltanelliformis的埃迪卡拉小型圆形化石上验证了这一观点,他们将岩石上的薄膜剥离下来,溶解后用气相色谱和质谱法寻找保存下来的有机分子。研究人员在2018年1月的报告中称,他们发现了高浓度的藿烷类化合物,这种分子痕迹的存在表明这些化石小球是曾经的蓝藻细菌群落。这一发现给了研究人员更多信心,他们开始尝试在狄更逊水母化石上使用这项技术,狄更逊水母是埃迪卡拉生物群最著名的物种之一。这块化石呈椭圆形,长约半米,酷似一块絮有棉花的浴垫。9月,研究小组报告称,狄更逊水母化石中含有胆固醇类分子的痕迹,这类分子是动物生命的标志。这一发现与其他一些证据吻合,所有这些证据表明埃迪卡拉生物群中至少有部分生物是最早出现在地球上的动物之一。
2018年10月,另一个研究小组在6.6亿至6.35亿年前的岩层中发现了今天只有海绵才有的分子痕迹,这一发现表明另一种动物生命形式海绵的进化,可能比发现的最古老的可识别的海绵化石早了1亿年。
“液-液相分离”与细胞自我管理
细胞内的各个组成部分是如何协同工作的?如何在正确的时间和地点行使其功能?生物学家逐渐意识到,这些问题的关键通常在于由蛋白质和RNA组成的液滴,但直到最近,他们才发现,这样的液滴在细胞中无处不在,它们组织协调细胞各部分的工作,但有时也会形成胶结状,导致细胞出现故障。
成千上万的蛋白质和其他分子聚集在细胞质中,细胞质是围绕细胞核的一种黏稠液体,它们之间经常相互碰撞,并发生反应,行使生命的任务,从分解营养物质到释放能量,再到废物循环等。从2009年开始,研究人员发现,许多蛋白质都会分离出或浓缩成离散的液滴,浓缩它们的含量,尤其是当细胞对压力做出反应时。这种“液-液相分离”类似于油醋在加醋沙拉酱中的“分层”现象,如今已成为细胞生物学中最热门的话题之一,越来越多的证据表明,“液-液相分离”促进了关键的生化反应,并且似乎是细胞各组成成分如何结合在一起的基本机制。
2017年发表在《自然》上的两篇论文显示,细胞核中的液状蛋白滴让基因组的某些部分的结构更紧凑,并让其中的某些基因“沉默”下来。2018年,《科学》上的三篇论文指出,液-液相分离甚至还发挥着更大的作用。他们发现,驱动遗传密码从DNA转变为RNA的蛋白质——制造新蛋白质的第一步——可以浓缩成附着在DNA上的液滴。其中的细节还有待于进一步探究,但这些研究揭示了这种液-液相分离是生命存在的一个基本奥秘,是基因的一种选择性表达。

由蛋白质和RNA组成的液滴是新发现的一种细胞组织形式
生物物理学家正在研究这些液滴是如何形成的。某些种类的蛋白质尾随着类似意大利面的尾部,这些尾部相互作用以触发浓缩反应。但如果这个过程出错,原本应该是液体的东西会变成凝胶,形成神经退行性疾病(如肌萎缩性侧索硬化症)中常见的那种凝聚体。3月份的一篇科学论文表明,当这些蛋白质被错误地从细胞核中排除时,就会发生这种情况。4月的《细胞》(Cell)杂志发表的4篇论文提出了溶解这些有毒物质可采取的一些措施,目前,几家实验室正试图利用这些知识来发现和开发治疗神经退行性疾病的药物。
资料来源 Science

