D手性肌醇对高糖导致氧化损伤线虫延缓衰老的作用及机制
王 慧,赵 江,杨胜楠,张晓寒,程 静,王 浩
(天津科技大学食品工程与生物技术学院,天津 300457)
肌醇是羟基环己醇,属于水溶性B族维生素,共有9种同分异构体[1],而D-手性肌醇(DCI)在自然界中广泛存在于荞麦、大豆等植物中,属于光学活性体的一种肌醇[2]。DCI具有降血糖、抗炎、抗癌、提高耐力等多种生物活性,有研究发现,在果蝇饮食中添加DCI可以显著延长果蝇的寿命[3],也有文献报道,一定剂量的DCI能够促进胰岛素抵抗HepG2细胞对葡萄糖的吸收[4]。但近年来,对于DCI的研究多在降血糖、抗衰老方面,对高糖膳食导致氧化损伤的机体延缓衰老的作用未见报道。
自由基学说认为,机体代谢过程中产生的大量ROS自由基能够导致细胞成分发生氧化损伤从而导致衰老。而机体在受到各种氧化应激的过程中会产生ROS自由基,ROS积累使氧化系统失衡,引起机体衰老[5]。在高脂环境中,生物膜成分更易受到自由基的攻击而发生过氧化损伤,从而使机体加速衰老[6]。而抗氧化剂可以清除体内多余的自由基,延缓氧化损伤。

表1 线虫抗衰老基因 mRNA 表达水平测定用 PCR 引物Table 1 PCR primers used to measure the mRNA expression levels of anti-aging genes in Caenorhabditis elegans
秀丽隐杆线虫是一种小型土壤线虫,其遗传信息与信号通路相对保守[7],生命周期短暂,适合短期内构建验证实验,而且线虫随着年龄的增加,会表现出行为迟缓,生理功能减退等现象。因此,秀丽隐杆线虫是研究衰老作用比较理想的模式生物[8]。
因此,本实验以秀丽隐杆线虫为实验模式生物,研究DCI对高糖氧化损伤的线虫延缓衰老的作用,观察其正常寿命变化并进一步研究其保护机制,为相关DCI的抗氧化产品开发应用提供科学依据。
1 材料与方法
1.1 材料与仪器
野生型秀丽隐杆线虫 北京生命科学研究所王晓晨研究员赠送;D-手性肌醇 上海诺金科生物科技有限公司(纯度 95%);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒 南京建成生物工程研究所;Trizol试剂、cDNA合成试剂盒和SYBR Green 宝生物生物工程有限公司。
HWS-850智能恒温恒湿培养箱 宁波海曙赛福实验仪器厂;UVmini-1240紫外/可见分光光度计 日本岛津公司;Real Time-PCR仪 美国BIO-RAD公司;倒置荧光显微镜 Olympus。
1.2 实验方法
1.2.1 线虫的培养 线虫基础NGM培养基的培养基成分参考文献[9];高糖培养基:在基础培养基中加入1%的葡萄糖。空白对照组线虫在基础NGM培养基中培养,高糖模型组线虫在高糖培养基中培养,实验组线虫则分别培养在添加0、5、10、20 μm/L的DCI的高糖培养基中。
1.2.2 油红O染色实验 将0.5 g油红O染料溶解于100 mL异丙醇中,配制成油红O溶液,将油红O溶液与蒸馏水以3∶2 (v/v)的比例混合,沉淀过滤后作为储备液备用。收集同期化线虫,按照寿命实验中的饲养方法培养。当线虫分别培养至10 d时,用PBS缓冲液冲洗收集线虫。线虫首先用多聚甲醛固定,-80 ℃下冷冻15 min后,于43 ℃水浴解冻,PBS冲洗3次后,用1% Triton X-100的油红O储备液浸泡30 min,PBS冲洗后,将空白对照组与高糖模型组线虫挑至1%浓度的琼脂糖凝胶上,于倒置荧光显微镜下观察脂滴含量并拍照[10]。
1.2.3 寿命实验 将5 d龄体内带卵的线虫用M9缓冲液冲下,加入裂解液裂解后,20 ℃静置过夜,得到L1期线虫,将其接种到涂有大肠杆菌OP50的NGM培养基上,20 ℃培养48~54 h,即得到用于实验的L4期线虫。将同期化线虫随机分为5组:空白对照组、高糖模型组和DCI处理组(5、10和20 μm/L),每组 3 板,每板30 条。每2 d更换一次相应的新鲜培养基,每组培养基需加入150 mm/L的五氟尿嘧啶来抑制线虫繁殖,同时观察线虫的生存状况,直至线虫全部死亡为止[9]。
1.2.4 脂褐素水平的测定 收集同期化线虫,按照寿命实验中的饲养方法分别培养10 d。配制1%浓度的琼脂糖凝胶,每个平面挑取线虫4~5条,NaN3麻醉,倒置荧光显微镜下,激发340~380 nm,发射430 nm,观察线虫体内脂褐素水平,拍摄荧光图片,利用Image J软件分析处理线虫体内脂褐素荧光水平。
1.2.5 ROS水平的测定 收集同期化线虫,按照寿命实验中的饲养方法培养。当线虫分别培养至10 d时,用PBS缓冲液冲洗收集各组线虫于避光条件下加入DCFDA 探针储备液,PBS冲洗3次后,于激发485 nm、发射530 nm波长条件下,拍摄荧光图片[11]。
1.2.6 线虫抗氧化酶活力的测定 与寿命生存试验培养方法相同,培养6 d后,转移至EP管中,将线虫用生理盐水冰浴匀浆后,4 ℃、2500 r/min 离心,收集上清液。采用试剂盒测定线虫体内SOD酶和CAT酶活力。
1.2.7 线虫体内抗氧化基因mRNA表达水平的测定 将同期化2 d龄线虫培养6 d后,转移至EP管中。生理盐水洗涤后放入-80 ℃冰箱备用。利用Trizol法提取mRNA,反转录得到cDNA,再利用Real-time PCR法以gpd-1为看家基因,检测age-1、daf-2、sir-2.1、sod-3、daf-16、ctl-1基因mRNA表达水平。
1.3 数据处理
数据使用 SPSS statistics17.0 软件进行统计分析,单因素方差分析进行显著性检验,p<0.05认为存在显著性差异,p<0.01认为存在极显著性差异。
2 结果与分析
2.1 高糖对线虫体内脂滴的影响
油红O作为一种油性染料,可以高度溶解于脂肪。由图1可知,经过高糖喂养之后的线虫体内脂滴明显增多,且线虫个体较对照组相比较大。Matsuyama等[12]通过研究表明,一定浓度的葡萄糖可以显著增加线虫体内的脂肪积累。而线虫在高脂情况下,生物膜更易受到自由基攻击而发生氧化损伤,加速衰老,Schultz等[13]也以葡萄糖代谢功能障碍的线虫为模型发现,葡萄糖干预后能够显著降低线虫的寿命。
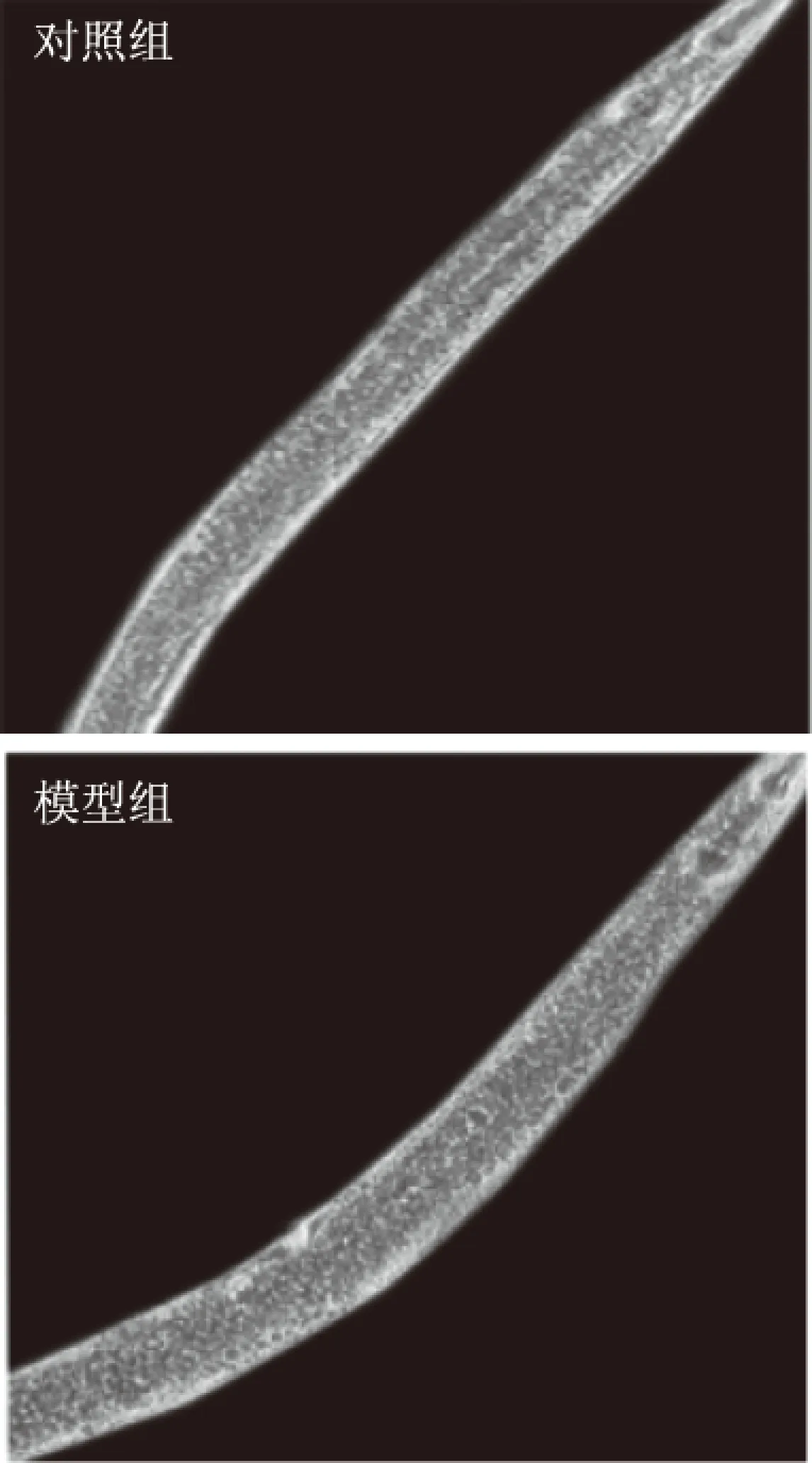
图1 200x显微镜下高糖对线虫体内脂滴的影响Fig.1 Effect of high glucose on lipid droplet in C. elegans by 200x microscope
2.2 DCI对高糖损伤线虫寿命的影响
从表2中可以看出,喂养1%的葡萄糖后,高糖模型组线虫的平均寿命与半数死亡时间与对照组相比极显著降低(p<0.01)。与模型组相比,喂养DCI的高糖损伤组线虫平均寿命和最高寿命与半数死亡时间均有所增加,且DCI摄入量与损伤组线虫的寿命呈剂量依赖关系,其中20 μm/L的DCI组高糖损伤线虫的平均寿命和最高寿命均显著升高(p<0.05)。因此,DCI能够延长高糖损伤线虫的存活时间,延缓氧化损伤过程,对其有一定的保护作用。此外,HadaB等[3]也通过研究发现,喂养一定剂量的DCI能够显著延长果蝇的寿命。

表2 DCI对高糖损伤线虫寿命的影响Table 2 Effect of DCI on the lifespan in C. elegans damaged by high glucose
2.3 DCI对高糖损伤线虫脂褐素含量的影响
线虫体内脂褐素随年龄增长而增多,可作为线虫机体衰老有效的生物标志。由图2可知,高糖损伤组线虫与对照组相比脂褐素水平极显著增加(p<0.01)。因此,高糖喂食能够加速线虫的机体衰老。与高糖损伤模型组相比,高糖给药组脂褐素荧光强度降低,其中10 μm/L的DCI组线虫体内的脂褐素荧光值较高糖组相比显著降低(p<0.05),20 μm/L的DCI组线虫体内的脂褐素荧光值较高糖组相比极显著降低了21%(p<0.01)。因此,一定含量的DCI能够有效降低高糖损伤线虫体内的脂褐素水平,延缓其机体衰老。

图2 DCI对高糖损伤线虫体内脂褐素相对含量的影响Fig.2 Effect of DCI on the content lipofuscin in high glucose-treated C. elegans注:脂褐素相对含量即线虫体内脂褐素自发荧光面积与线虫身体面积之比;和对照组相比,# p<0.05,## p<0.01;和模型组相比,*p<0.05,**p<0.01。
2.4 DCI对高糖损伤线虫体内ROS水平的影响
由图3可知,与对照组相比,高糖损伤组线虫ROS水平极显著升高(p<0.01)。机体在受到氧化损伤时会产生ROS自由基,ROS积累使氧化系统失衡,引起机体衰老。而给予高糖损伤线虫5、10 μm/L的DCI后,ROS相对含量与模型组相比显著降低(p<0.05),给予高糖损伤线虫20 μm/L的DCI后,ROS相对含量与模型组相比极显著降低(p<0.01)。因此DCI能降低线虫体内的ROS含量,有效降低高糖膳食对果蝇的氧化损伤作用。

图3 DCI对高糖损伤线虫体内ROS相对含量的影响Fig.3 Effect of DCI on the content ROSin C. elegans damaged by high glucose注:ROS相对含量即线虫体内ROS发射荧光面积与线虫身体面积之比;和对照组相比,#p<0.05,##p<0.01;和模型组相比,*p<0.05,**p<0.01。
2.5 DCI对高糖损伤线虫抗氧化酶活力的影响
SOD和CAT是线虫体内两种重要的抗氧化酶[14]。由图4可知,给予一定剂量的DCI后,高糖损伤线虫的抗氧化酶活力与模型组相比有所升高,其中喂养20 μm/L DCI的线虫体内的SOD活力和CAT活力分别提高了28.9%和58.9%。因此一定剂量的DCI能够增强线虫的抗氧化性,这可能是其发挥抗衰老的作用机制之一。此外张泽生等[15]研究了DCI的不同剂量对小鼠体内抗氧化系统的影响也发现,DCI能够显著升高小鼠不同组织的SOD、CAT活力,对衰老的小鼠具有延缓衰老的效果。

图4 DCI对高糖线虫SOD、CAT酶活力的影响Fig.4 Effect of DCI on SOD and CAT activity in C. elegans damaged by high glucose注:和对照组相比,# p<0.05,## p<0.01;和模型组相比,*p<0.05,**p<0.01。
2.6 DCI对高糖损伤线虫抗衰老相关基因转录水平的影响
由图5可知,与模型组相比,喂药组高糖损伤线虫的age-1、daf-2基因表达水平降低,其中给予20 μm/L DCI的高糖损伤组线虫体内的age-1基因表达水平极显著下调(p<0.01),而给予20 μm/L DCI的高糖损伤组线虫体内的sir-2.1、sod-3、daf-16、ctl-1基因与模型组相比显著上调(p<0.05)。胰岛素信号通路可以调控线虫衰老,而daf-2、age-1、daf-16基因是该通路中与线虫寿命有关的信号因子。daf-2是胰岛素/胰岛素样生长因子受体家族的同族体[16],age-1为哺乳动物磷脂酰激酶-3-羟基激酶的同族体[17],daf-16为叉头转录因子的同族体,其靶基因为sod-3、ctl-1[18-19]。在胰岛素信号通路中,线虫体内的DAF-2受体与胰岛素配体结合后可磷酸化AGE-1[17],AGE-1又可通过AKT-1/AKT-2/SGK-1通路引起DAF-16磷酸化[20]。Abbas等[21]研究发现,儿茶素能够影响线虫体内的daf-2 胰岛素信号转导过程,从而减少线虫氧化损伤并延长其寿命。此外近些年也有研究表明,齐墩果酸能够激活daf-16基因延长线虫寿命,同时,sod-3、ctl-1基因的mRNA也过度表达[22]。ctl-1是编码细胞质基质过氧化氢酶的基因,其过度表达可以延长线虫寿命,提高氧化应激耐受能力[23]。而sir-2.1作为线虫体内的长寿基因,其过度表达可以增强线虫氧化应激抵抗,Berdichevsky等[24]研究发现,sir-2.1基因突变的线虫对应激表现更敏感。因此,一定剂量的DCI能够通过调节与寿命相关的基因来延长高糖损伤组线虫的寿命,对其起到一定的保护作用。

图5 DCI对高糖损伤线虫体内延缓衰老相关基因mRNA表达水平的影响Fig.5 Effect of DCI on mRNA expression level about anti-aging genes in C. elegans damaged by high glucose注:和对照组相比,# p<0.05,## p<0.01;和模型组相比,*p<0.05,**p<0.01。
3 结论
本实验结果表明,10、20 μm/L的DCI能够显著延长高糖损伤线虫的平均寿命(p<0.05),而20 μm/L的DCI极显著降低线虫体内脂褐素和ROS水平(p<0.01)。此外,20 μm/L剂量组氧化损伤线虫体内SOD和CAT活力显著增加(p<0.05),age-1、daf-2基因mRNA 表达水平显著下调(p<0.05),而sir-2.1、sod-3、daf-16、ctl-1基因的mRNA表达水平显著上调(p<0.05)。因此DCI对高糖导致氧化损伤线虫有保护作用,而延缓线虫衰老的作用机制可能与其调控抗衰老相关基因的表达有关。本实验结果为相关DCI抗氧化保健产品开发应用提供科学依据,但本次研究只局限于生理表层和基因表达方面,将来更需要通过蛋白质组学和代谢组学实验进行评价分析,为DCI在食品工业中的开发提供理论帮助。

