响应面优化微波辅助提取蓝靛果花色苷工艺及其抗氧化活性
李凤凤,张秀玲,*,柳晓晨,张雪婷,赵恒田
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.中国科学院东北地理与农业生态研究所,黑龙江哈尔滨 150081)
蓝靛果忍冬(LoniceraedulisTurcz)又名蓝靛果,俗称山茄子、黑瞎子果等,属于忍冬科忍冬属,是一种新兴的野生浆果资源[1-5]。蓝靛果果实中VC含量高于其他一般果蔬,且有多种有益的矿物质和氨基酸,特别是花色苷含量显著高于其他果实(蓝莓等)[6-7],具有抗氧化功能,对癌症、心血管、高血压等多种慢性疾病有预防作用[8-10],营养和保健价值较高,因此有“第三代水果”之称[11-12]。花色苷是花色素与糖以糖苷键结合而成的一类化合物,广泛存在于果蔬中,使其呈现由红、紫红到兰等不同颜色。研究表明,花色苷具有多种生理保健功能,包括抗氧化、清除自由基、抗炎、抗肿瘤、抗糖尿病以及预防老年痴呆等,因此提取花青素可以满足食品工业的日益增长的需求及其在医药和纺织工业中的重要应用。
目前已有通过使用有机溶剂、酶辅助提取、超临界流体萃取和超声辅助提取等方法提取蓝靛果中的花色苷,与常规方法比较提取量提高[13-18]。应用响应面法优化蓝靛果花色苷微波辅助提取与抗氧化性的研究少有报道。
本文采用微波辅助提取法提取蓝靛果中的花色苷,相较于普通的溶剂提取法,具有时间短、提取效率高、成本适中等优点;相较于酶解法,具有操作简单、能够更好地保护蓝靛果中的花色苷成分的优点;相较于超声波辅助提取,具有耗时短、无噪音的优点。通过响应面法进行优化,能够评估多个参数及其相互作用对响应值的影响,确定出最佳提取工艺条件,并且分析了其体外抗氧化活性,为更深的研究和开发蓝靛果花色苷提供理论支持。
1 材料与方法
1.1 材料与仪器
野生蓝靛果 采自小兴安岭伊春地区的野生鲜果,挑选新鲜无损伤果、除去杂质后进行速冻贮藏(-20 ℃);无水乙醇、盐酸、氯化钾、乙酸钠等 哈尔滨盛达生化仪器有限公司;1,1-二苯基-2-苦苯肼自由基(含10~20%苯) 梯希爱(上海)化成工业发展有限公司;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐 美国sigma公司。
MJ-BL25C3搅拌机 广东美的精品电器制造有限公司;JA1003电子天平 上海舜宇恒平科学仪器有限公司;PHS-3C型pH计 上海雷磁仪器厂;G70D20CN1P-D2(S0)格兰仕微波炉 广东格兰仕微波生活电器制造有限公司;UV-2600紫外可见分光光度计 日本岛津公司;旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 蓝靛果花色苷的提取 取适量蓝靛果冻果于室温下解冻,用搅拌机将其破碎成匀浆。精确称取5.00 g蓝靛果冻果匀浆,加入锥形瓶中,按照一定的料液比加入一定体积分数的乙醇溶液,设定相应的微波提取功率和提取时间,进行微波辅助提取。将提取液抽滤,得到花色苷粗提取液。
1.2.2 蓝靛果花色苷提取单因素实验
1.2.2.1 微波功率的优化 准确称取5.00 g 的蓝靛果匀浆6份,分别按料液比1∶20 g/mL 加入70%乙醇溶液,在微波功率为70、140、210、280、350、420 W的实验条件下提取 90 s,提取液抽滤并计算花色苷提取量,平行实验三次。
1.2.2.2 微波时间的优化 准确称取5.00 g 的蓝靛果匀浆6份,分别按料液比1∶20 g/mL加入 70% 乙醇溶液,在微波功率为280 W的实验条件下依次提取30、60、90、120、150、180 s,提取液抽滤并计算花色苷提取量,平行实验三次。
1.2.2.3 料液比的优化 准确称取5.00 g 的蓝靛果匀浆6份,分别按料液比1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 g/mL 加入 70% 乙醇溶液,在微波功率为280 W,微波时间90 s的实验条件下提取,提取液抽滤并计算花色苷提取量,平行实验三次。
1.2.2.4 乙醇体积分数的优化 准确称取5.00 g 的蓝靛果匀浆6份,分别按料液比1∶20 g/mL 加入体积分数分别为40%、50%、60%、70%、80%、90%的乙醇溶液,在微波功率为280 W,微波时间90 s的实验条件下提取,提取液抽滤并计算花色苷提取量,平行实验三次。
1.2.3 响应面优化实验设计 根据上述各个单因素的实验结果,以蓝靛果花色苷提取量为响应值,进行响应面分析,得到最优的工艺条件。响应面实验因素及水平见表1。
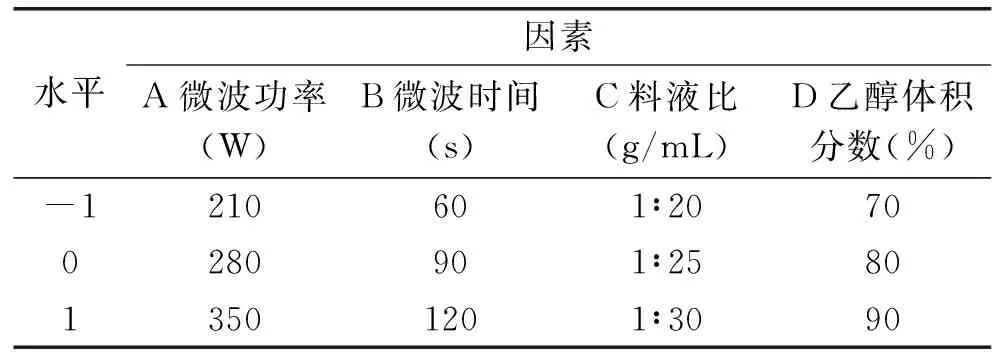
表1 响应面分析因素及水平Table 1 Factors and levels used in response surface analysis
1.2.4 蓝靛果中花色苷提取量的测定 采用pH示差法[19-20]。取2份2 mL的花色苷提取液,分别用pH1.0(将浓度均为0.2 mol/L和氯化钾溶液以67∶25比例混匀后校正)和pH4.5(将浓度均为0.2 mol/L的乙酸溶液和乙酸钠溶液等体积混匀后校正)缓冲溶液,定容至50 mL,平衡60 min,在540 nm下测定吸光值,按式下式计算提取量:
式中:A:(A540-A700)pH1.0-(A540-A700)pH4.5;MW:矢车菊-3-葡萄糖苷的摩尔质量,g/mol,449.29;DF:稀释倍数;V:提取溶剂的体积,mL;ε:矢车菊-3-葡萄糖苷的摩尔消光系数,L·mol/cm,26900;m:称取的蓝靛果质量;1:比色皿的光距长度,cm。
1.2.5 DPPH自由基清除的能力测定 参照李新原等[21]的方法进行改动。取不同质量浓度(20、40、60、80、100 μg/mL)的蓝靛果花色苷提取液2.0 mL与0.1 mol/L DPPH乙醇溶液2.0 mL混合均匀,然后将其在室温下放置30 min后,在517 nm波长处测吸光值A1;用无水乙醇代替蓝靛果花色苷提取液和DPPH乙醇溶液,按照同样的方法,测定吸光值A0、A2。采用相对应浓度的VC作为花色苷提取液的对照,平行测定3次。DPPH自由基清除率按下式计算:
1.2.6 ABTS+·清除能力的测定 参照蔡宁晨等[22]的方法略做改动。首先配置ABTS+·母液:将88 μL(140 mmol/L)氧化剂过硫酸钾溶液与5 mL的7 mmol/L ABTS+·溶液混合,在室温避光条件下静置过夜。然后用无水乙醇将ABTS+·母液稀释,使其在734 nm波长处吸光度为0.7±0.02。取不同质量浓度(20、40、60、80、100 μg/mL)的蓝靛果花色苷提取液0.1 mL与3.9 mL ABTS+·工作液充分混匀,在室温黑暗处反应10 min后,在734 nm波长处测定吸光值A1。以无水乙醇替换蓝靛果花色苷提取液,同法操作,测定吸光值A2。用相对应浓度的VC作为花色苷提取液的对照,平行测定3次。ABTS+·清除率按下式计算:

1.2.7 超氧阴离子自由基清除能力的测定 参照李斌等[23]的方法略做改动。取0.2 mL不同质量浓度(20、40、60、80、100 μg/mL)的蓝靛果花色苷提取液,依次加入5.7 mL Tris-HCl缓冲溶液(50 mmol/L,pH8.20)、0.1 mL的6 mmol/L邻苯三酚溶液,混匀后室温下反应5 min,加入1滴HCl(12 mol/L)来结束反应,最后在320 nm波长处测定吸光值A1。按照同一方法,以蒸馏水分别代替邻苯三酚溶液和提取液进行反应,测定吸光值A2、A0。用相对应浓度的VC作为花色苷提取液的对照,平行测定3次。超氧阴离子自由基清除率按下式计算:
1.2.8 总还原能力的测定 采用铁氰化钾还原显色法[24]。取0.2 mL不同质量浓度(20、40、60、80、100 μg/mL)的蓝靛果花色苷提取液于试管中,分别加入1.0 mL的0.2 mol/L磷酸盐缓冲液(pH6.6)和1.0 mL 1%(w/v)铁氰化钾溶液,旋涡震荡混匀,然后置于50 ℃水浴中反应20 min,取出后加入1.0 mL 10%(w/v)三氯乙酸溶液终止反应,3000 r/min、4 ℃离心10 min,取上清液2.0 mL,依次加入2.0 mL蒸馏水和0.4 mL 0.1%(w/v)FeCl3溶液,混匀后放置15 min后,在波长700 nm下测定吸光值A1,用蒸馏水代替提取液,测定吸光值A2。采用相对应浓度的VC作为对照,每组实验平行3次。总还原力按下式计算:
还原力=A1-A2
1.3 数据处理与统计分析
所有实验平行3次。采用Origin 8.0软件、SPSS 22.0软件和Design-Expert 8.0.6统计软件进行实验设计和统计分析。
2 结果与分析
2.1 微波辅助提取蓝靛果花色苷的单因素实验结果
2.1.1 微波功率对蓝靛果花色苷提取量的影响 微波功率对蓝靛果花色苷提取量的影响见图1,由图1可知,微波功率在70~280 W的范围内,随着功率的增加,蓝靛果花色苷提取量增加,不同微波功率之间蓝靛果花色苷提取量存在显著性差异(p<0.05)。当微波功率为280 W时,花色苷含量达到最大值285.13 mg/100 g,继续增大功率对花色苷提取量无显著性影响(p>0.05),甚至出现下降,原因可能是微波功率增加导致体系温度过高,使花色苷结构破坏,同时有杂质溶出,导致蓝靛果花色苷提取量的下降。因此,选择微波功率210~350 W作为响应面的参数范围。
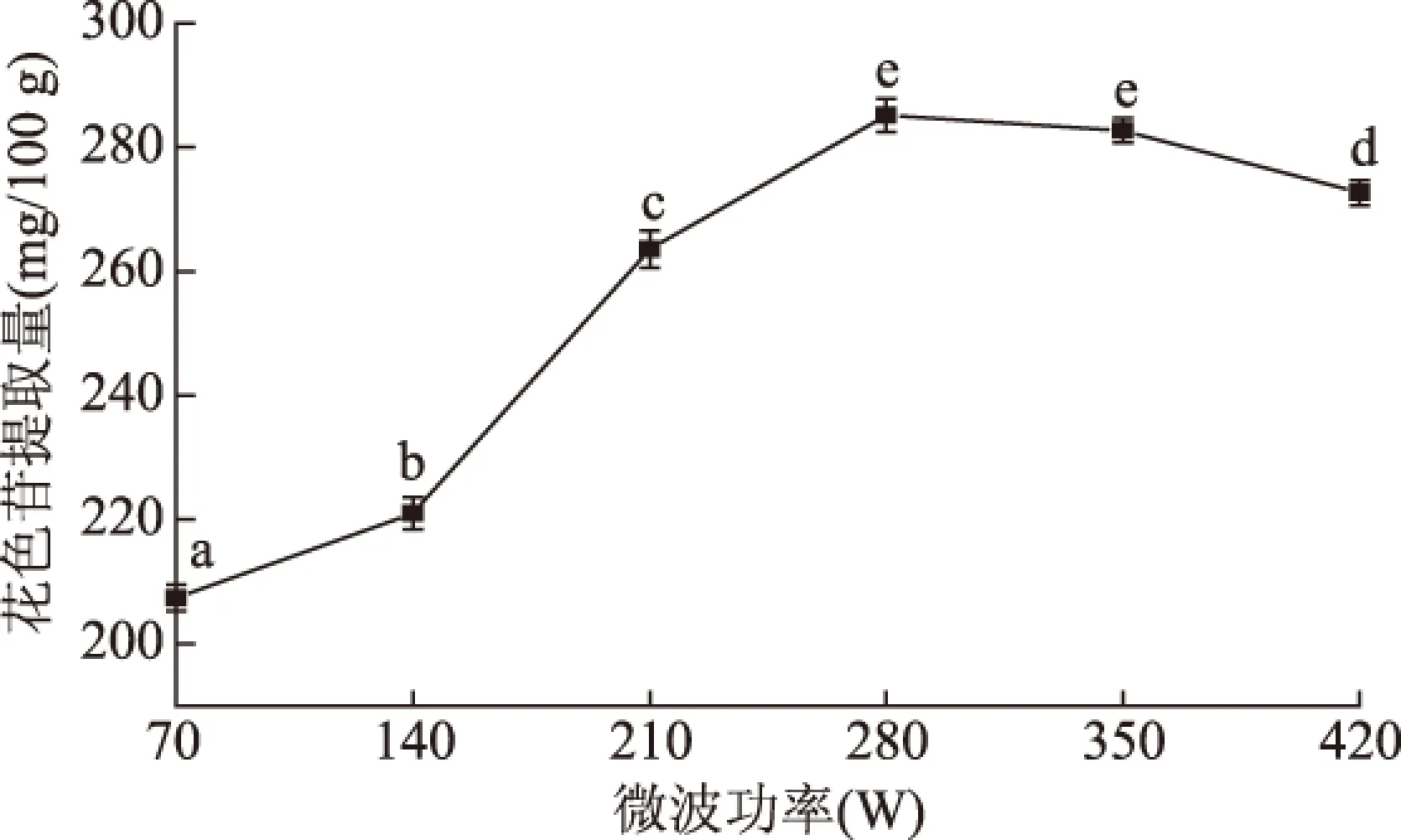
图1 微波功率对蓝靛果花色苷提取量的影响Fig.1 Effect of microwave power on extraction amount of anthocyanins from Lonicera edulis
2.1.2 微波时间对蓝靛果花色苷提取量的影响 微波时间对蓝靛果花色苷提取量的影响见图2,由图2可知,随着微波时间的增加,蓝靛果花色苷提取量呈先上升再下降的趋势。这可能是因为随时间增加有利于花色苷成分充分的溶出,所以花色苷提取量增加;然而随着时间继续增加,花色苷发生降解,使提取量降低。花色苷提取的最佳微波时间是90 s,提取量达到290.54 mg/100 g,显著高于其他时间的提取量(p<0.05)。因此,选择微波时间60~120 s作为响应面的参数范围。

图2 微波时间对蓝靛果花色苷提取量的影响Fig.2 Effect of microwave time on extraction of anthocyanin from Lonicera edulis
2.1.3 料液比对蓝靛果花色苷提取量的影响 料液比对蓝靛果花色苷提取量的影响见图3,由图3可知,在料液比1∶10~1∶25之间,蓝靛果花色苷的提取量随溶剂用量的增大而显著增加(p<0.05),这是因为随着溶剂用量增加,花色苷成分溶出增加;当料液比达到1∶25时,花色苷提取量最大为280.45 mg/100 g,继续增加溶剂用量,花色苷提取量无显著性差异(p>0.05),随后出现下降的趋势,这是由于随着提取剂用量增加,干扰杂质的浸出量增加。因此,选择料液比1∶20~1∶30作为响应面的参数范围。

图3 料液比对蓝靛果花色苷提取量的影响Fig.3 Effect of ratio of material to liquid on extraction of anthocyanin from Lonicera edulis
2.1.4 乙醇体积分数对蓝靛果花色苷提取量的影响 乙醇体积分数对蓝靛果花色苷提取量的影响见图4,由图4可知,蓝靛果花色苷提取量在乙醇体积分数为80%时,达到最大值288.83 mg/100 g。当乙醇体积分数在40~80%范围内,蓝靛果花色苷提取量呈显著性增加(p<0.05)。当乙醇体积分数高于80%,花色苷含量下降。因此,选择乙醇体积分数70%~90%作为响应面的参数范围。

图4 乙醇体积分数对蓝靛果提取量的影响Fig.4 Effect of ethanol volume fraction on extraction of Lonicera edulis
2.2 微波辅助提取蓝靛果花色苷的响应面优化实验结果
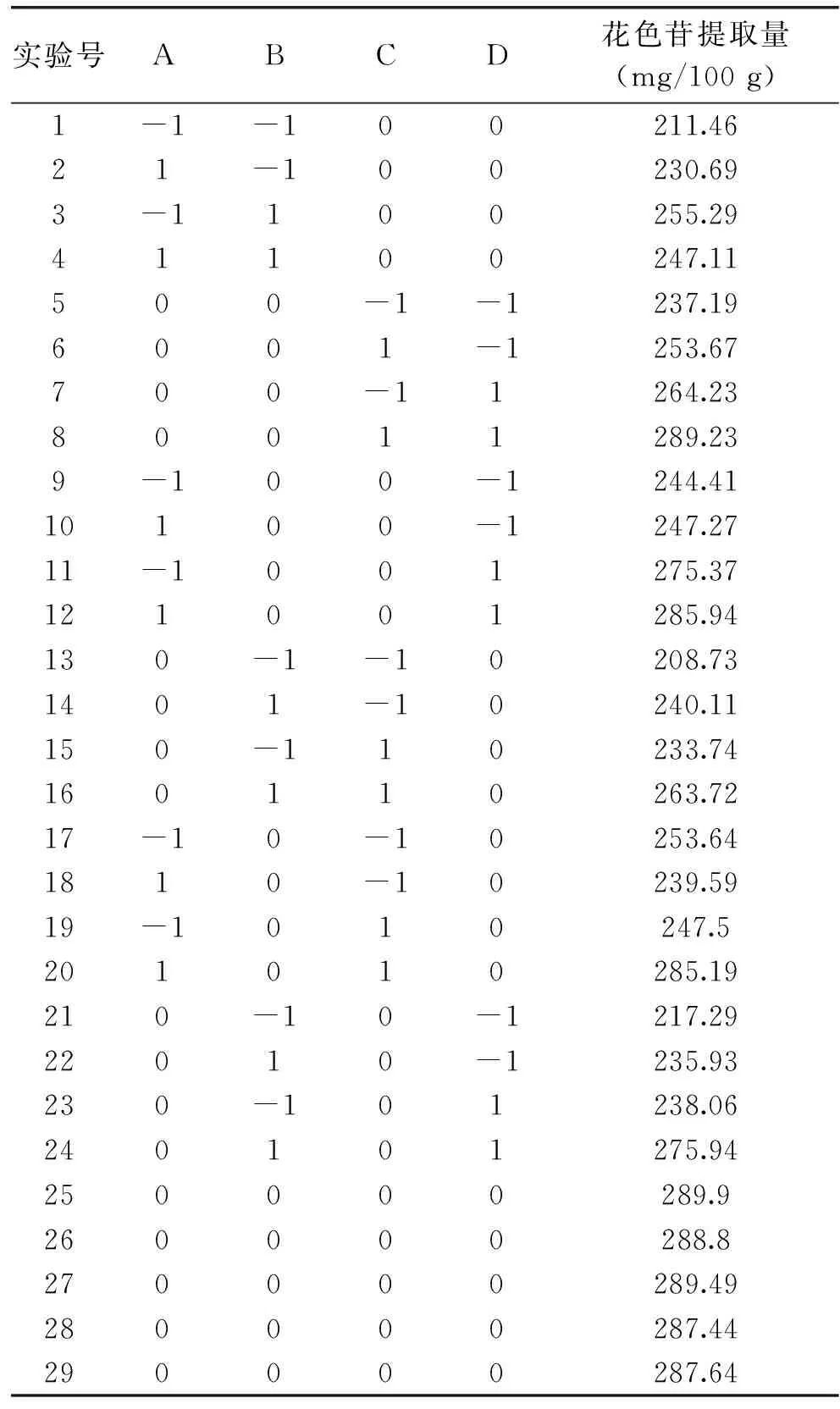
表2 响应面分析实验方案与结果Table 2 Experimental design and results for response surface analysis
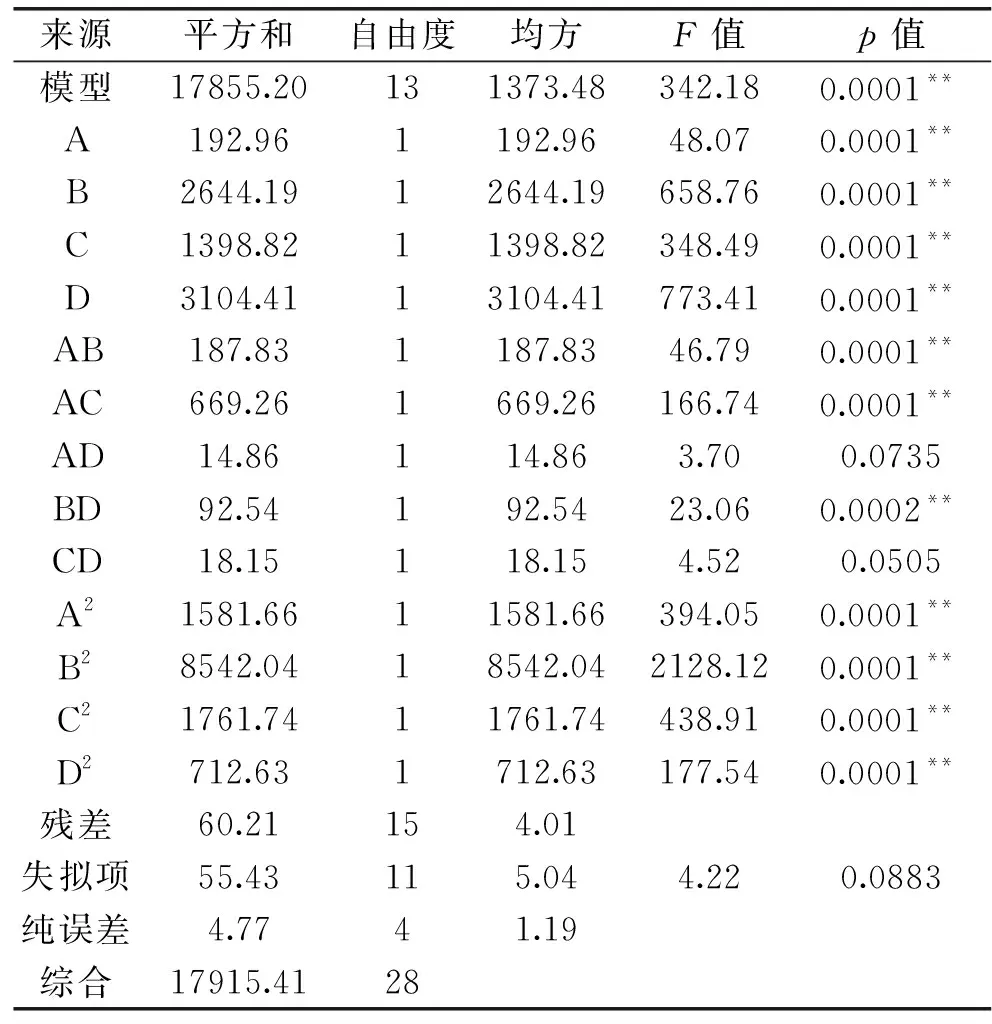
表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.2.2 最佳条件的确定和回归模型的验证 确定最佳工艺条件为微波功率304.52 W,微波时间96.93 s,料液比1∶27.62,乙醇体积分数89.06%,在此条件下得到的花色苷提取量为301.185 mg/100 g。由于实际工艺条件的限制,选择微波功率280 W,微波时间90 s,料液比1∶25,乙醇体积分数85%,在这个工艺参数下,得到花色苷提取量为(292.16±1.25) mg/100 g,与理论值仅相差3%左右,表明此模型能较好地测定蓝靛果中花色苷含量。
2.3 蓝靛果花色苷对DPPH自由基的清除能力
由图6可知,对于蓝靛果花色苷和VC照组对DPPH自由基能较好地清除,且清除率随质量浓度增加而增强。当质量浓度在20~80 μg/mL范围内,蓝靛果花色苷对DPPH自由基的清除能力显著性增强(p<0.05)。蓝靛果花色苷和VC对照组在质量浓度为100 μg/mL时,清除DPPH自由基的能力都达到最大,清除率分别为89.2%和91.59%。

图6 蓝靛果花色苷对DPPH自由基的清除能力Fig.6 Scavenging capacity of anthocyanins from Lonicera edulis on DPPH free radical
2.4 蓝靛果花色苷对ABTS+·的清除能力
由图7可知,蓝靛果花色苷和VC对照组对ABTS+·的清除率随质量浓度增加而增加,且清除能力均较强。在同一质量浓度下,蓝靛果花色苷对ABTS+·的清除能力弱于VC对照组。当质量浓度在20~100 μg/mL,对ABTS+·来说,蓝靛果花色苷和VC对照组清除能力存在显著性差异(p<0.05)。蓝靛果花色苷清除率在质量浓度为100 μg/mL时达到最大,为70.4%。

图7 蓝靛果花色苷对ABTS+·的清除能力Fig.7 Scavenging capacity of anthocyanins from Lonicera edulis on ABTS+·
2.5 蓝靛果花色苷对超氧阴离子自由基的清除能力
由图8可知,随着质量浓度的增加,清除能力增强,蓝靛果花色苷和VC对照组对超氧阴离子自由基的清除能力均较显著(p<0.05)。在同等浓度下,蓝靛果花色苷对超氧阴离子自由基的清除率弱于VC对照组。当质量浓度为100 μg/mL时,蓝靛果花色苷超氧阴离子自由基的清除率为44.73%,VC对照组为64.49%。
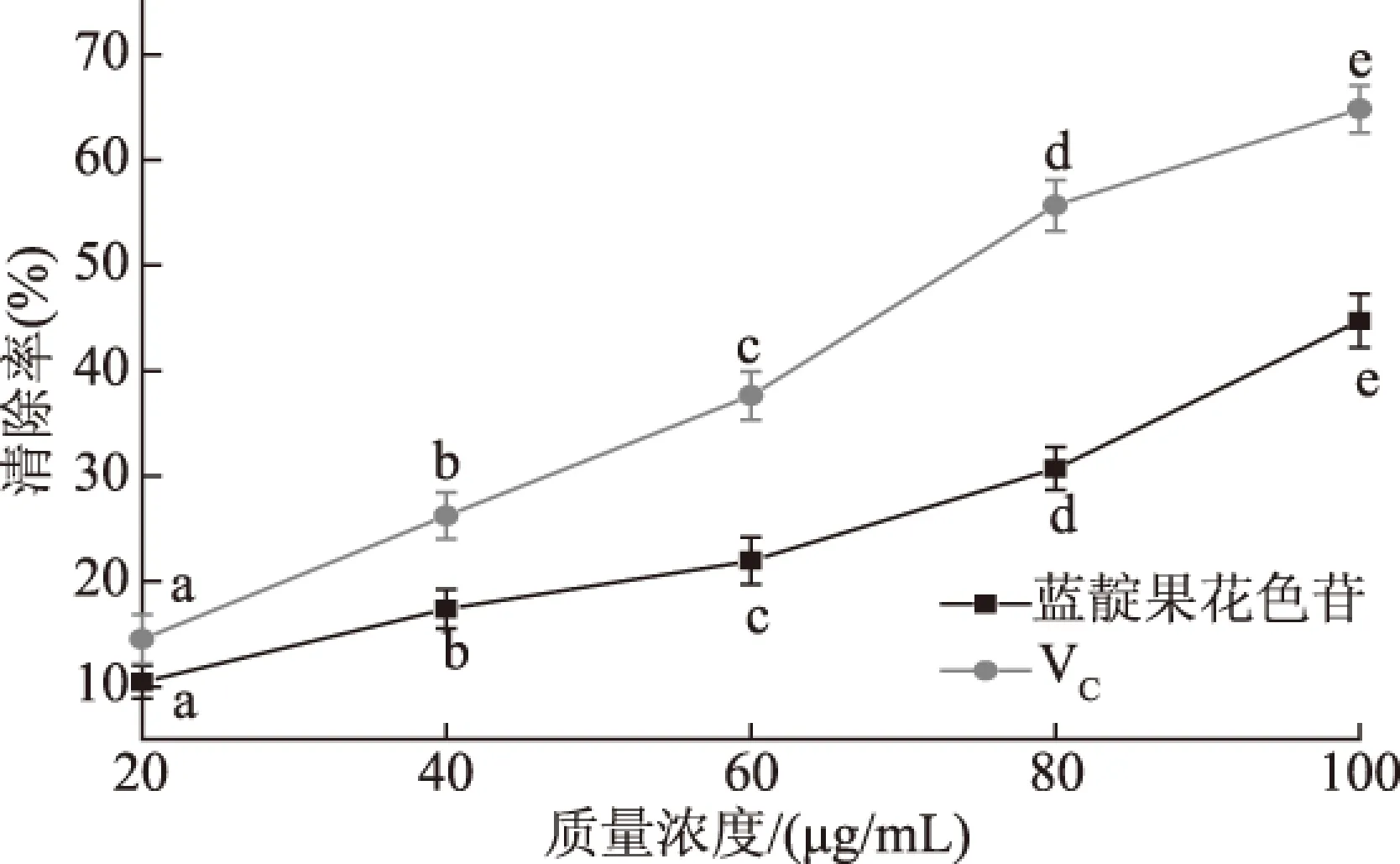
图8 蓝靛果花色苷对超氧阴离子自由基的清除能力Fig.8 Scavenging capacity of anthocyanins from Lonicera edulis on superoxide freeradical
2.6 总还原能力
由图9可知,对于蓝靛果花色苷和VC对照组来说,还原能力都随着质量浓度的增加而增强。在同一质量浓度下,蓝靛果花色苷的还原能力弱于VC对照组。当质量浓度在60~100 μg/mL,蓝靛果花色苷的还原力呈显著性上升(p<0.05)。当质量浓度为100 μg/mL时,蓝靛果花色苷的还原力达到最大为1.06,达到同等质量浓度VC还原力的68%。
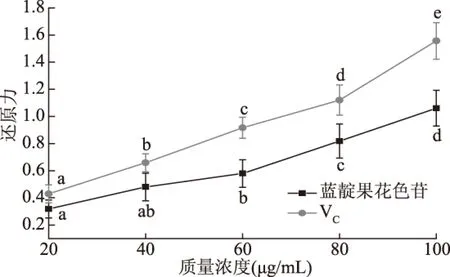
图9 蓝靛果花色苷的总还原力Fig.9 Total reduction capacity of anthocyanins from Lonicera edulis
3 结论
采用微波辅助提取蓝靛果花色苷,利用响应面法得到最佳工艺条件为微波功率280 W,微波时间90 s,料液比1∶25,乙醇体积分数85%,在此条件下获得的花色苷提取量为(292.16±1.25) mg/100 g。通过蓝靛果花色苷的体外抗氧化活性实验得知,蓝靛果花色苷与VC对照组比,具有一定抗氧化能力。蓝靛果花色苷对DPPH自由基、ABTS+·和超氧阴离子自由基具有较强的清除能力,清除率分别达到89.20%、70.40%和44.73%,同时具有较高的总还原能力。因此,进一步开发和应用蓝靛果花色苷具有重要意义。随着人们对花色苷的兴趣越来越大,花色苷对人体健康产生积极的有益作用,其在食品工业以及其他相关行业中的应用前景广阔。

