灵芝固体发酵龙眼核提取物的主要活性成分及其抗氧化性
张国广,沈 琳,黄冰晴,赖燕华,周 梅,邹金美
(1.闽南师范大学生物科学与技术学院,福建漳州 363000;2.菌物产业福建省高校工程研究中心,福建漳州 363000)
龙眼(DimocarpuslongyanLour)俗名桂圆,是无患子科龙眼属植物,属于亚热带果树,在中国和东南亚一些国家,如越南、泰国、菲律宾等国广泛栽培。在中国主要分布于广东、广西、福建、台湾和海南等省,云南、贵州和四川等省也有少量栽培。龙眼核是龙眼果实的种仁,其重量约占龙眼果实鲜重的17%[1],是龙眼果实加工中的主要废弃物。
龙眼核富含淀粉和蛋白质等营养物质成分,其淀粉含量在38.5%~60%之间,蛋白质含量5.59%~7.4%,还原糖含量10.2%~14.13%,脂类含量在2.47%以上[2-3],是具有开发利用价值的生物质营养资源。龙眼核也富含多酚类、黄酮类和多糖等活性物质,其提取物具有抗菌、抗氧化、抗癌、抗虫等生物活性[1,4-9]。很多酚类和黄酮类物质能够赋予食用资源抗菌和抗氧化等保健功能,但该类物质也赋予了食材的苦味和涩味等,甚至部分酚类或黄酮类成分长期食用可能会有一定的毒副作用,尽管有研究对龙眼核的毒理学进行了探讨,在动物饲喂试验期内(13周)没有观察到龙眼核的毒性效应[10]。但因龙眼核口感涩苦,适口性较差,作为食用或饲用资源加以利用的报道并不多见[11],在局部地区作为一种中药有少量的利用[12-13],其余多被焚烧或被丢弃,造成生物资源的浪费。用真菌发酵中草药或工农业生产中产生的废弃物,以改善药物疗效或提高加工废弃物的食用或药用价值的研究表明,真菌发酵中药材后可以改变其活性或药用成分,具有减毒和增加相关疗效的效果[14-16],真菌发酵普通食材也可以增加其活性成分[17-18]。本研究拟探讨用灵芝发酵含有龙眼核的固体基质后的主要活性成分含量变化及其抗氧化活性变化,为开发基于龙眼核的功能性食用或饲用菌质营养资源提供实验依据。
1 材料与方法
1.1 材料与仪器
龙眼核 购买自福建科人公司;高粱和小麦 购自粮食市场;灵芝菌种 学院菌物实验室保存;马铃薯葡萄糖琼脂(PDA)培养基 杭州滨和微生物试剂公司;芦丁、齐墩果酸 标准品,中国食品药品检定研究院;没食子酸 Sigma公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ)、3-(2-吡啶基)-5,6-双(4-磺苯基)-1,2,4-三嗪二钠盐(Ferrozine) 梯希爱上海化成公司;总抗氧化测定试剂盒 南京建成生物公司;其它试剂 市售分析纯。
Multiskan Go全波长酶标仪 Thermo Scientific公司;AR124CN 电子分析天平 奥豪斯公司;UV-1100分光光度计 上海美谱达公司;JY99-IIDN超声波细胞粉碎仪 宁波新芝公司;TGL-20M冷冻离心机 长沙湘仪公司;PE-400S破碎机 广州旭朗机械设备公司。
1.2 实验方法
1.2.1 灵芝固体发酵龙眼核 PDA培养基按照说明书配制,配制后121 ℃高压灭菌20 min,在超净工作台内倒入直径9 cm玻璃平板,制成PDA固体培养平板。超净工作台内从灵芝母种中挑取约1 cm见方的小块,放置在PDA培养平板中间,28 ℃的培养箱内培养,待菌丝基本长满平板后备用。
小麦清洗后用清水浸泡24 h,捞至沸水中煮至小麦粒中无白心,捞出摊晾至小麦粒表面无明显水分,将小麦粒装入500 mL玻璃瓶中,装至瓶高三分之二处,封口后126 ℃高压灭菌2 h,得到小麦粒固体培养基,冷凉至室温后,在超净台内将长满菌丝的灵芝菌种平板接种至小麦粒固体培养基中,一个活化的灵芝菌种平板接种一瓶小麦粒固体培养基。接种后,于28 ℃的培养箱内培养,待瓶中菌丝长满小麦粒固体培养基后备用。
将购买的龙眼核清洗后,于鼓风干燥箱内60 ℃烘干,用破碎机破碎成直径4 mm左右的颗粒状,使用高粱和龙眼核颗粒两种材料制备固体培养基,设置高粱和龙眼核的重量比分别为100∶0、70∶30、30∶70和0∶100的4种培养基,即分别包含重量百分比为0%、30%、70%和100%龙眼核的4种固体培养基,采用上述真菌麦粒菌种培养基的制作方法对两种材料进行处理后,混合或单独装入500 mL玻璃瓶内,装料至瓶高三分之二处,126 ℃高压灭菌2 h后,取出冷凉至室温后接入上述准备好的灵芝麦粒固体菌种,菌种接种量5%,每种培养基均同时设置不接菌对照组。
接菌组和对照组均放入28 ℃的培养箱中培养,间隔24 h观察一次,接种菌玻璃瓶表面观察到灵芝菌丝长满玻璃瓶后,再继续培养7~10 d,将接菌组玻璃瓶和对应的对照组基质瓶取出,放置到鼓风干燥箱内,60 ℃烘至彻底干燥后粉碎备用。100%龙眼核组中灵芝菌丝生长最慢,2个月左右菌丝才长满全瓶。
1.2.2 提取物的制备 以60%乙醇为提取溶剂,采用超声波辅助法提取1.2.1灵芝发酵所制备的固体基质和其对照组的有效成分,超声波破碎程序设置为:破碎5 s、间歇5 s,提取30 min,超声频率40 Hz、超声功率800 W,温度60 ℃。提取物最后定量为:以发酵或未发酵的基质质量计0.1 g/mL,共计制备8种不同的提取物,为方便表述分别用字母编号表示(表1)。

表1 8种提取物的字母编号Table 1 Alphabet code of 8 kinds of extracts
1.2.3 提取物中糖、多酚类、黄酮类和总三萜含量的测定 采用苯酚-硫酸法测定提取物中糖含量[19],以葡萄糖为标准品,测得的标准线性回归方程为y=16.234x - 0.0142,R2=0.989;
采用福林酚法测定提取物中多酚类物质含量[4],以没食子酸为标准品,测得的标准曲线回归方程为y=1.6369x+0.0143,R2=0.9984;
采用亚硝酸钠-硝酸铝显色法测定提取物中黄酮类含量[20],以芦丁为标准品,测得的标准曲线回归方程为y=1.0626x+0.0082,R2=0.9946;
采用香草醛-高氯酸显色法测定提取物中总三萜物质含量[21],以齐墩果酸为标准品,测得的标准线性方程为y=11.556x - 0.013,R2=0.9983。
1.2.4 总抗氧化能力的测定 8种接种灵芝或未接种灵芝发酵培养基提取物总抗氧化能力测定方法,按试剂盒说明书提供的方法进行,总抗氧化能力(T-AOC)定义为:在37 ℃时,每分钟每毫升样品液使反应体系的520 nm波长处吸光度值每增加0.01时,为一个总抗氧化能力单位(U)。
1.2.5 总还原力的测定和清除DPPH自由基能力测定 将A、B、C、D、A′、B′、C′和D′ 8种提取物分别配成浓度为0.001、0.002、0.005、0.01、0.1 g/mL的测试液。
总还原力测定采用铁氰化钾还原法测定,操作步骤参照文献[20];
DPPH自由基清除能力的测试方法参考文献[19]步骤进行。
1.2.6 ABTS自由基清除能力的测定 参考文献[4]步骤并修改使之适用于酶标仪测定:称取ABTS 3 mg,溶解于0.735 mL纯水中;称取过硫酸钾1 mg,溶解于1.43 mL纯水中;取0.4 mL ABTS与0.4 mL 过硫酸钾溶液混匀,黑暗、室温静置12 h,取出后稀释30倍左右,使其吸光值落在0.8左右;酶标板每5孔为一组共取两组,依次加入0.16 mL ABTS工作液,然后在一组5孔中加入0.04 mL固体基质提取物(A),另外一组5孔中分别加入0.04 mL 60%乙醇为(A0),微型涡旋仪上轻微振荡10 s,混匀,静置6 min后,在酶标仪中734 nm波长下测定各孔的吸光值;按以下公式计算清除率:
1.2.7 Fe3+还原抗氧化能力的测定 采用FRAP法测定,参考文献[4]并修改使之适用于酶标仪:由0.3 mol/L pH3.6 的乙酸钠缓冲液、10 mmol/L TPTZ溶液(TPTZ溶液采用40 mmol/L HCl溶解)和20 mmol/L三氯化铁以体积比10∶1∶1混匀,现配现用;取150 μL上述混匀FRAP试剂于酶标管中,加入15 μL 60%乙醇和5 μL不同浓度的提取物,将反应混合物在37 ℃下孵育30 min,用酶标仪于593 nm波长下测定各板孔的吸光值。吸光值越高,表明对Fe3+的还原能力越强。
1.3 数据处理
样品测定采用3个重复。实验结果用SPSS 17.0软件进行统计分析,运用Origin 6.1软件作图。
2 结果与分析
2.1 糖类、多酚类、黄酮类和三萜类物质测定结果
由表2可知,A、B、C、D 4种未接灵芝发酵处理的提取物中,随着基质中龙眼核含量的增加,糖含量显著增加(p<0.05),可能是因为龙眼核中小分子糖类含量较高粱中的多,所以在用60%乙醇提取时,溶解在溶剂中的糖类物质较多,在A′、B′、C′、D′ 4种接灵芝菌发酵基质的提取物中,糖含量均比未接菌显著性增加(p<0.05),可能是灵芝生长过程中,能够分解利用基质中的营养物质,在菌体构建过程中重新产生可溶解于60%乙醇中的糖类。

表2 8种提取物中几种活性物质测定结果Table 2 Determination results of several active components in 8 kinds of extracts
A、B、C、D 4种未接菌基质的提取物中,随基质中龙眼核含量的增加,多酚类物质含量显著性增加(p<0.05),而在接菌的A′、B′、C′、D′ 4种基质的提取物中,除A′组外,B′、C′和D′组多酚类物质含量与对应的B、C和D组多酚类含量相比,都显著性降低(p<0.05),可能是灵芝在其菌丝生长过程中,能分泌相应的酶,分解利用龙眼核中的大量多酚类物质。邹礼根等[22]在用灵芝发酵绿茶中也发现,灵芝能显著性降低茶叶中的茶多酚含量。A′组多酚类含量显著高于未接菌的A组(p<0.05),可能是灵芝在纯高粱培养基生长过程中,菌丝会产生一些多酚类物质,未接灵芝的A组中多酚类含量在8个试验组中最低(表2)。
在8种基质中,黄酮类物质的变化趋势和多酚类物质的变化趋势基本一致(表2),可能在灵芝菌丝的生长过程中,能分泌某些酶,从而分解或利用龙眼核中的黄酮类物质,灵芝菌丝生长中也会在菌体内产生一些新的黄酮类物质。张平等[14]在使用灵芝发酵枇杷叶时,也发现枇杷叶的黄酮类物质显著性下降。
未接灵芝菌的A、B、C、D 4种提取物中,总三萜含量随基质中龙眼核含量的增加基本呈现小幅度增加趋势(表2),在接菌的C′和D′ 2种提取物中,总三萜含量与对应的C和D组比有所下降,但差异不显著(p>0.05),说明龙眼核自身含有三萜类物质,灵芝菌丝生长中能够分解利用龙眼核的三萜类物质;而纯高粱基质经过灵芝发酵后的A′与对照A组比,三萜类物质含量显著性增加(p<0.05),说明灵芝菌丝体构建过程中有三萜类物质的生成[23]。
2.2 总抗氧化能力分析
由图1可知,A、B、C、D 4种未接灵芝发酵的基质提取物,其总抗氧化活性随基质中龙眼核含量的增加而增强,其总抗氧化活性的变化可能与其多酚类物质和黄酮类物质含量的递增有关[4];与B、C、D提取物相比,接入灵芝发酵的B′、C′和D′ 总抗氧化能力减小,可能与灵芝对龙眼核发酵后使得基质中的多酚和黄酮类物质含量降低有关,A′组比未接菌A组的总抗氧化活力略强,可能与灵芝接种高粱后,在生长过程中产生的活性物质有关[17]。

图1 8种不同提取物总抗氧化能力测定结果Fig.1 Determination results of total antioxidant capacity of 8 different extracts
2.3 总还原力分析
由图2可知,8种提取物在所设定的浓度范围0.001~0.1 g/mL内,随着浓度的升高,总还原力呈上升的趋势。三种包含30%、70%和100%龙眼核的B′、C′和D′与未发酵的B、C和D相比,总还原能力下降,可能是灵芝发酵后菌质内的酚类和黄酮类物质含量下降所致;纯高粱接入灵芝发酵组A′总还原力相对A组有所提高,可能与灵芝菌丝生长中产生的具有还原能力的物质有关[17-18]。
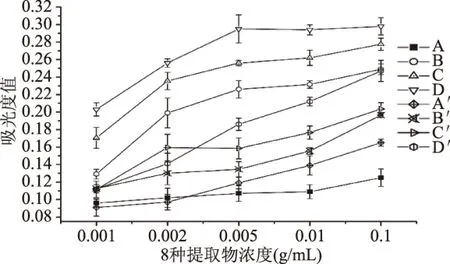
图2 8种不同提取物的总还原力测定结果Fig.2 Determination results of total reducing capacity of 8 different extracts
2.4 清除DPPH自由基能力比较
由图3可知,8种提取物在所设定的浓度范围0.001~0.1 g/mL内,随着浓度的升高,DPPH自由基的清除能力呈上升的趋势。C、D组未经过灵芝发酵的基质,其DPPH自由基清除能力较强,设定的最低浓度清除能力能够达到80%以上,经过灵芝发酵后DPPH自由基清除能力均有下降,可能是灵芝发酵后龙眼核内的多酚类和黄酮类物质含量下降所致;A′组DPPH自由基清除能力相对A组有较大的增强,可能与灵芝菌丝生长中产生的活性物质有关[17-18]。

图3 8种不同提取物清除DPPH自由基能力结果Fig.3 Determination results of scavenging DPPH ability of 8 different extracts
2.5 ABTS自由基清除能力的测定结果
由图4可知,8种基质的提取物在所设定的浓度范围0.001~0.1 g/mL内,随着浓度的提高,ABTS自由基的清除率呈现上升的趋势。含有相同重量百分比龙眼核的培养基质接菌培养后提取物对ABTS清除率较未接菌处理组的清除能力下降,可能与灵芝发酵后基质内多酚类和黄酮类物质含量的下降有关[24]。A′组ABTS自由基清除能力相对A组有所提高,可能与灵芝菌丝在高粱中生长产生的活性物质有关[17-18]。

图4 8种不同提取物ABTS自由基清除能力Fig.4 Determination results of scavenging ABTS ability of 8 different extracts
2.6 Fe3+还原能力的测定结果
由图5可知,6种包含有龙眼核的基质提取物在所设定的浓度范围0.001~0.01 g/mL内,随着各自浓度的升高,其Fe3+还原能力呈现上升的趋势,不含龙眼核的A和A′组无论有无灵芝的发酵,对Fe3+还原能力均较弱;未使用灵芝发酵的B、C、D组和灵芝发酵的B′、C′、D′组相比,对Fe3+的还原能力更强。

图5 8种不同提取物Fe3+还原能力Fig.5 Determination results of Fe3+ reduction ability of 8 different extracts
3 讨论与结论
本研究中龙眼核经过灵芝固体发酵后,发酵龙眼核提取物中的糖的含量显著性增加(p<0.05),多酚类和黄酮类物质含量较未发酵的对照组显著性降低(p<0.05),说明灵芝生长中能够利用或分解培养基质中的酚类物质和黄酮类物质[14-15,22],灵芝发酵中草药的研究也表明,灵芝发酵能显著改变中药材中的活性成分,起到减毒增效的作用[15-16]。抗氧化能力检测结果表明,灵芝固体发酵龙眼核后的提取物仍然保持了一定的抗氧化活性,说明灵芝发酵龙眼核后产生的菌质兼具了营养和保健两种属性。灵芝对高粱的发酵表明,发酵后(A′组)增加了高粱的抗氧化活性,该结果也和猴头菌[17]和灵芝[18]发酵普通食材可以增加食材的保健成分和保健效果的研究结果一致。本研究结果为龙眼核的食用或饲用资源的拓展利用提供了实验依据。

