脱脂椰蓉可溶性膳食纤维制备工艺及单糖组成和理化特性分析
杜晓静,白新鹏,姜泽放,高 巍,张芳芳
(海南大学食品学院,生物活性物质与功能食品开发重点实验室,海南 海口 570228)
脱脂椰蓉为全脂椰蓉榨油后剩余部分,含有大量纤维素,是制备膳食纤维的良好原料,具有较高的经济价值。目前脱脂椰蓉被当作废弃物或直接用作动物饲料,既浪费资源,又造成环境污染,有效成分也未能被充分利用[1]。目前关于椰子油、椰子蛋白的研究较多,但关于脱脂椰蓉膳食纤维的报道还较少[2]。膳食纤维是指不被人体消化的多糖类碳水化合物和木质素的总称,被公认为第七大营养素[3-4]。现代社会对饮食的要求越来越精细化,对膳食纤维摄入量远远不够,膳食纤维摄入量不足会严重影响人类健康[5]。膳食纤维根据溶解性分为可溶性膳食纤维(soluble dietary fiber,SDF)和不可溶性膳食纤维(insoluble dietary fi ber,IDF),二者的功效作用不同[6]。SDF能在结肠中几乎被彻底水解,能够促进肠道益生菌生长,具有阻碍脂质运输、预防心血管疾病以及清除自由基的作用[7-9];IDF具有能够促进肠胃蠕动、控制体重、缓解便秘、防治癌症等作用[10-12]。因此SDF含量是衡量膳食纤维品质优劣的重要指标[13]。
目前对脱脂椰蓉膳食纤维的研究程度并不深,相关报道较少,脱脂椰蓉膳食纤维提取方法有酶法[1]、化学法[2]和发酵法[14]。但目前国内外针对椰蓉膳食纤维的提取多采用化学法,虽然该法工艺简单、成本低,但膳食纤维得率低、容易造成化学残留;酶法可获得高纯度产品,但酶制剂成分较高。因此本研究以脱脂椰蓉为原料,采用酶-化学法提取椰蓉SDF,应用响应面分析法优化提取工艺条件,确定SDF最佳的提取工艺,对提取的SDF进行单糖成分分析和结构表征,同时分析其理化性质,为脱脂椰蓉粕的综合开发利用提供可靠的科学依据和广阔的市场前景。
1 材料与方法
1.1 材料与试剂
脱脂椰蓉粕 海口市大白康健医疗有限公司;95%乙醇溶液 西陇科学股份公司;磷酸氢二钾、磷酸二氢钾、氢氧化钠(均为分析纯) 广州试剂化学厂;α-淀粉酶(3 700 U/g)、糖化酶(100 000 U/g) 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
AII研磨机 广州仪科实验室技术有限公司;CU-420恒温水浴锅 上海齐欣科学仪器有限公司;EL204型电子天平 梅特勒-托利多仪器(上海)有限公司;RE52CS旋转蒸发仪 上海亚荣生化仪器厂;GL-20G-II高速冷冻离心机 北京时代北利离心机有限公司;PHS-3D酸度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 脱脂椰蓉预处理
把脱脂椰蓉粕冻干后粉碎,过80 目筛,密封备用;酶解:取脱脂椰蓉粉样品2 g,添加40 mL蒸馏水,调pH 6.5,加入混合酶(α-淀粉酶-糖化酶1∶1,m/m)60 ℃水浴边酶解边搅拌;灭酶:100 ℃水浴灭酶10 min;碱解:灭酶后,待温度降至60 ℃加入适量的NaOH溶液进行碱解,并不断搅拌;醇沉:将提取液于5 000 r/min离心10 min,取上清液旋蒸后用4 倍体积的95%乙醇溶液进行醇沉过夜,干燥称质量即为SDF[9,15]。椰蓉SDF得率计算见式(1):

式中:m1为提取SDF质量;m为样品质量。
1.3.2 影响椰蓉SDF得率的单因素试验
准确称取2 g椰蓉粉,按料液比1∶20(g/mL)加入蒸馏水,固定混合酶添加量(质量分数)0.4%、酶解时间60 min、碱液(NaOH溶液)质量分数4%、碱解时间30 min条件,分别设置混合酶添加量为0.2%、0.3%、0.4%、0.5%、0.6%;酶解时间30、40、50、60、70 min,1 mol/L的碱液质量分数2%、3%、4%、5%、6%;碱解时间10、20、30、40、50 min。抽滤,取上清液,浓缩后加入4 倍体积的95%乙醇溶液醇沉过夜,离心取沉淀物,冻干称量,计算SDF得率,考察混合酶添加量、酶解时间、碱液质量分数、碱解时间对SDF得率的影响。
1.3.3 Box-Behnken优化试验
采用Design-Expert软件中的Box-Behnken建立数学模型,以混合酶添加量、酶解时间、碱液质量分数和碱解时间4 个单因素为自变量,椰蓉SDF得率Y为响应值,采用响应面分析法优化提取工艺。试验设计因素水平见表1。

表1 Box-Behnken试验因素与水平Table1 Coded levels and corresponding actual levels of independent variables used for Box-Behnken design
1.3.4 脱脂椰蓉SDF单糖组成的测定
1.3.4.1 单糖衍生化
采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生法测定脱脂椰蓉SDF单糖组成。分别取400 μL的混合单糖标准液或多糖水解液于5 mL具塞试管中,加400 μL PMP-甲醇溶液,涡旋混匀;于70 ℃水浴反应2 h,取出放置冷却至室温;加400 μL 0.3 mol/L盐酸溶液中和(pH 6~7);加水200 μL,再加等体积的氯仿,涡旋混匀振摇,静置,弃去氯仿相,萃取2 次。将水相用0.45 μm微孔膜(水系)过滤后供高效液相色谱进样分析。
1.3.4.2 样品水解液的制备
称取10~20 mg多糖样品于10 mL钳口瓶中,加入5 mL的2 mol/L三氟乙酸(trifluoroacetate,TFA),充N2封管,110 ℃烘箱中水解6 h;冷却后打开盖,取2 mL加入1 mL甲醇后,在70 ℃水浴下用N2吹干,如此重复2 次,以去除TFA;加入2 mL 0.3 mol/L NaOH溶液充分溶解残渣,为样品多糖水解液。
1.3.4.3 高效液相色谱检测条件
仪器型号:Agilent 1100,配二极管阵列检测器;色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm);流动相A:100 mmol/L磷酸钠缓冲液(pH 6.4);流动相B:乙腈;检测波长250 nm;柱温30 ℃;流速1 mL/min;进样量5 μL。洗脱程序:0~10 min,85%~83% A;10~30 min,83%~80% A;30~35 min,80%~60% A;35~36 min,60%~85% A;36~40 min,85% A。
1.3.5 红外光谱分析
精确称取干燥的脱脂椰蓉粉和椰蓉SDF样品各1 mL于玛瑙研钵中,加入100 mg干燥KBr晶体,在红外灯照射下研磨至极细混匀,用压片机压片,制成一定直径和厚度的透明片,于红外分光光度计400~4 000 cm-1红外区扫描,测定红外光谱曲线。
1.3.6 原料椰蓉和脱脂椰蓉膳食纤维理化性质的测定
1.3.6.1 持水力的测定
准确称取1 g椰蓉SDF加50 mL去离子水,25 ℃搅拌2 h,3 000 r/min离心30 min,将上清液倒出,称质量得到吸水后的样品,按式(2)计算持水力[16]:

1.3.6.2 膨胀性的测定
准确称取1 g椰蓉SDF置于25 mL量筒中,加入15 mL蒸馏水,振荡摇匀后浸泡24 h测定体积,按式(3)计算膨胀性[17]:

1.3.6.3 持油力的测定
准确称取1 g椰蓉SDF加入15 g花生油,混匀后于常温下静置1 h,3 000 r/min离心15 min,取沉淀物(吸油后的样品),称质量,按式(4)计算持油力[18]:

1.3.7 椰蓉SDF纯度的测定
按照AOAC 993.19[17],利用凯式定氮法进行蛋白质残留检测,对适量样品进行灰分测定,并计算其纯度[18-19]。
2 结果与分析
2.1 脱脂椰蓉粉成分分析

表2 脱脂椰蓉粉主要成分含量Table2 Main components of defatted coconut flour%
由表2可知,脱脂椰蓉粉中含13.5%的蛋白质,粗纤维质量分数为63.25%,膳食纤维相对含量为70.14%,可知脱脂椰蓉粉具有丰富的纤维组分。如将其充分利用,不仅可以充分利用脱脂椰蓉资源,而且可为脱脂椰蓉粕的综合开发利用提供广阔的市场前景。
2.2 脱脂椰蓉SDF提取单因素试验结果
2.2.1 混合酶添加量对脱脂椰蓉SDF得率的影响
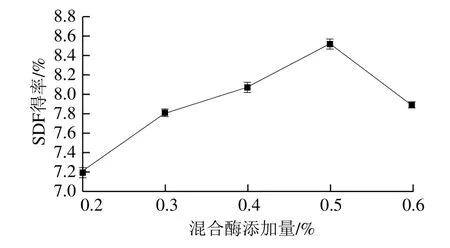
图1 混合酶添加量对脱脂椰蓉SDF得率的影响Fig.1 Effect of enzyme dosage on the yield of SDF
由图1可知,混合酶添加量对SDF得率影响很大。椰蓉SDF得率随加酶量的增加而逐渐升高,当混合酶添加量为0.5%时,得率达到8.53%;继续增加混合酶添加量,膳食纤维得率开始降低,这可能是因为椰蓉中IDF水解为SDF,生成了小分子的多糖、低聚糖或单糖,乙醇无法醇沉下来,从而使得SDF得率下降[20-21]。因此混合酶添加量以0.5%左右为宜。
2.2.2 酶解时间对脱脂椰蓉SDF得率的影响

图2 酶解时间对脱脂椰蓉SDF得率的影响Fig.2 Effect of enzymatic hydrolysis time on the yield of SDF
由图2可知,随着酶解时间的延长,SDF得率逐渐增加,当酶解时间为50 min时,SDF得率最高,为7.17%。继续延长酶解时间,得率呈下降趋势;这是因为随着酶解时间的延长混合酶作用于SDF,使得半纤维素等发生降解,生成小分子的单糖,从而使得率下降[22]。因此酶解时间选择50 min左右为宜。
2.2.3 碱液质量分数对脱脂椰蓉SDF得率的影响

图3 碱液质量分数对脱脂椰蓉SDF得率的影响Fig.3 Effect of alkali concentration on the yield of SDF
由图3可知,当碱液质量分数为2%~5%时,椰蓉SDF得率不断增加,当添加量为5%时,得率达到最大为7.45%;当继续增加碱液添加量,得率逐渐减低,可能是因为碱解过程中大部分椰蓉蛋白质溶解于碱液中,可将蛋白质和部分淀粉去除,但当碱液质量分数过大,椰蓉中的纤维素与碱液发生反应引起纤维素的降解,导致得率降低[23]。因此碱液质量分数以5%为宜。
2.2.4 碱解时间对脱脂椰蓉SDF得率的影响

图4 碱解时间对脱脂椰蓉SDF得率的影响Fig.4 Effect of alkaline hydrolysis time on the yield of SDF
由图4可知,当碱解时间为10~40 min内,椰蓉SDF得率逐渐升高,并在处理时间为40 min时,椰蓉SDF得率达到7.70%。继续延长碱解时间,SDF得率开始下降;这是因为当碱解时间过短时蛋白质水解不完全,造成得率过低,但碱解时间过长会造成水解时间过长,从而使得率下降[24]。因此碱解时间以40 min左右为宜。
2.3 SDF提取工艺回归模型的建立及方差分析
应用响应面法进行优化,以X1(混合酶添加量)、X2(酶解时间)、X3(碱液质量分数)和X4(碱解时间)为自变量,以SDF得率为响应值Y,采用Box-Behnken试验设计原理,设计4因素3水平响应面分析方法对亚临界水提取SDF工艺进行优化,结果如表3所示。
对表3中数据进行二次多元回归拟合,得到回归方程:Y=11.32+0.87X1+0.22X2+0.31X3+0.098X4-0.47X1X2-0.083X1X3+0.11X1X4-0.22X2X3+0.92X2X4-0.088X3X4-3.03-1.14-1.94-1.32。
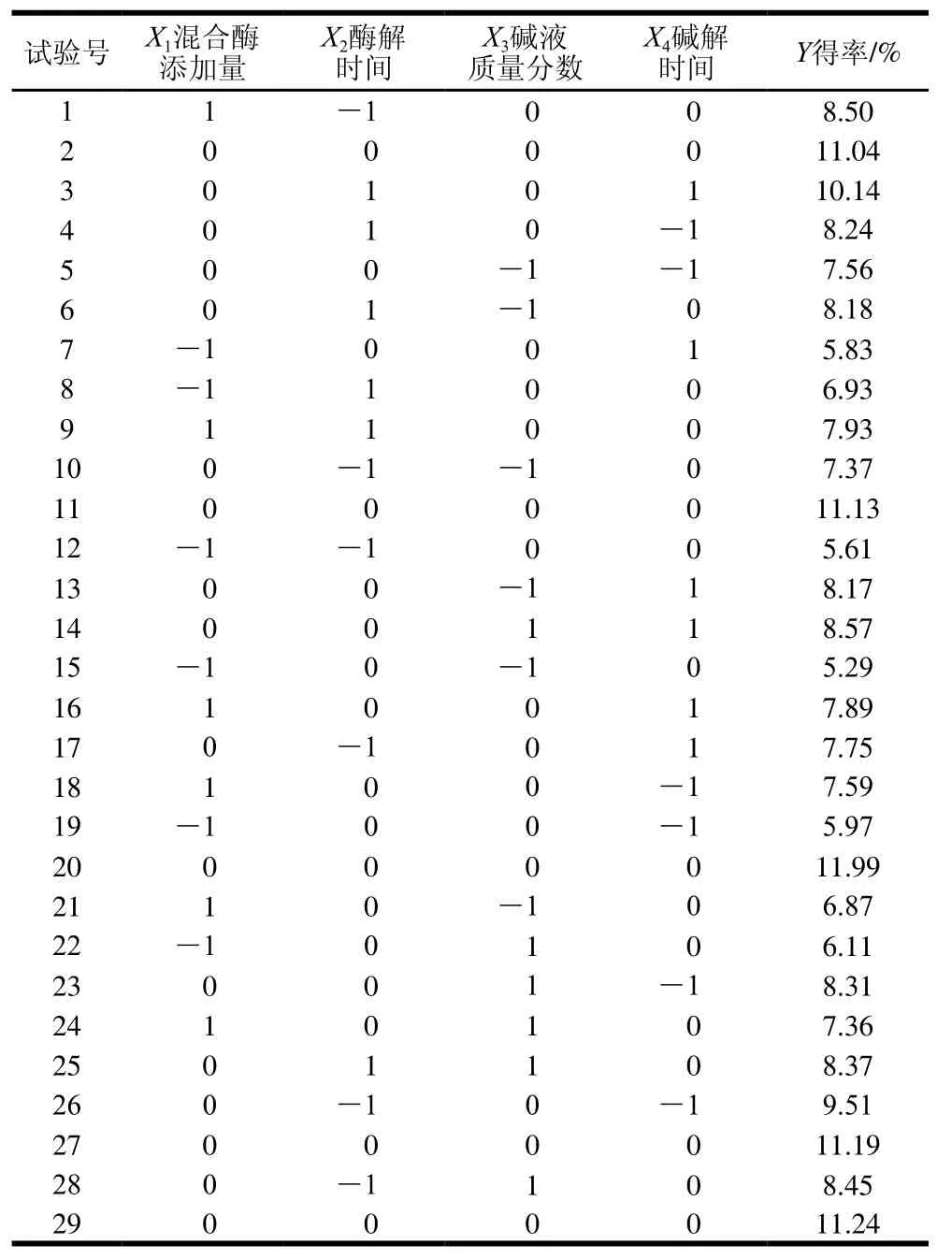
表3 响应面试验设计与结果Table3 Experimental design and results for respond surface analysis
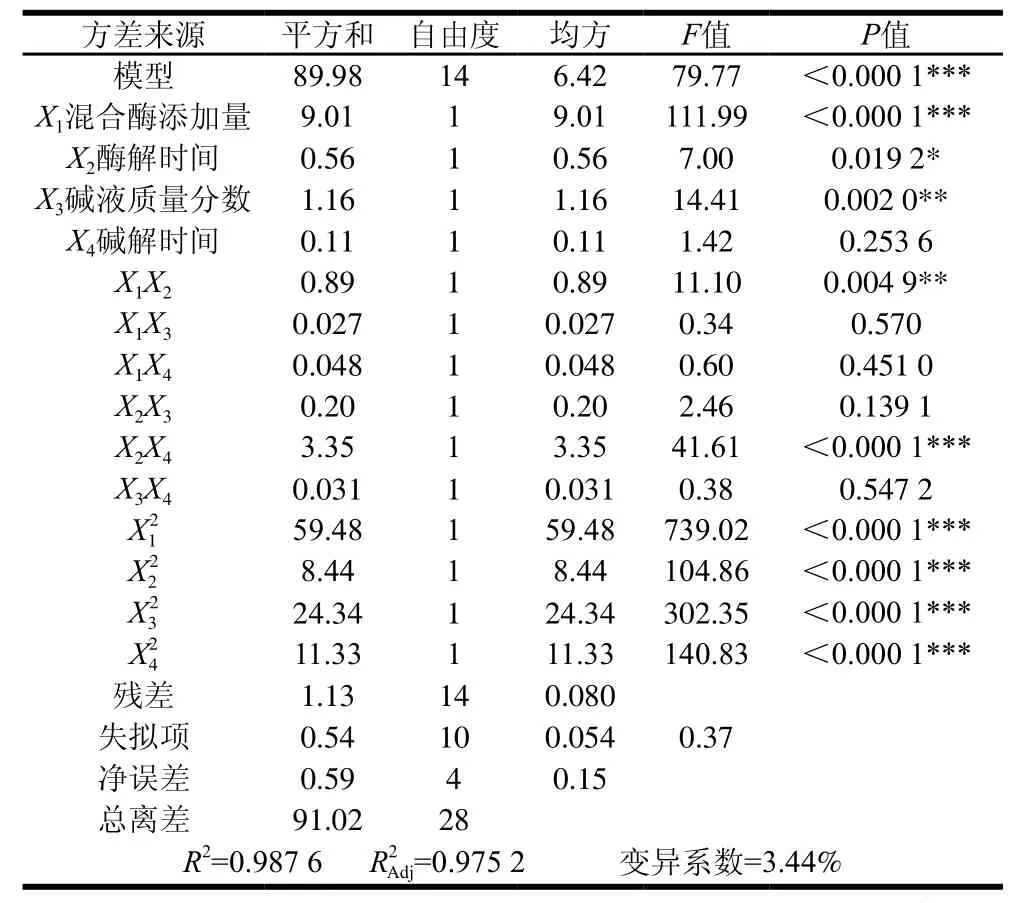
表4 回归方程方差分析及结果Table4 Analysis of variance for regression model
由表3可知,所选模型高度显著(F=79.77,P<0.000 1),失拟项差异不显著(P=0.908 8>0.05),表明方程对试验拟合程度较好。对回归方程进行显著性检验,表明混合酶添加量X1及二次项、酶解时间、碱液质量分数、碱解时间对SDF得率有高度显著影响;碱液质量分数X3、X1X2对SDF得率影响极显著;酶解时间X2对SDF得率影响显著。结果表明,模型回归系数R2为0.987 6,校正决定系数为0.975 2,表明97.52%的响应值变化可用此模型来解释。因此用此模型对脱脂椰蓉SDF得率进行分析和预测是可靠的。
2.4 响应面分析


图5 混合酶添加量、酶解时间、碱液质量分数和碱解时间交互作用对SDF得率的影响Fig.5 Respond surface plots showing the interactive effect of variables on the yield of SDF
由图5可知,响应值随着各因素水平的增加而增加,达到最高点后,响应值开始逐渐减小。混合酶添加量和酶解时间(X1X2)、酶解时间和碱解时间(X2X4)之间交互作用显著。
2.5 提取工艺条件的优化和可靠性验证结果
为进一步确定各因素的最佳取点,利用Design-Expert软件进行分析,通过分析可得到最大响应值所对应的最佳因素条件:混合酶添加量0.5%、酶解时间50 min、碱液质量分数5%、碱解时间40 min,此工艺下椰蓉SDF理论得率为11.99%。此优化提取条进进行3 次验证实验,得到实际测得SDF得率平均值为11.78%。与理论值较为接近,表明此模型优化脱脂椰蓉SDF提取工艺可靠。
2.6 脱脂椰蓉膳食纤维单糖组成分析
由图6可知,脱脂椰蓉SDF单糖的保留时间为甘露糖(16.122 min)、核糖(18.955 min)、鼠李糖(19.585 min)、葡萄糖醛酸(23.469 min)、半乳糖醛酸(25.633 min)、葡萄糖(26.974 min)、氨基半乳糖(27.874 min)、半乳糖(30.262 min)、阿拉伯糖(31.637 min);由脱脂椰蓉粉SDF高效液相色谱图可以看出,椰蓉SDF在11.5 min时出现了一个杂锋,这是因为在样品前处理过程中加入了衍生试剂PMP的原因;脱脂椰蓉SDF由9 种单糖组成,主要单糖成分为甘露糖、氨基半乳糖、半乳糖和阿拉伯糖质量浓度较高,分别为537.21、40.38、39.48、15.83 mg/L。

图6 椰蓉SDF高效液相色谱图Fig.6 Monosaccharide analysis of SDF from coconut flour
2.7 红外光谱分析

图7 脱脂椰蓉及椰蓉SDF红外光谱对比图Fig.7 Infrared spectra of defatted coconut flour and its SDF
由图7可知,在1 114.15、1 183.62、1 404.63、1 548.75、1 652.09 cm-1处的吸收峰消失,在1 107.06、1 157.21、1 315.35、1 461.92、1 637.43、1 743.65、2 924.09、2 954.95 cm-1出现了新的特征吸收峰。据此可知,酶-化学法脱脂椰蓉粉发生了一定程度的反应。
椰蓉S D F具有典型的多糖特征吸收峰,在3 422.76 cm-1存在较大吸收峰,是O—H伸缩振动吸收,说明椰蓉SDF处于缔合状态的氢键较多;2 929.29 cm-1处是由饱和C—H伸缩振动吸收;1 652.09 cm-1处是糖分子中羰基C=O的伸缩振动吸收,1 548 cm-1处是木质素苯环的吸收峰,表示样品中存在芳香族类有机物;1 404 cm-1处是由C—H变角振动吸收;1 200~1 400 cm-1处是糖分子中C—H键的变角振动吸收,1 114.15 cm-1处有一强吸收峰,是吡喃糖环中的O—H变角振动吸收峰;873.71 cm-1吡喃糖C—H变形振动的特征吸收峰;811.62 cm-1处是由呋喃糖分子中C—H键的变角振动吸收;619 cm-1有一强吸收峰,可能是存在游离的醇或酚。
2.8 脱脂椰蓉SDF理化性质分析
实验结果表明,脱脂椰蓉SDF持水力(3.8 g/g)高于蔗渣膳食纤维(3.6 g/g)[25]、花生壳膳食纤维(2.64 g/g)[26]、葡萄皮渣膳食纤维(2.98 g/g)[27];所得膨胀性(3.1 mL/g)高于葡萄皮渣膳食纤维(1.75 mL/g)[27],与花生壳膳食纤维(3.1 mL/g)相当[26];所得持油性(5.2 g/g)高于蚕豆膳食纤维(4.48 g/g)[29]、花生壳膳食纤维(1.12 g/g)[26]以及葡萄皮渣膳食纤维(1.05 g/g)[28]。由此可见,采用酶-化学提取的椰蓉膳食纤维理化性质更突出,这主要是因为在提取过程中去除椰蓉非膳食纤维成分后,膳食纤维暴露出来的亲水集团,使得具有更强的吸附性[30]。
2.9 脱脂椰蓉SDF纯度测定结果
由实验结果可知,椰蓉SDF纯度为82.12%。郑亚军等[2]研究稀碱法提取椰子SDF工艺操作简单、成本低,纯度达到65.18%。本实验利用酶-化学法先用糖化酶分解椰蓉中的多糖,淀粉酶去除淀粉,反应温和,使得提取出的SDF纯度较高;再用碱除去蛋白质,缩短了碱解时间,从而使蛋白质碱解完全,具有工艺简单、反应温和、纯度高、效率高等优点。
3 结 论
采用酶-化学法提取脱脂椰蓉中的SDF,在单因素试验基础上利用响应面试验进行优化分析,获得最佳工艺参数为混合酶添加量0.5%、酶解时间50 min、碱液质量分数5%、碱解时间40 min,在此条件下SDF得率为11.78%;持水力、膨胀性和持油性分别为3.8 g/g、3.1 mL/g和5.2 g/g。红外光谱分析脱脂椰蓉SDF处于缔合状态的氢键较多;高效液相色谱分析单糖组成结果表明椰蓉SDF中主要单糖成分为甘露糖、氨基半乳糖、半乳糖和阿拉伯糖质量浓度较高,分别为537.21、40.38、39.48、15.83 mg/L。

