益生性植物乳杆菌的温度胁迫处理及其对发酵冰淇淋品质和菌活性的影响
赵 雯,吴凤玉,郑 义,张 健,姜芸云,赵 笑,杨贞耐
(北京食品营养与人类健康高精尖创新中心,食品质量与安全北京实验室,北京工商大学,北京 100048)
益生菌冰淇淋是在冰淇淋原本美味的基础上,进一步赋予产品良好的肠道益生特性,因此广受欢迎,是冷饮市场近年研究与开发的热点。益生菌冰淇淋自1970年在美国上市以来,其销量占比已经超过了冷饮市场总体的25%,而中国益生菌冰淇淋销量预计将达到100亿 元市场规模[1]。
冰淇淋配料种类丰富,可以为益生菌提供充足的营养物质如乳蛋白、乳脂肪、乳糖、维生素等,并且具有较为温和的pH值环境,因此被认为是良好的益生菌传递载体[2]。然而,冰淇淋制作过程需要低温凝冻,运输过程中不可避免的冻融循环以及长时间低温贮藏都会对菌体造成冷冻损伤[3]。低温环境下,菌体对碳水化合物与氨基酸的利用能力下降,细胞膜的流动性下降,膜相关功能受损,RNA形成稳定的二级结构,蛋白质合成速率减缓,对冰淇淋中活菌数和菌活性的保持产生不利影响[4]。实验室前期研究发现,冰淇淋经凝冻过程和4 周低温冷冻贮藏后,植物乳杆菌(Lactobacillus plantarum)YW11活菌数下降0.8~1.61 个数量级,耐酸和胆盐的特性也随之下降[5]。世界卫生组织对益生菌产品的定义为食品中含有充足数量的活的微生物,经过食品加工的各个过程,以及进入人体肠道以后,仍能保持适当的活菌数量和菌活性[6]。研究指出益生菌产品若想达到其预期的功能特性,益生菌活菌数在产品货架期内应保持在106~107CFU/g范围内[7]。在巴西,法律规定,活菌数应在108~109CFU/g范围内才可以在产品标签上标注为含有益生菌食品[8]。因此如何保持菌株在冰淇淋产品生产加工及贮存过程中的活菌数和菌活性,成为目前亟待解决的问题。
多种策略应用于如何保护菌株以缓解低温胁迫对其体造成的伤害,如胁迫预处理、添加巧克力等保护因子、微胶囊包埋技术、优化冰淇淋配料组成及产品加工工艺等[9-11]。其中胁迫预处理会诱使菌体进化出特定的胁迫-敏感系统以及胁迫-防御机制,使得菌体可以耐受长期不利的环境条件或突然的环境改变[12-13]。冷激蛋白(cold-shock protein,CSP)家族是微生物在低温环境下诱导产生的一类重要分子伴侣家族,参与转录、翻译、蛋白质折叠等一系列过程[14]。进一步研究表明,细菌在应对高温胁迫环境时,会诱导出与低温胁迫相似的代谢通路与蛋白质合成变化,产生交互保护作用而提高菌株的低温耐受性[15]。巧克力中含有丰富的可可脂成分,可在菌体周围形成保护层,进而对外界胁迫环境起到缓冲作用,并且有助于益生菌在肠道中的靶向释放[16]。Silva等[17]使用巧克力作为L. acidophilus LA3和Bifidobacterium animalis subsp. lactis BLC1的传递载体,其活菌数在4 ℃贮存120 d后没有发生明显变化。Kemsawased等[18]使用巧克力作为L. casei 01和L. acidophilus LA5的固定化载体,其活菌数在4 ℃贮存60 d后大于106CFU/g,并且具有较为良好的模拟肠道环境耐受性。
本研究利用1 株分离自西藏灵菇的益生性植物乳杆菌K25,将其加入到冰淇淋浆料中,发酵制备益生菌冰淇淋。前期实验表明,植物乳杆菌K25能够提高衰老小鼠的抗氧化能力,降低小鼠血清胆固醇水平,抑制口腔变异链球菌;进一步对K25菌株全基因组测序及蛋白质组学的研究表明,该菌株具有与低温耐受相关的基因及蛋白质表达[19-20];此外K25菌株具有良好的胃酸和胆盐耐受性,适宜用于冰淇淋的发酵制作。本研究考察低温和高温胁迫预培养菌株及添加巧克力辅料的方法,对冰淇淋中益生性植物乳杆菌K25生物活性和肠道环境耐受性的保护作用,以及温度胁迫预培养后的菌株对冰淇淋品质的影响。
1 材料与方法
1.1 材料与试剂
植物乳杆菌K25由吉林省农业科学院提供,菌株保存在含20%甘油的MRS培养基中,-80 ℃冻存。使用前接种于MRS液体培养基,37 ℃连续活化3 次。
大豆蛋白胨、牛肉膏、酵母粉、葡萄糖、磷酸氢二钾、乙酸钠、柠檬酸钠、硫酸镁、硫酸锰、乙酸、琼脂、吐温8.0(均为分析纯) 国药集团化学试剂有限公司;脱脂乳粉 新西兰恒天然集团有限公司;奶油雀巢股份有限公司;巧克力酱 费列罗股份有限公司。
MRS琼脂培养基:大豆蛋白胨10.0 g/L、牛肉膏10.0 g/L、酵母粉5.0 g/L、葡萄糖20.0 g/L、吐温80 1.0 mL/L、磷酸氢二钾2.0 g/L、乙酸钠5.0 g/L、柠檬酸钠5.0 g/L、硫酸镁0.2 g/L、硫酸锰0.054 g/L、琼脂15 g/L,蒸馏水1 000 mL,1 mol/L乙酸调pH值为6.5,121℃灭菌15 min。
1.2 仪器与设备
GJJ-0.03/100小型实验室均质机 上海诺尼轻工机械有限公司;MLS-3750高压蒸汽灭菌器 日本三洋公司;BQ7225软质冰淇淋机 黄石东贝制冷有限公司;DV-II黏度计 英国Brookf i eld公司。
1.3 方法
1.3.1 低温及高温胁迫预处理对植物乳杆菌K25低温耐受性的影响
采用不同温度条件对处于对数生长期的植物乳杆菌K25进行胁迫预处理,具体方法参照Ergin等[21],稍作改动。分别采取低温4、10、20 ℃和高温45、50、55 ℃胁迫处理0.5、1.5、3、5、8、18、24 h。胁迫预处理后的菌株分为4 部分贮存。一部分于MRS固体培养基37 ℃培养72 h测定初始活菌数,剩余3 部分则贮藏于-20 ℃,分别在1、15、30 d测定其活菌数变化。未经处理的植物乳杆菌 K25(对照)采取相同方法测定其活菌数变化。
1.3.2 C-K25与H-K25制作巧克力冰淇淋
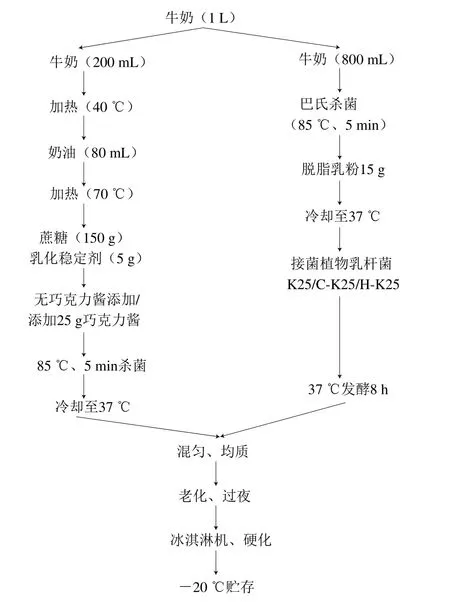
图1 冰淇淋制作流程Fig.1 Flow chart of ice cream production process
分别选用低温(cold adapted-K25,C-K25)和高温(heat adapted-K25,H-K25)处理组中终活菌数最高的两株菌用于冰淇淋制作,使用未经处理的植物乳杆菌K25作对照组。冰淇淋具体制作方式如图1所示。
1.3.3 冰淇淋理化性质分析
1.3.3.1 滴定酸度和pH值
滴定酸度测定参照于志会等[22]方法,略作修改。取10 g冰淇淋浆料样品,加入20 mL去离子水,充分混匀,加入2 滴酚酞指示剂,用浓度为0.1 mol/L NaOH标准溶液滴定。滴定酸度为1 g冰淇淋浆料消耗浓度为0.1 mol/L NaOH溶液的毫升数,消耗1 mL浓度为0.1 mol/L的NaOH溶液相当于1 °T。pH值采用pH计测定。
1.3.3.2 膨胀率
分别称取100 mL冰淇淋浆料质量M1和冰淇淋成品质量M2,测定其膨胀率,按照式(1)计算:
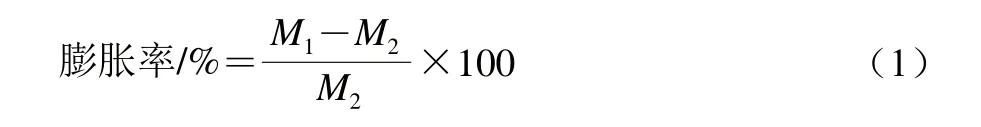
1.3.3.3 融化率
称取25 g于-20 ℃贮存30 d冰淇淋成品,置于0.833 mm的不锈钢筛网上,在温度25 ℃、相对湿度75%的环境下静置1 h,每隔10 min称其融化质量,按式(2)计算融化率:

1.3.3.4 黏度
采用布氏黏度仪测定老化后的冰淇淋浆料黏度。将-20 ℃冷冻的冰淇淋样品于4 ℃缓慢解冻,用玻璃棒将冰淇淋样品轻轻搅拌均匀(顺时针和逆时针各搅拌10 圈),选用LV34转子,测定条件为5 r/min,每隔5 s取一个测试值,测定时间范围为0~120 s。
1.3.3.5 硬度
冰淇淋样品在-20 ℃冰箱贮存48 h后,采用Texture Analyzer XT2质构仪进行硬度测定,P/5 Cylinder stainless探头,直径0.5 cm,测定速率1 mm/s,刺入深度0.5 cm。
1.3.4 冰淇淋中植物乳杆菌K25活菌数的测定
采用平板涂布计数法测定冰淇淋冷藏期间的活菌数。取5 g冰淇淋样品,45 mL无菌生理盐水稀释。取稀释后的样品溶液1 mL,梯度稀释后,取适宜的稀释液倍数接种于MRS固体培养基,37 ℃培养48 h,记录各组冰淇淋样品浆料-20 ℃贮存1、15、30、60 d后活菌数变化。
1.3.5 冰淇淋中植物乳杆菌K25模拟胃肠道耐受性实验
取-20 ℃贮存30 d的冰淇淋样品,测定植物乳杆菌K25在体外模拟胃肠道环境下的存活能力。植物乳杆菌K25对人工模拟胃液、肠液的耐受性测定方法参照Buriti等[23]方法,略作改动。取冰淇淋样品25 g,使用22 mL 0.05 g/L NaCl溶液稀释后混合均匀制成样品溶液。人工模拟胃液:取10 mL样品溶液,0.5 mol/L HCl溶液调节pH 2.6~3.0,加入0.3 mL 3 mg/mL胃蛋白酶溶液,充分混匀后,37 ℃培养2 h,MRS固体培养基培养72 h测定活菌数。人工模拟胰液:取10 mL样品溶液,1 mol/L NaOH溶液调节pH 4.9~5.4。加入胆盐与胰酶分别至终质量浓度6、1 mg/mL,充分混匀后37 ℃培养2 h,MRS固体培养基培养72 h测定活菌数。
1.4 数据分析
使用SPSS 16.0处理数据,图表在Origin 7.5中生成,所有组别数据均测定3 次后取平均值,ANOVA进行显著性分析。
2 结果与分析
2.1 不同温度胁迫预处理对植物乳杆菌K25低温耐受性的影响
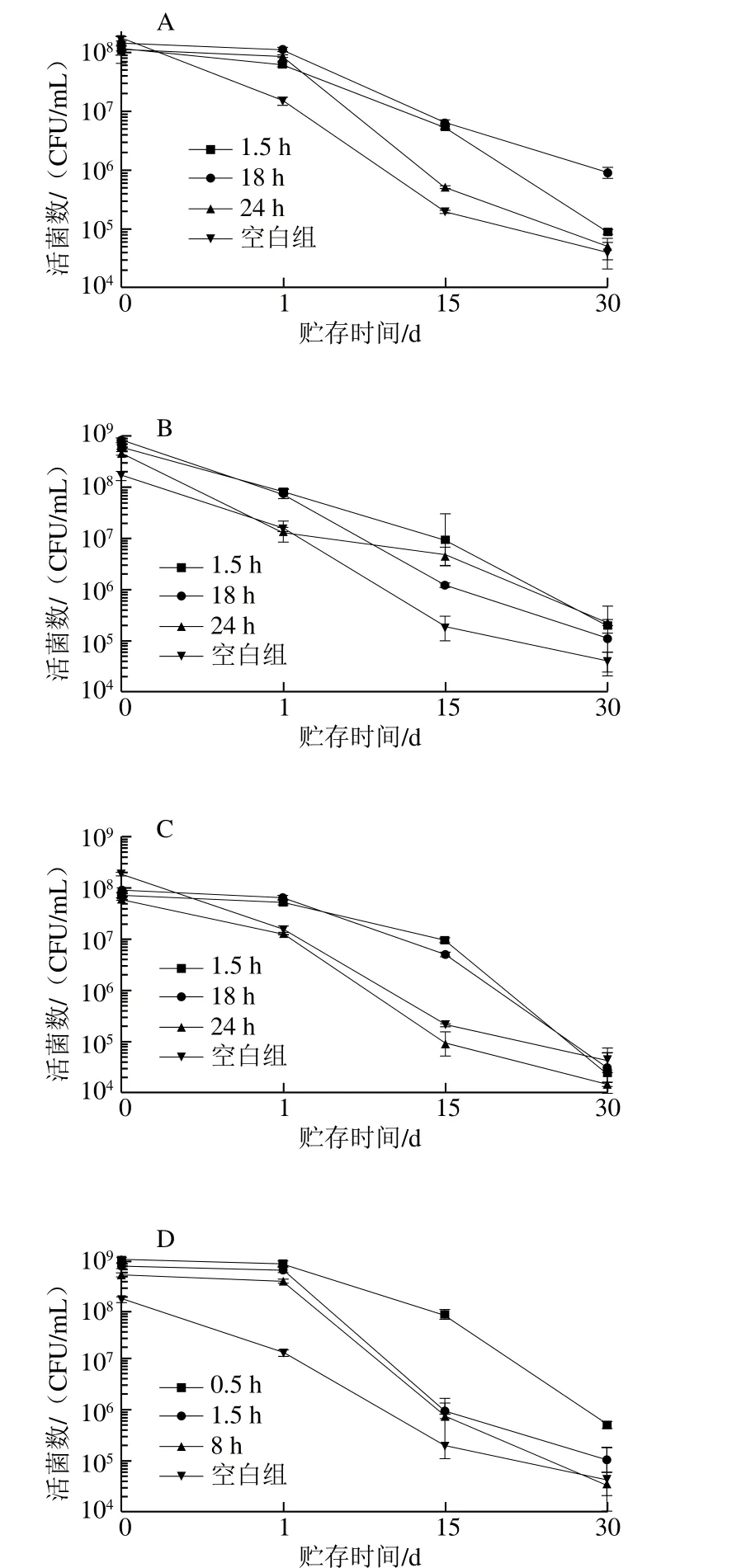

图2 不同温度胁迫-20 ℃处理活菌数变化Fig.2 Change in viable counts of L. plantarum K25 during storage at -20 ℃
如图2所示,所有组别的植物乳杆菌K25初始活菌数大致相同(108CFU/mL),低温胁迫1.5~24 h范围内,植物乳杆菌K25初始活菌数均略有增长,相反,热处理超过8 h后检测不到活菌数,表明植物乳杆菌K25不能耐受长时间高温环境。
植物乳杆菌K25在-20 ℃环境下贮存30 d后,其活菌数由最初的108CFU/mL降至104CFU/mL。图2 A~C显示,贮存1 d后,活菌数保持在1.12×107~1.2×108CFU/mL范围内,贮存30 d后,活菌数在1.5×104~1.10×106CFU/mL范围内,其中以贮存时间为15 d时,其活菌数下降幅度明显。10 ℃-18 h、10 ℃-24 h组冻藏30 d后其活菌数分别为1.14×105CFU/mL和2.20×105CFU/mL,而4 ℃-18 h组终活菌数最高1.10×106CFU/mL,为对照组活菌数的12 倍。图2D~F显示,贮存1 d后,活菌数保持在1.24×108~8.0×108CFU/mL。4 5℃-0.5 h组在-2 0 ℃贮存3 0 d后其活菌数为5.4×105CFU/mL,而55 ℃-0.5 h组终活菌数最高,为1.35×106CFU/mL,为对照组活菌数的15 倍。Wouters等[24]研究表明,L. lactis MG1363在10 ℃预先处理4 h后,于-20 ℃环境下贮存24 h菌株存活率增加约100 倍。Walker等[25]研究指出L. johnsonii VPI 11088在55 ℃胁迫预处理30 min后在-20 ℃贮存7 d,其活菌数与对照组相比增加了20%。Shao Yuyu等[26]研究指出,亚致死温度胁迫预处理诱导CSP编辑基因(cspA、cspB、cspC、cspD、cspE、cspF)过表达,该家族基因表达能够提高菌株低温耐受性。Komatsu等[27]则进一步证明热胁迫处理条件下诱导产生的热激蛋白同样可以增加细胞的冷冻耐受性,该蛋白可通过与大分子物质疏水相互作用进而增加其稳定性以发挥保护作用。Kandil等[28]则认为温度预处理能够提高菌株低温耐受性主要源于不同温度下酶构象和活性的改变。
在所有温度时间相互作用关系中,4 ℃-18 h与55 ℃-0.5 h胁迫预处理后植物乳杆菌K25在-20 ℃贮存30 d内降幅最小、终活菌数最高,活菌数分别由8.16(lg(CFU/mL))降至5.96(lg(CFU/mL))、9.25(lg(CFU/mL))降至6.13(lg(CFU/mL)),分别降低2.2、3.12 个对数级,对照组则由8.25 (lg(CFU/mL))降低至4.60(lg(CFU/mL)),降低3.65 个对数级。4 ℃-18 h与55 ℃-0.5 h胁迫预处理后植物乳杆菌K25在-20 ℃贮存30 d后的活菌数与未经处理的菌株相比分别提高了18.2%与10.4%,因此选用该2 种胁迫处理后的K25菌株用作冰淇淋的加工制作。
2.2 冰淇淋产品理化指标分析

表1 冰淇淋理化性质测定结果Table1 Physicochemical properties of ice cream fermented with cold-/heat- adapted L. plantarum K25
冰淇淋产品的酸度、膨胀率、融化率、黏度、硬度是影响产品口感与消费者感官的主要理化因素[29],本实验对冰淇淋产品理化指标的测定结果如表1所示。相同发酵时间内,不同组别的冰淇淋pH值、滴定酸度、膨胀率和融化率变化分别在5.82~6.11、30~45 °T、19.46%~44.93%、13.17~19.00 g/min范围内。其中温度胁迫处理后的K25发酵冰淇淋pH值较低,可能归因为胁迫处理影响了菌株的代谢通路,促进菌体产酸[14]。而C-K25组发酵冰淇淋膨胀率较高(35.81%)且融化率较低(14.67 g/min),具有良好的冰淇淋理化特性。不同组别的冰淇淋在黏度与硬度变化分别在707~1 079 mPa·s和728~1 156 N范围内,差异较为显著(P<0.05)。经胁迫处理后的植物乳杆菌K25发酵冰淇淋黏度、硬度均高于未处理组。不同组别理化性质的差别可能归因于胁迫环境下,菌株分泌过量的胞外多糖等代谢产物以保护菌体,这些代谢产物会对冰淇淋产品的黏度和硬度产生影响。Van Laere等[30]指出在亚致死高温胁迫下,与胞外多糖合成相关的半乳糖酶活性明显增强,进而促进胞外多糖的分泌。Nguten等[31]进一步指出胞外多糖黏附在细胞表面,降低细胞表面净电荷,进而增加其对不良环境的耐受性。Dertli等[32]研究则表明,与不产胞外多糖的菌株相比,使用产胞外多糖的菌株发酵冰淇淋,产品具有更高的黏度。Ergin等[21]使用温度胁迫预处理后的菌株发酵冰淇淋,其产品的黏度与硬度增加,将其解释为产品中菌株活性增加引起的胞外多糖产量增加。
2.3 植物乳杆菌K25发酵冰淇淋的活菌数变化

表2 低温和高温胁迫处理后的植物乳杆菌K25发酵冰淇淋于-20 ℃贮存60 d后的活菌数变化Table2 Viable counts of cold-/heat- adapted L. plantarum K25 in ice cream during storage for 60 days at-20 ℃(lg(CFU/mL))
保持菌株在产品冷冻加工过程以及货架期期间的活菌数和生物活性对冰淇淋产品的益生特性具有显著意义。不同组别冰淇淋浆料及-20 ℃贮存60 d内的活菌数变化如表2所示,植物乳杆菌K25发酵冰淇淋初始活菌数为8.48(lg(CFU/mL))。L. acidophilus、B. lactis Bb12、L. casei发酵冰淇淋的初始活菌数分别为7.36、7.45、6.49(lg(CFU/mL))[33-36]。结果表明,植物乳杆菌K25具有较为良好的冰淇淋基质发酵特性,适宜作为冰淇淋的发酵菌株或辅助发酵剂以提高产品中的活菌数。硬化过程活菌数下降最为明显,1 d后下降至7.52(lg(CFU/mL))(下降0.96 个对数级)。Zhang Jian等[5]对植物乳杆菌YW11发酵冰淇淋从加工到贮存期间的活菌数变化情况进行探讨,结果表明硬化过程对活菌数影响最大。L. acidophilus La-5和B. animalis Bb-1在冰淇淋凝冻过程中,其活菌数同样显著降低[35]。而Leandro等[36]研究则指出冰淇淋硬化过程对L. delbrueckii UFV H2b20活菌数影响较小。Ferraz等[11]指出凝冻对活菌数的影响主要与冰淇淋产品的脂肪含量与膨胀率相关。
植物乳杆菌K25发酵冰淇淋,从浆料至60 d贮存过程中,其终活菌数为5.63(lg(CFU/mL)),平均活菌数为6.8 3(l g(C F U/m L)),活菌数下降2.8 5 个对数级。其中 H-K 2 5 组发酵冰淇淋从浆料至6 0 d贮存过程中,终活菌数为7.2 6(l g(C F U/m L)),平均活菌数为7.7 9(l g(C F U/m L)),活菌数下降1.2 7 个对数级。C-K 2 5发酵冰淇淋从浆料至贮存过程中,其终活菌数为7.3 2(l g(C F U/m L)),平均活菌数为7.8 9(l g(C F U/m L)),活菌数下降1.36 个对数级。结果表明经过高温、低温胁迫预处理后的菌株,在冰淇淋发酵及贮存期间,其终活菌数分别提高1.63、1.69 个对数级。除对照组外,所有组别的冰淇淋活菌数在经60 d贮存后,均高于106CFU/mL,满足益生菌产品对活菌数的最基本要求。Arslan等[37]研究指出,通过分级冷冻的方式对菌株进行预处理,在冰淇淋发酵、加工和贮存过程,菌体细胞对冷冻条件耐受性增强。Zhang Jian等[5]指出与直接添加菌株发酵冰淇淋的方式相比,添加冷冻干燥后的菌粉进行冰淇淋制作,冰淇淋产品在发酵和贮存过程中活菌数保持较为稳定。这一方面归因于冷冻干燥过程添加的保护剂对菌株具有一定程度的保护作用,另一方面则归因于冷冻条件改变菌株胞内酶活性,使其能够更好地适应冷冻条件。有研究[21,38]采取低温和高温对L. acidulous进行胁迫预处理,并使用胁迫后的菌株制作冰淇淋,结果表明冰淇淋在冷冻贮藏120 d后,胁迫处理后的菌株的菌活数明显高于空白组。Chen Mingju等[39]表明热胁迫、冷胁迫预处理均可以提高L. kef i ranofaciens M1的低温耐受特性,并进一步提高该菌株的肠道环境耐受性。
K25-巧组冰淇淋从浆料至60 d贮存过程中,其终活菌数为6.04(lg(CFU/g)),平均活菌数为7.04(lg(CFU/mL)),活菌数下降2.47 个对数级。H-K25-巧组(添加巧克力)冰淇淋从浆料至60 d贮存过程中,其终活菌数为7.40(lg(CFU/mL)),平均活菌数为7.86(lg(CFU/mL)),活菌数下降1.16 个对数级。C-K25-巧组(添加巧克力)冰淇淋从浆料至60 d贮存过程中,其终活菌数为7.56(lg(CFU/mL)),平均活菌数为7.97(lg(CFU/mL)),活菌数下降1.07 个对数级。终活菌数与相应的未添加巧克力组分别提高了0.41、0.26、0.24 个对数级,表明巧克力的添加对菌株具有一定的保护作用。Possemiers等[40]使用巧克力作为L. helveticus CNCM I-1722和B. longum CNCM I-3470的微胶囊载体,制作益生菌冰淇淋,菌株在冷冻贮存期间活菌数稳定性增加,经体外模拟胃酸与胆汁消化后,活菌数分别保持91%和80%。Champagne等[41]将巧克力加入L. rhamnosus R0011和B. longum R0175微胶囊壁材中制作益生菌冰淇淋,低温贮存24 周,其存活率高于未加巧克力的包埋组与未包埋组。2.4 耐酸耐胆盐结果
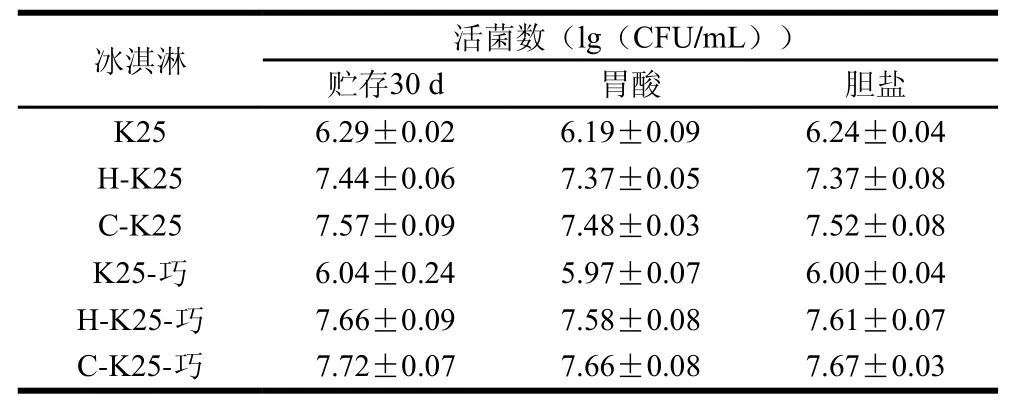
表3 人工模拟胃酸和胆盐环境对冰淇淋中不同温度胁迫处理植物乳杆菌K25活菌数的影响Table3 Viable counts of cold-/heat-adapted L. plantarum K25 in ice cream during exposure to simulated gastric and bile salt solutions
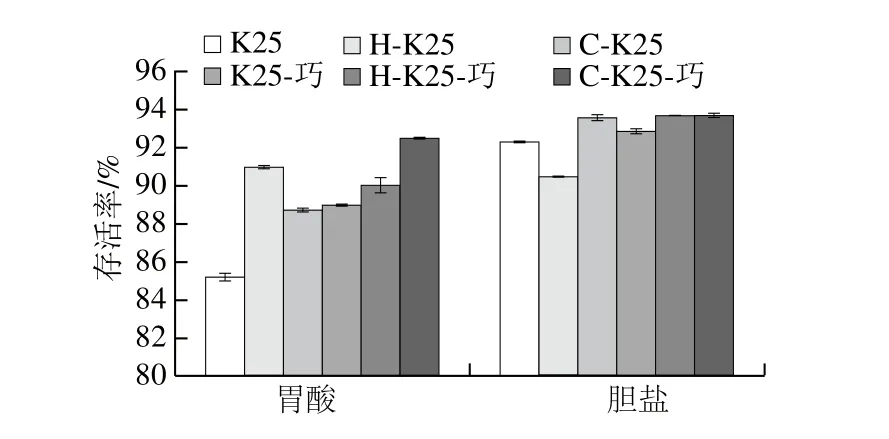
图3 冰淇淋-20 ℃贮存30 d后植物乳杆菌K25在人工模拟胃酸和胆盐环境下的存活率Fig.3 Survival rates of cold-/heat-adapted L. plantarum K25 in ice cream during exposure to simulated gastric and bile salt solutions
肠道环境对菌株活性具有较为显著的影响[36],Zárate等[42]研究同时指出,体内与体外实验对益生菌肠道耐受性影响具有较为相似的结果。模拟胃酸环境胁迫结果(表3和图3)表明,6 组冰淇淋样品中的植物乳杆菌K25存活率由大到小分别为C-K25-巧>H-K25>H-K25-巧>K25-巧>C-K25>K25,其中C-K25-巧与K25冰淇淋中存活率分别为92.45%和85.19%。模拟胆盐溶液胁迫结果表明,6 组冰淇淋样品中的植物乳杆菌K25存活率由大到小分别为C-K25-巧>H-K25-巧>C-K25>K25-巧>K25>H-K25,其C-K25-巧和H-K25冰淇淋中活菌数存活率分别为93.71%和90.48%。所有组别的菌株经模拟胃肠道环境胁迫后,其活菌数并未有显著改变(P>0.05),表明胁迫预处理与巧克力的添加均对菌株存活具有良好的保护作用。Silva等[43]指出B. animalis subsp. lactis BLC1与B. animalis subsp. lactis BB-12在酸性环境下活菌数分别下降1.24、3 个对数级,在胆盐环境则分别下降3.82、4 个对数级。Beley等[44]则指出胆盐对菌株活性影响主要与损伤细胞膜结构和(或)破坏细胞稳定性相关。L. delbrueckii UFV H2b20发酵冰淇淋,在贮存30 d后,其菌株的模拟肠道环境耐受性结果与本实验相似,研究同时指出菌株对胆盐的耐受程度可能与其生物被膜形成相关[36]。Alamprese等[45]研究表明,市售冰淇淋在货架期内的冻融循环会对菌株被膜造成破坏,使得菌株在胃液环境中更容易遭受胆盐胁迫。Bustos等[46]则进一步指出,在人体胃肠道环境下,食物基质可为菌株提供营养物质,菌株数量也有可能出现上升的现象。值得注意的是王辑等[19]前期实验表明植物乳杆菌K25具有较为良好的耐酸耐胆盐特性。
3 结 论
本研究考察不同温度对植物乳杆菌K25胁迫处理不同时间后对菌株低温耐受性的影响。结果表明,经4 ℃-18 h(C-K25)与55 ℃-0.5 h(H-K25)胁迫预处理后的菌株在-20 ℃贮存30 d后活菌数分别达到1.10×106、1.35×106CFU/mL,为对照组的12 倍和15 倍。选用该2 株菌株用作冰淇淋的制作,并且添加巧克力作为辅料。结果表明,使用胁迫处理后的菌株发酵降低冰淇淋产品酸度,显著增加产品的黏度与硬度(P<0.05),且低温处理后的K25发酵对冰淇淋的膨胀率和融化率产生有益影响。产品于-20 ℃贮存60 d后,C-K25和H-K25活菌数与对照组相比分别提高1.63、1.69 个对数级,而 C-K25-巧组活菌数最高,为7.56(lg(CFU/mL))。冰淇淋于-20 ℃贮存30 d后,对菌株进行模拟胃肠道环境耐受性分析,结果表明所有组别的菌株均具有较为良好的肠道环境耐受性。本研究为如何提高植物乳杆菌的低温耐受性以及冰淇淋产品中植物乳杆菌在贮存期间和人工模拟胃肠道环境下存活特性提供了研究思路和数据支撑,为实际生产中提高冰淇淋中益生菌的存活率提供一种有效的技术方法。

