小麦TaeEF1β基因的克隆、同源性及表达分析
陈 炫,张天烨,羊 健,张恒木,陈剑平,*
(1.浙江农林大学 林业与生物技术学院,浙江 杭州 311300; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州 310021)
真核翻译延伸因子(eukaryotic translation elongation factor,eEFs)最早作为一个对噬菌体Qβ的依赖于RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)活性具有重要作用的辅助因子被发现并鉴定[1]。在真核细胞中包括3类延伸因子,分别为eEF1α(eukaryotic translation elongation factor 1α)、eEF1β和eEF2[2]。EF1β在真核生物中的结构比在细菌中更复杂,该蛋白由EF1β-alpha、EF1β-gamma和EF1β-beta三个亚基组成。在蛋白质的合成过程中,eEF1β主要作为EF家族的一种核苷酸交换因子,催化不活跃的eEF1α·GDP重新变成具有活性的eEF1α·GTP[3]。
近年来,越来越多的证据表明,eEFs作为蛋白分子伴侣和RNA/actin结合蛋白参与病毒的转录、翻译、组装及其致病机理的过程[4-9]。已经报道的有eEF1α在番茄花叶病毒(Tomato mosaic virus,ToMV)[10]和番茄丛矮病毒(Tomato bushy stunt virus,TBSV)[11]中促进病毒复制复合体的形成;在人类免疫缺陷病毒1型(HIV-1)病毒中促进病毒粒子的组装[19];在乙型肝炎病毒(hepatitis B virus,HBV)中作为X蛋白的分子伴侣[12];eEF1β与烟草花叶病毒(Tobacco mosaic virus,TMV)的RdRp互作影响其病毒的复制[13]等。
中国小麦花叶病毒(Chinese wheat mosaic virus,CWMV)是本实验室于20世纪末在我国山东冬小麦上鉴定的一种由禾谷多黏菌(Polymyxagraminis)传播的病毒[14]。CWMV为单链正义RNA病毒(positive-sense single-stranded RNA virus,(+)ssRNA virus),包含两条基因组分别命名为RNA1和RNA2。RNA1含有3个开放阅读框(open reading frame,ORF),其中ORF1编码一个149~153 ku的多肽,其UGA终止密码子能以一定比例通读(read through,RT)而使开放阅读框延伸至ORF2,产生一个RNA依赖性RNA聚合酶(RdRP)。ORF3编码一个36~37 ku的运动蛋白(movement protein,MP)[15]。RNA2含有3个ORF,分别编码19 ku的CP蛋白、84 ku的外壳蛋白基因通读区(CP-RT)蛋白、25 ku的蛋白质(N-CP)和18~19 ku的沉默抑制子蛋白[16]。前期本实验室通过蛋白质组学分析发现,CWMV侵染小麦初期能够诱导TaeEF1β在蛋白质水平的上调表达(数据待发表),据此,推测TaeEF1β可能通过某种途径参与病毒侵染寄主植物的过程。本研究首先用RT-PCR从小麦(TriticumaestivumL.)中克隆TaeEF1β基因,并对其进行生物信息学分析,并采用qRT-PCR分析TaeEF1β在小麦根、茎、叶等不同组织部位和CWMV不同侵染时期的转录表达水平,为进一步研究TaeEF1β对CWMV的影响机制提供依据。
1 材料与方法
1.1 材料
本实验所用小麦烟农22由山东省烟台市农业科学研究院提供,并由本实验室于温室内培养。大肠埃希菌(Escherichiacoil)感受态细胞Trans 5α购于北京全式金生物技术有限公司;基因克隆所使用的反转录试剂盒First Strand cDNA Synthesis Kit购于TOYOBO公司;ExTaq酶购于TaKaRa公司;限制性内切酶购于New England Biolabs(NEB)公司;实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)所用的反转录试剂盒HiScript Q RT SuperMix for qPCR与ChamQ Universal SYBR qPCR Master Mix购于南京诺唯赞生物科技公司;凝胶回收GeneJET Gel Extraction Kit购于Thermo Scientific公司;引物由杭州擎科梓熙生物技术有限公司合成。
1.2 总RNA的提取及cDNA合成
总RNA的提取:取健康小麦叶片0.75 g,使用液氮进行研磨后装入1.5 mL RNase free EP管(以下步骤均使用RNase free EP管);按照1 g·mL-1的量加入750 μL TRIzol,涡旋振荡混匀后于4 ℃,1 4000 r·min-1,离心10 min;小心吸取上清到新的EP管中,按每1 mL TRIzol加入200 μL氯仿,涡旋振荡混匀后于室温静置10 min,4 ℃,1 4000 r·min-1,离心10 min;吸取上清无色水相,按每1 mL TRIzol加入600 μL异戊醇,涡旋振荡混匀后于室温静置10 min,4 ℃,1 4000 r·min-1,离心10 min;弃上清后,用预冷的无水乙醇悬浮沉淀(RNA)后于4 ℃,1 4000 r·min-1,离心10 min(重复该步骤一次);对RNA进行微干燥后,使用30~50 μL DEPC水进行溶解,用RNA琼脂糖凝胶电泳和NanoDrop One对RNA的完整性、浓度和纯度进行检测,于-80 ℃保存。
cDNA合成:取总RNA 1 μg,以随机引物为反转录引物,采用First Strand cDNA Synthesis Kit进行反转录,反应液配置及反应体系参照试剂盒说明书,进行反转录获得小麦cDNA,以0.1×cDNA为PCR扩增模板。
1.3 qRT-PCR
根据NCBI数据库中小麦eEF1β序列(登录号:AK332529.1),设计小麦基因TaeEF1β的PCR引物(表1)。使用诺唯赞公司的SYBR在荧光定量仪PCR-7900(ABI)上进行qRT-PCR反应,
表1本实验所用引物
Table1Primers used in this study
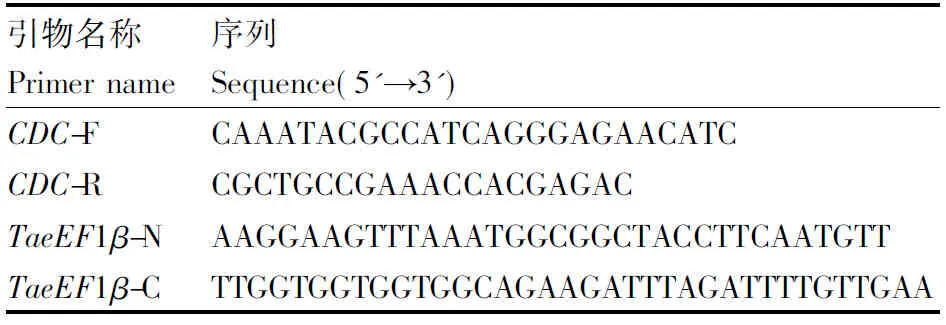
引物名称Primer name序列Sequence(5'→3')CDC-FCAAATACGCCATCAGGGAGAACATCCDC-RCGCTGCCGAAACCACGAGACTaeEF1β-NAAGGAAGTTTAAATGGCGGCTACCT-TCAATGTTTaeEF1β-CTTGGTGGTGGTGGCAGAAGATT-TAGATTTTGTTGAA
反应程序为:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火 30 s,72 ℃延伸 30 s(10 μL体系,40次循环)。以CDC基因为内参基因。
1.4 小麦TaeEF1β基因的克隆
以0.1×cDNA为扩增模板,使用引物TaeEF1β-N/TaeEF1β-C进行PCR扩增,反应程序为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火 30 s,72 ℃延伸1 min(20 μL体系,35次循环),最后,72 ℃彻底延伸10 min。取10×上样缓冲液2 μL与PCR反应液混匀后,进行琼脂糖凝胶电泳检测,检测电压为160~180 V,溴酚蓝迁移至大约2/3处停止电泳,在凝胶成像仪中UVP光下,将与预期大小一致的凝胶条带切下,参照Thermo Scientific公司的GeneJET Gel Extraction Kit说明书进行回收。检测用琼脂糖凝胶浓度为1.2%,电泳缓冲液为0.5×TAE。纯化后的PCR产物连接于T5-zero载体,转化入大肠埃希菌Trans 5α感受态中,取菌液PCR鉴定结果正确的样品送杭州博尚公司进行测序验证。
1.5 序列分析及其结构分析
测序结果通过NCBI进行序列比对后,利用Psipred对该蛋白的二级结构进行(http://bioinf.cs.ucl.ac.uk/psipred/)预测,利用Smart(http://smart.embl-heidelberg.de/smart/show-motifs.pl)分析该蛋白的结构特征,利用Swiss-model 分子建模服务系统(http://www.swiss-model.expasy.org/)预测蛋白质的三维结构。
2 结果与分析
2.1 小麦eEF1β基因的克隆
以构建的小麦cDNA文库为模板,参考NCBI数据库中小麦eEF1β基因序列(基因登录号:AK332529.1),设计针对该基因的ORF区域的PCR引物,进行RT-PCR扩增。PCR扩增获得的产物,经1.2%琼脂糖凝胶电泳分析,结果发现位于780 bp处获得一条与预计大小相符的特异性条带(图1)。经切胶纯化回收后,连接至T5-zero载体,转化入大肠埃希菌Trans 5α感受态细胞中,将阳性菌液送至杭州铂尚公司进行测序验证。
2.2 小麦TaeEF1β同源序列的分析
利用获得的TaeEF1β基因的ORF氨基酸序列,用BLAST在NCBI搜索,显示该蛋白在水稻(Oryzasativa)、大麦(Hordeumvulgare)、玉米(Zeamays)、高粱(Sorghumbicolor)、烟草(Nicotianabenthamiana)等5个物种中也存在高度同源的类似蛋白,其在NCBI中的登录号分别为:XP_015647859.1(OseEF1β)、CAB90214.1(BaeEF1β)、NP_001149263.1(ZmeEF1β)、XP_002463179.1(SbeEF1β)和NP_001312454.1(NbeEF1β)。利用DNAMAN软件将TaeEF1β与5个物种间的氨基酸序列进行同源性分析,比对结果显示,这些不同物种间的eEF1β的氨基酸序列同源性高达84%(图2),其中TaeEF1β与BaeEF1β的氨基酸序列相似性最高,达到99%。用Smart软件分析该蛋白的结构特征(图3-A)与保守结构域(图3-B),并利用Swiss-model分子建模服务系统预测蛋白质的晶体结构(图3-C),结果显示,该蛋白的保守结构域为137~226 aa。
2.3 qRT-PCR分析TaeEF1β的表达差异性
实验利用qRT-PCR对TaeEF1β基因在根、茎、叶组织部位中转录水平的相对表达量进行分析,如图4-A所示。以TaeEF1β在根部的表达量为参照,结果显示,TaeEF1β在茎部的表达量最高,

1,8 000 bp DNA Ladder;2,TaeEF1β.图1 TaeEF1β的基因的RT-PCR扩增Fig.1 TaeEF1β obtained by RT-PCR

图2 TaeEF1β的氨基酸同源序列分析Fig.2 Homology analysis of TaeEF1β
根部和叶部的表达量次之,且两者的表达量相对一致。该结果也表明,虽然TaeEF1β基因在小麦的根、茎、叶组织部位中都存在表达,但是具有一定的组织表达特异性。
eEF1β参与多种RNA病毒的复制过程[1]。为了验证在CWMV侵染前后TaeEF1β转录水平的表达量变化,本实验利用qRT-PCR对TaeEF1β基因在CWMV侵染小麦植株4、6、8和10 d的转录水平表达量进行分析,如图4-B所示。结果表明,CWMV的侵染可以明显诱导TaeEF1β的表达,其中4 d的表达量最高,上调12.3倍,6、8和10 d的表达量也显示出上调趋势,但相对较为一致,分别为6.3倍、6.1倍和6.5倍。该结果也进一步说明,TaeEF1β的表达量受CWMV侵染的诱导,且在病毒的侵染初期最为明显,因此TaeEF1β可能参与CWMV的复制过程。
3 讨论
eEF是一类多功能调控蛋白,广泛参与植物的各种生命过程,有关eEF生物学功能的证据主要来自于酵母[8,17]和哺乳动物[18-19],对于植物eEF

A: :α-螺旋; :β-折叠; :无规则卷曲;B: :(137-226aa)保守结构域A: :helix; :strand; :coli;B: :The conservative structure domain of (137-226aa)图3 TaeEF1β的二级结构(A)、保守结构域的预测(B)及蛋白质结构模型(C)Fig.3 Secondary structure of TaeEF1β (A), conservative structural domain prediction (B) and protein structure model of TaeEF1β (C)
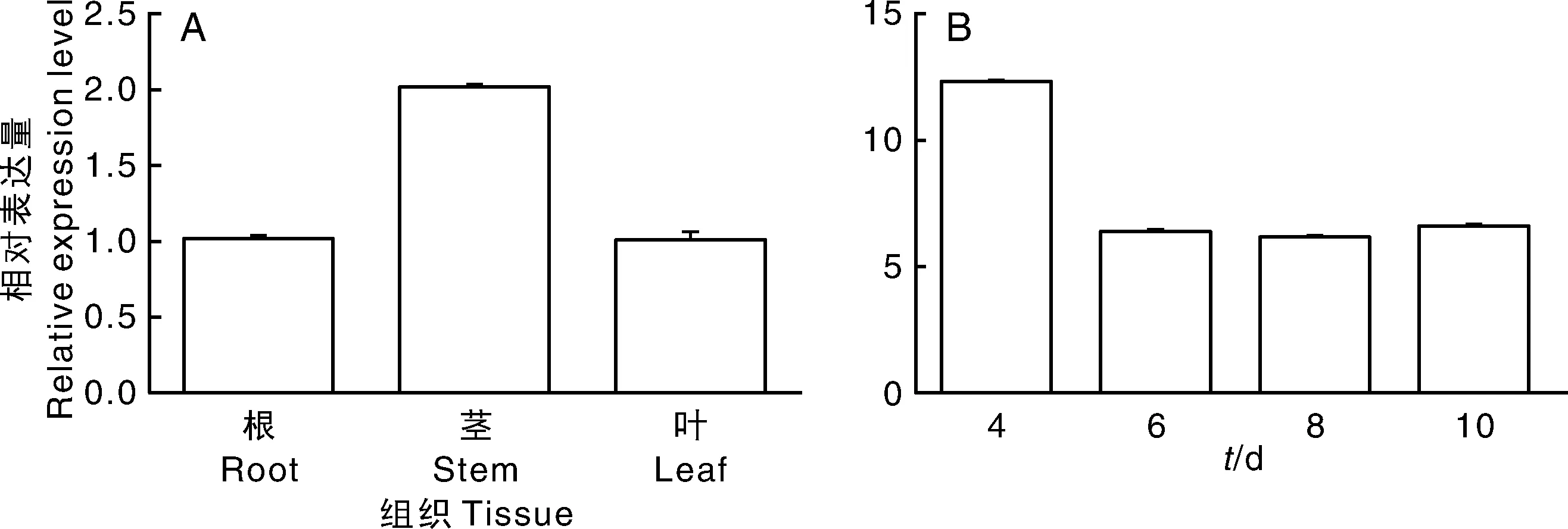
图4 TaeEF1β在小麦不同部位(A)及CWMV不同侵染时期(B)的表达分析Fig.4 Relative expression level of TaeEF1β in different tissues (A) and different stages of CWMV infection (B) of wheat
的生物学功能和作用机制知之甚少。因此,对于植物eEF类蛋白的研究还有待进一步深入。本研究成功地克隆了小麦的TaeEF1β基因,同源分析表明,该蛋白与水稻、大麦、玉米、高粱和烟草植株中的EF1β高度同源,推测TaeEF1β与其他植物中的同源蛋白可能存在相同的功能。蛋白质的保守结构域和三维预测分析表明,TaeEF1β的保守结构域主要位于137~226 aa处,这也为后期该蛋白的功能分析奠定基础。
植物不同营养组织、不同的发育时期需要不同蛋白参与调控。本研究发现,TaeEF1β在小麦的根、茎、叶组织部位中都存在表达,且茎部的表达量最高。因此,推测TaeEF1β可能主要参与植物的茎部生长发育过程。eEF1β作为植物中重要的蛋白,也参与病毒生活史的循环过程。如NbeEF1β与烟草花叶病毒(TMV)的RdRp蛋白互作,从而有利于TMV在烟草植株中的复制过程[13]。另外,eEF1β还能与eEF的另外一个组成蛋白eEF1A蛋白发生直接互作从而影响eEF1A的活性。众所周之,eEF1A广泛的参与病毒的生命过程,如eEF1A参与正链RNA病毒复制,如登革热病毒(dengue virus,DV)[20]、黄萝卜花叶病病毒(Turnipyellowmosaicvirus,TYMV)[21]、烟草花叶病毒(TMV)[22]、西尼罗河病毒(West Nile virus,WNV)[23]和芜菁皱缩病毒(Turnipcrinklevirus,TCV)[16];也有报道表明其参与负链RNA病毒如水疱性口炎病毒(vesicular stomatitis virus,VSV)的复制[24]。本研究中,我们也发现在CWMV侵染的初期TaeEF1β在转录水平的表达量呈现明显上调,这也预示该蛋白可能与CWMV的初期复制相关,但是其是直接参与病毒的复制还是通过影响eEF1A的活性从而参与病毒的复制过程仍有待进一步研究。

