添加氧载体对γ多聚谷氨酸发酵的影响
冯文心,袁志怡,常忠义,高红亮,贾彩凤
(华东师范大学生命科学学院,上海200241)
γ-多聚谷氨酸(Poly-γ-glutamic acid,γ-PGA)是由L-谷氨酸、D-谷氨酸两种构型的单体,通过γ-酰胺键聚合形成的细胞外水溶性的高分子氨基酸聚合物[1]。γ-PGA具有极佳的成膜性、成纤维性、阻氧性、可塑性、粘结性、保湿性和可生物降解等理化和生物学特性,无毒无害,对人体无任何副作用[2-3],在医药、食品、塑料以及其它很多方面具有广阔的应用前景[4-5]。
提高γ-PGA的产量一直是实现工业化生产的关键因素。数十年来,人们通过菌种诱变、培养基条件优化、生产工艺条件优化等手段提高γ-PGA的生产效率[6-9]。然而在 γ-PGA 发酵过程中,微生物大量繁殖,对氧气需求量增大,同时伴随着γ-PGA的大量合成,黏度的急剧增加严重阻碍了氧气的传递,较低的溶氧水平是限制γ-PGA产量提高的一个关键因素。因此,提高发酵过程中的溶氧是优化γ-PGA发酵中重要的一步。氧载体是指不溶于培养基但能够吸附或包裹溶解氧,以减少气液传氧阻力,提高氧气传质速率的物质,氧气在其中的溶解度是在水中的15~20 倍[10-11]。近年来,在发酵体系中添加氧载体越来越受到人们的重视。研究表明,利用氧载体对氧气高溶解度的特性,将它们添加到发酵液中,可以降低氧气的传质阻力,显著提高了黄原胶、那他霉素、恩拉霉素的产率[12-14]。另外,在发酵液中添加过氧化氢用来增加发酵液的溶氧,从而提高了 γ-PGA 的产量[15],但关于 γ-PGA 发酵过程中添加氧载体的研究还鲜有报道。
本文以实验室筛选的枯草芽孢杆菌为材料,从氧载体种类、加入量和加入时间三个方面进行研究,筛选出最优的氧载体加入方式,为实现γ-PGA大规模工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
实验菌株 本实验室分离并保存的枯草芽孢杆菌;氧载体 正己烷、正庚烷为分析纯 国药集团;正十二烷、正十六烷为分析纯 北京沃凯生物科技有限公司;γ-PGA Sigma公司;种子培养基:胰蛋白胨 10 g/L、酵母粉 5 g/L、NaCl 10 g/L、蒸馏水 1 L,pH7.0;发酵培养基:葡萄糖 50 g/L、L-谷氨酸钠50 g/L、酵母粉 10 g/L、NaCl 10 g/L、KH2PO45 g/L、MgSO4·7H2O 0.5 g/L、蒸馏水 1 L,pH7.0。
Sigma 2-16KL冷冻离心机、QUintix型电子天平(精密度0.1 mg) 塞多利斯科学仪器(北京)有限公司;ZQZY-BF型全温恒温培养摇床 上海知楚仪器有限公司;721型分光光度计 上海光学仪器厂;GNP-9160型隔水式恒温培养箱 上海精宏实验设配有限公司;Synergh-HT酶标仪 基因有限公司;Brookfield粘度计 Brookfield公司。
1.2 实验方法
1.2.1 培养方法 参考文献[16],将斜面菌种接入5 mL种子培养基中,37℃、250 r/min摇床培养16 h;然后将培养好的种子液以5%的接种量接入装有50 mL发酵培养基的250 mL锥形瓶中,37℃、250 r/min摇床培养48 h。
1.2.2 添加氧载体的单因素实验
1.2.2.1 氧载体种类对γ-PGA发酵的影响 发酵开始0 h时,在发酵培养基中分别添加0.5%(与培养基的体积比)的正庚烷、正己烷、正十二烷和正十六烷,对照组不添加氧载体(添加的氧载体量很少,带来的培养基体积变化忽略不计),发酵结束后,测定发酵液中的γ-PGA产量、菌体生物量(OD600)、发酵液的粘度,综合这些指标,筛选出可以促进γ-PGA产量的氧载体种类。
1.2.2.2 氧载体添加浓度对γ-PGA发酵的影响 在得到最适氧载体种类的基础上,发酵开始0 h时,分别在培养基中以体积比0.1%、0.3%、0.5%、1.0%、2.0%的添加量加入该氧载体,发酵结束后,综合发酵液中的γ-PGA产量、菌体生物量(OD600)和发酵液的粘度,确定氧载体的最佳添加浓度。
1.2.2.3 氧载体添加时间对γ-PGA发酵的影响 在得到最适氧载体种类和最佳添加量的基础上,分别在发酵开始0、12、24、36 h时将最适氧载体以最佳添加浓度的加入培养基,发酵结束后,综合发酵液中的γ-PGA产量、菌体生物量(OD600)和发酵液的粘度,确定氧载体的最佳添加时间。
1.2.2.4 最优氧载体添加方案下γ-PGA摇瓶发酵曲线 在得到最适氧载体种类与其添加方案后,以该方案进行发酵,发酵液每隔6 h取样,测定γ-PGA产量、菌体生物量(OD600)、发酵液残糖含量。
1.2.3 指标的测定
1.2.3.1 发酵液中γ-PGA产量的测定 首先制作γ-PGA标准曲线,参照 Aboy等[17]方法进行测定,步骤如下:在0.2 g/L的NaOH溶液中,加入CTAB(十六烷基三甲基溴化铵),配制成5 g/L的CTAB溶液。制备30、50、60、70、90 μg/mL 的 γ-PGA 标准液,分别取100μL不同浓度的γ-PGA标准溶液和100μL CTAB溶液加入96孔板中,其中以不含γ-PGA的蒸馏水作为对照,37℃反应5 min,在酶标仪上测定各孔400 nm处吸光度。根据γ-PGA浓度和OD400吸光值,制作标准曲线。
发酵液中γ-PGA产量的测定:取3.0 mL发酵液,加入9.0 mL预冷无水乙醇,后置于4℃冰箱过夜12 h,10000 r/min离心10 min,弃上清,沉淀用30 mL的蒸馏水充分溶解,再次10000 r/min离心10 min,上清即为待测液,其余操作同标准曲线的操作,根据标准曲线得出发酵液中的发酵液中γ-PGA产量。
1.2.3.2 生物量的测定 取3.0 mL发酵液,用6 mol/L H2SO4调 pH 为3.0,10000 r/min离心10 min,弃上清,菌体沉淀用蒸馏洗涤2次,后将菌体重悬于适量的蒸馏水,测定OD600的吸光值。
1.2.3.3 发酵液粘度的测定 发酵结束后,取50 mL发酵液用粘度计测量,转子为S64型。
1.2.3.4 发酵液中残糖的测定 取1 mL发酵液,用蒸馏水稀释10倍,10000 r/min离心去除菌体,用DNS法[18]测定发酵液中残糖的含量。
1.3 数据处理
实验均重复3次,以珚X±SD表示,采用SPSS 17.0分析数据,采用Graphpad Prism 5和Origin Graph作图。
2 结果与分析
2.1 γ-PGA标准曲线的测定
由不同浓度的γ-PGA标准品与反应液的OD400吸光值,制作标准曲线,结果如图1所示。该曲线R2达到了0.99以上,表明γ-PGA浓度与OD400的相关性良好,可用于测定发酵液中的γ-PGA浓度。
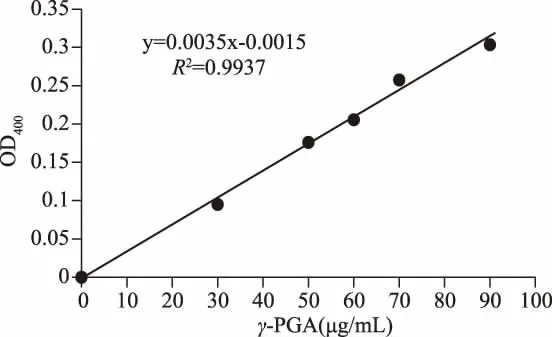
图1 γ-PGA的标准曲线Fig.1 Standard curve ofγ-PGA
2.2 氧载体种类对γ-PGA发酵的影响
由图2A可知,添加正十六烷的实验组的γ-PGA产量显著高于添加正己烷、正庚烷、正十二烷与对照组(p<0.05),达到了 18.43 mg/mL,比对照组13.91 mg/mL相比,增加了32%。在对聚谷赖氨酸合成酶的转录表达与动力学研究中指出,胞内ATP水平是 γ-PGA 合成代谢的关键调控因素[18-20]。正十六烷作为氧载体,具有比水较高的溶氧量且与发酵液不相溶,可以减少气-液两相之间的传氧阻力,提高发酵液的溶氧能力,发酵液中溶氧水平的提高,会促进细胞呼吸作用的增强,导致胞内ATP水平的提高,ATP水平的提高,不仅为细胞生产提供了能量,而且有利于聚谷氨酸合成酶催化合成γ-PGA。

图2 不同氧载体对γ-PGA发酵的影响Fig.2 Effect of different oxygen vector on the fermentation ofγ-PGA注:图中不同小写字母表示差异显著(p<0.05),图3~图4同。
由图2B可知,添加正十六烷的实验组显示了最高的菌体生物量,OD600达到19.5,对照组为15.6,说明添加正十六烷有利于菌体的生长;而添加正己烷、正庚烷、正十二烷的实验组,菌体生物量(OD600)与对照组相比没有显著性差别(p>0.05)。
由图2C可知,与对照组相比,添加正十六烷并未显著增加发酵液的粘度(p>0.05),此外,添加正己烷、正十六烷、正庚烷的实验组都显示了较高的粘度,可见发酵液的粘度与γ-PGA产量并不完全正相关。综上,选取正十六烷为最优氧载体种类,进行后续实验。
2.3 正十六烷添加量对γ-PGA发酵的影响
由图3A和3B可知,当正十六烷的添加量从0.1%增加到0.5%时,菌体生物量(OD600)逐渐上升,菌体生物量(OD600)从16.3增加到23.91;γ-PGA产量也从13.2 mg/mL增加到18.8 mg/mL。但当正十六烷添加量超过0.5%时,反而不利于菌体的生长与γ-PGA的生成,添加量为1.0%和2.0%时,菌体生物量(OD600)分别为17.37和15.46;此时γ-PGA产量也有所降低,分别为15.22和13.21 mg/mL。正十六烷添加量为0.5%的实验组的γ-PGA产量和菌体生物量(OD600)都显著高于其他浓度的实验组(p<0.05)。

图3 不同浓度正十六烷对γ-PGA发酵的影响Fig.3 Effect of different amount of n-hexadecane on the fermentation ofγ-PGA
有研究发现[21],具有正铺展系数的氧载体(如正十六烷)含量的增加会使氧传递系数的数值不断增大,有利于氧的传递,但是,随着正十六烷添加量过高,γ-PGA产量反而逐渐降低,可能是在低装液量、高氧载体浓度时,培养基失水过多,从而影响了γ-PGA的产量。
发酵液粘度主要是由于高聚合度的γ-PGA引起,图3C实验结果表明,粘度的大小与γ-PGA产量并不完全正相关,与上文图2C结论相同,猜测粘度的大小与γ-PGA产量、γ-PGA分子量大小等多重因素有关。粘度仅可以作为γ-PGA产量的一个辅助评价指标。综上,选择0.5%浓度为正十六烷的最优添加量。
2.4 正十六烷的添加时间对γ-PGA发酵的影响
氧载体的添加会增加培养基的溶氧水平,进而影响菌体的生长及代谢水平。因此,氧载体的添加时间对发酵过程有重要影响,实验通过改变正十六烷的添加时间考察其对γ-PGA发酵的影响,结果见图4。
从图4A可知,γ-PGA产量随着氧载体添加时间的延迟而显著降低(p<0.05),在0 h添加氧载体的实验组γ-PGA产量最高,为18.48 mg/mL,而在36 h时添加正十六烷时,γ-PGA含量降到13.4 mg/mL。由图4B可知,在0 h添加氧载体时,菌体生物量(OD600nm)显著高于其他添加时间的实验组(p<0.05),此时发酵液的菌体生物量(OD600nm)最高,达到了20.9。从图4C可知,随着氧载体添加时间的推迟,发酵液的粘度也均逐渐下降。

图4 正十六烷添加时间对γ-PGA发酵的影响Fig.4 Effect of n-hexadecane addition time on the fermentation ofγ-PGA
可能在发酵后期,菌体处于平台期,外源有机溶剂的添加会对该阶段的细胞生长有一定的抑制作用,进而影响到γ-PGA的合成。小白链霉菌发酵生产ε-聚赖氨酸过程中,发酵初始添加氧载体正十二烷可以显著提高ε-聚赖氨酸的产量[22];而在茯苓菌深层发酵过程中,48 h添加氧载体,可以最大程度上提高胞外多糖和茯苓酸产量[23],这可能是由于发酵产物的代谢途径不同所致。综合菌体生物量(OD600)、γ-PGA产量和发酵液粘度的实验结果,选取0 h加入正十六烷为本研究的最佳方案。
2.5 最优氧载体添加方案下γ-PGA摇瓶发酵曲线
由于正十六烷的添加改善了发酵体系的传氧,进而改变整个发酵过程,因此我们考察了在氧载体添加后整个发酵过程中γ-PGA产量、菌体生长及残糖含量的动态变化,结果见图5。
由图5可知,随着发酵的进行,γ-PGA产量、菌体浓度和残糖含量都在动态变化。发酵18 h以前,γ-PGA产量和菌体生物量(OD600)随着发酵的进行都迅速增加,而残糖随之迅速下降,此时微生物生长和发酵产γ-PGA的效率最高。发酵24~48 h期间,残糖含量一直维持在较低水平,说明培养基营养成分基本耗尽,菌体浓度基本维持不变,γ-PGA产量缓慢上升,到发酵48 h时,γ-PGA产量达到最高值为18.62 mg/mL。48 h以后,菌体浓度有所降低,表明此时由于菌体衰老发生了部分自溶,此时的γ-PGA产量也有所下降。研究表明γ-PGA生产菌株在发酵48 h,72 h甚至更长时间 γ-PGA产量达到最高[24-26]。综上,选择 48 h 为最适的发酵周期,此时的γ-PGA产量达到18.62 mg/mL,相比不加氧载体的对照组(13.91 mg/mL)提高了30%以上。
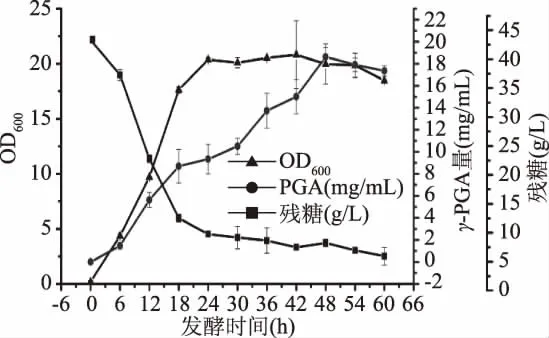
图5 摇瓶中添加氧载体的γ-PGA发酵过程曲线Fig.5 The curve ofγ-PGA fermentation with oxygen vector in shake flask
3 结论
本研究探讨了不同氧载体(包括正己烷、正庚烷、正十二烷、正十六烷)对于枯草芽孢杆菌发酵产γ-PGA的发酵体系中 γ-PGA产量、菌体生物量(OD600)、发酵液粘度的影响,筛选出了最适氧载体(正十六烷),并对其添加浓度、添加时间进行了优化。通过对氧载体种类、添加量、加入时间的单因素实验,结果表明正十六烷为最适氧载体,其最佳加入条件是发酵0 h时添加0.5%正十六烷。此条件下的发酵曲线表明,48 h时γ-PGA产量达到最高值为18.62 mg/mL,相比对照提高了30%以上,此时发酵液具有较高的粘度。本研究建立了枯草芽孢杆菌发酵产γ-PGA中氧载体的添加策略,使得γ-PGA产量显著提高(p<0.05)。加入少量正十六烷在有效提高γ-PGA产量的同时保证了其品质,对工业生产有一定应用价值。

