lgA肾病牛津病理分型特点及对疾病预后影响分析
原发性IgA 肾病(IgA nephropathy)是常见的原发性肾小球疾病中的一种,约占40%~47.2%[1]。它是以IgA 为主的免疫球蛋白沉积于肾小球系膜区和毛细血管壁的原发性肾小球疾病[2],病理类型及临床表现多样,预后相差悬殊[3],约有10%~20%的IgA 肾病患者最终会发展为慢性肾衰竭[4],是我国终末期肾病最主要的病因之一[5]。终末期肾病严重影响患者生活质量,给社会和家庭带来沉重的经济负担。lgA 肾病牛津分型是近年提出的lgA 肾病病理分型标准,对于判断肾病预后具有重要作用,但目前在临床和疾病预后预测中的效果还有待进一步验证。本次研究通过对lgA 肾病患者不同病理分型的临床特征进行比较,并探讨牛津病理分型与疾病预后的相关性,为牛津分型在lgA 肾病患者中的应用提供科学理论依据。
1 材料与方法
1.1 研究对象
收集2012年1—12月在我院住院治疗的原发性lgA 肾病患者。纳入标准:(1)肾脏活检确诊为IgA 肾病;(2)知情同意。排除标准:(1)先天性和继发性肾病所致的IgA 肾病患者;(2)服用调脂药及降尿酸药物;(3)信息资料不全者。最后纳入研究对象200名。
1.2 收集指标
收集患者基本信息,开始纳入研究和随访终点时临床信息、病理指标。基本信息包括年龄、BMI、平均动脉压;临床指标包括尿素氮、血肌酐、血尿酸、尿蛋白,采用简化MDRD 公式估算肾小球滤过率(GFR);病理指标包括牛津病理分型,定义如下:(1)系膜细胞增生(M):每个系膜区细胞<4 个,评0分;每个系膜区细胞4~5 个,评1分;每个系膜区细胞6~7 个,评2分;每个系膜区细胞>8 个,评3分;系膜增生评分是所有肾小球评分的平均值,M0 <0.5,M1 >0.5。(2)节段肾小球硬化(S):任何数量的肾小球毛细血管袢硬化,不包括球性硬化和黏连;S0无,S1 有。(3)内皮细胞增生(E):内皮细胞增生定义为肾小球细胞增多包括毛细血管上皮细胞和系膜细胞增多;E0 无,E1 有。(4)小管萎缩或间质纤维化(T):皮质区小管萎缩或间质纤维化,以显著的为准;T0 <25%,T1 为26%~50%,T2 >50%。
1.3 随访信息
预后随访从患者出院至2017年12月31日,以不可逆的小球滤过率(eGFR)下降大于50%或进入终末期肾脏病(ESRD)为终点事件,判断为不良疾病预后。200 例lgA 肾病患者随访时间3~60 个月,中位随访时间为24 个月。
1.4 统计学分析
采用SPSS 17.0 进行数据统计分析。连续性资料符合正态分布,采用(均数±标准差)描述,组间比较采用t检验;不符合正态分布采用中位数(四分位数)描述,组间比较采用秩和检验。多因素分析采用二元Logistic 回归分析法。以双侧P<0.05 为差异具有统计学意义。
2 结果
2.1 研究对象概况
200 例lgA 肾病患者年龄为(34.12±10.24)岁,BMI 为(23.56±3.88)kg/m2,平均动脉压为(95.87±10.98)mmAg。患者在纳入研究和随访结束时,在血尿酸(χ2=8.946,P=0.011)和尿蛋白(χ2=6.241,P=0.002)上差异具有统计学意义(P<0.05)。随访结束时,lgA 肾病患者血尿酸较开始纳入研究时高,lgA 肾病患者尿蛋白较开始纳入研究时低。详见表1。

表1 200 例lgA 肾病患者临床指标特点
2.2 lgA 肾病患者牛津病理分型
按牛津病理分型对200 例lgA 肾病患者进行分组,结果发现,M0 和M1 两组患者在血尿酸、尿蛋白和eGFR 上差异具有统计学意义(P<0.05)。S0 和S1 两组患者在血肌酐上差异具有统计学意义(P<0.05)。T0、T1 和T2 在尿素氮、血肌酐、血尿酸、尿蛋白和eGFR 上差异具有统计学意义(P<0.05)。E0 和E1 两组在五种临床指标中差异无统计学意义(P>0.05)。详见表2。
2.3 牛津病理分型对lgA 肾病患者预后影响分析
以Y=0 为lgA 肾病患者未发生不良疾病预后,Y=1 为lgA 肾病患者发生不良疾病预后,分析不同牛津病理分型对lgA 肾病患者预后的影响。结果发现,校正年龄、BMI、平均动脉压、尿素氮、血肌酐、血尿酸、尿蛋白、eGFR,系膜增生和小管萎缩/间质纤维化是影响lgA 肾病患者预后的独立影响因素(P<0.05),M1患者发生不良疾病预后是M0 患者风险度的1.712 倍(χ2=7.556,P<0.001),T1 患者发生不良疾病预后是T0 患者风险度的1.341倍(χ2=4.507,P=0.034),T2 患者发生不良疾病预后是T0 患者风险度的2.012 倍(χ2=11.893,P<0.001)。详见表3。
3 讨论
IgA 肾病的发生约占原发性肾小球疾病的25%~50%[6],是我国慢性肾衰竭的主要病因之一。国内研究报道,IgA 肾病患者15年存活率仅为50.9%[7],提示患者患病15年后超过半数患者将进入终末期肾病,导致不良预后甚至死亡。因此,研究发现影响IgA肾病预后的危险因素,早期发现并采取有效措施干预,对改善IgA肾病的疾病结局十分重要。
已有多项研究认为病理指标对于肾脏疾病预后判断具有重要作用[8],但病理指标作为肾脏疾病预后判断中独立影响因素的应用仍存在争议。目前牛津分型是lgA 肾病病理分型中的一种新方法[9],但是否能够作为lgA 肾病预后的独立影响因素和判断指标,仍需要大样本临床试验验证。
本研究对200 例lgA 肾病患者牛津病理分型进行分组,探究牛津病理分型对于lgA 肾病患者疾病预后的独立影响。结果发现,M0 和M1 两组患者在血尿酸、尿蛋白和eGFR 上差异具有统计学意义(P<0.05)。S0 和S1 两组患者在血肌酐上差异具有统计学意义(P<0.05)。T0、T1 和T2 在尿素氮、血肌酐、血尿酸、尿蛋白和eGFR 上差异具有统计学意义(P<0.05)。提示不同牛津病理分型的lgA 肾病患者临床特征不同,病理分型越高,临床指标异常程度越高,lgA 肾病患者肾脏功能损害越严重。与胡诗德等[10]研究结果一致。
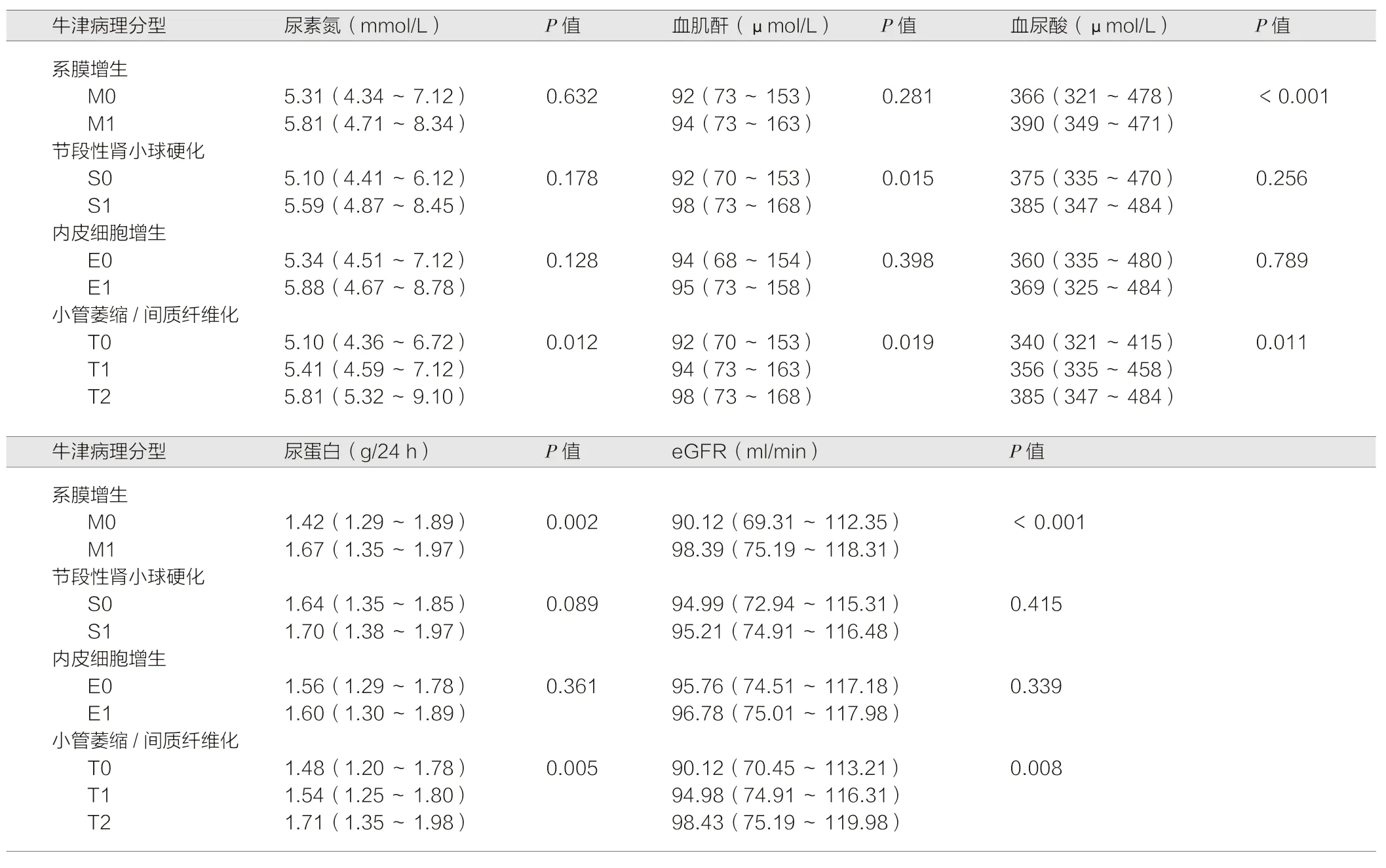
表2 开始纳入研究时临床指标与牛津病理分型的相关性

表3 lgA 肾病患者预后影响因素分析
预后分析中,校正混杂因素后,膜增生和小管萎缩/间质纤维化是影响lgA 肾病患者预后的独立影响因素。与马也娉等[11]和张扬等[12]研究结果一致,lgA 肾病患者牛津病理分型指标,系膜细胞增生M、内皮细胞增生E、节段性肾小球硬化/粘连S、肾小管萎缩/间质纤维化T 与lgA 肾病患者的临床指标具有密切相关,其中系膜细胞增生M、节段性肾小球硬化/粘连S、肾小管萎缩/间质纤维化T 是影响lgA 肾病患者预后的独立影响因素。提示研究lgA 肾病患者的牛津病理分型,对于临床上针对性诊疗以及对疾病预后的预测与判断提供依据。
lgA 肾病患者临床病理表现具有一定特征,其牛津病理分型与疾病预后密切相关。对lgA 肾病患者进行牛津病理分型,可预测不良疾病预后发生风险。

