Bcl-2抑制剂ABT-263对鼻咽癌细胞5-8F增殖和凋亡的影响
王雨洁,范小琴,宋 健,吴汉伟,王宇洋,陆 璐,聂国辉
(1.中山大学附属第一医院耳鼻喉科,广州 510080; 2.深圳市第二人民医院耳鼻喉科,转化医学研究院,广东 深圳 518035)
鼻咽癌作为中国南方高发癌症,其治疗方式主要以放疗为主,辅以化疗,鲜有靶向治疗在鼻咽癌中的应用,而对于鼻咽癌晚期、复发及转移的患者,常规治疗收效甚小,靶向治疗在鼻咽癌中的应用研究极具价值。B细胞淋巴瘤/白血病2(B-cell lymphoma/leukemia-2,Bcl-2)家族蛋白在细胞凋亡过程中起关键作用,根据其功能该家族蛋白分为两类:一类是抗凋亡蛋白,包括Bcl-2、Bcl-xL、髓细胞白血病1(myeloid cell leukemia-1,Mcl-1)等;另一类是促凋亡蛋白,包括Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、Bcl-2同源拮抗剂/杀伤剂(Bcl-2 homologous antagonist/killer,Bak)、Bcl-2样蛋白11(Bcl-2-like protein 11,Bim)、佛波醇-12-肉豆蔻酸-13-乙酸酯诱导的蛋白质1(phorbol-12-myristate-13-acetate-induced protein 1,PMAIP1/Noxa)等[1]。之前的研究表明,多种肿瘤中均发现抗凋亡蛋白(包括Bcl-2、Bcl-xL及Mcl-1)的高表达,在肿瘤细胞的无限增殖中起重要作用[2]。目前,以肿瘤中异常高表达的抑凋亡蛋白为靶点的药物研究成为抗癌药物的研究热点,多种Bcl-2家族抑制剂处于临床及临床前研究中[3]。Bcl-2家族抗凋亡蛋白在鼻咽癌细胞系及肿瘤组织中均呈现高表达,且该蛋白的高表达可能是导致鼻咽癌细胞对于化疗药物抗性的原因之一[4]。
ABT-263是由雅培制药公司研发的一种口服型Bcl-2小分子抑制剂,其在实体瘤治疗上已有多项临床试验,并且对Bcl-2、Bcl-xL及Bcl-2样蛋白2等抑凋亡蛋白的抑制作用可以缓解B淋巴细胞瘤选择性抑制产生的抗性问题[5]。本研究拟探讨ABT-263对鼻咽癌增殖及凋亡的影响,以助于阐明ABT-263诱导鼻咽癌细胞凋亡的具体作用机制,为B淋巴细胞瘤家族蛋白靶向抑制剂在鼻咽癌治疗中的应用提供理论支持。
1 材料与方法
1.1材料 人鼻咽癌细胞系5-8F来自深圳市第二人民医院李泽松课题组;RPMI(洛斯维·帕克纪念研究所)-1640细胞培养液、磷酸盐缓冲液购自美国Hyclone公司;胎牛血清、胰蛋白酶购自美国Gibco公司;细胞计数试剂盒8(cell counting Kit-8,CCK-8)购自日本同仁化学研究所;Annexin V-异硫氰酸荧光素/碘化丙啶(Annexin V-fluoresceine isothiocyanate/propidium iodide,Annexin V-FITC/PI)双染试剂盒购自美国BD公司;兔抗人Bcl-2、胱天蛋白酶3(caspase-3)抗体购自美国Proteintech公司;兔抗人Mcl-1、Bcl-xL、Bak、Bax、Bim、Actin抗体购自美国CST公司;鼠抗人Noxa抗体购自美国Abcam公司;辣根过氧化物酶标记的鼠源、兔源二抗购自美国Abcam公司。
1.2细胞培养 人鼻咽癌细胞5-8F使用含有10% 胎牛血清及100 U/mL青霉素和100 mg/L链霉素的RPMI-1640培养基,在37 ℃、5% CO2的细胞培养箱中培养。
1.3CCK-8法检测鼻咽癌细胞的增殖活力 在96孔板每孔中种植1×104个5-8F细胞,培养过夜后换不含血清的培养基饥饿4 h,随后根据加入ABT-263药物浓度的不同分为0、0.031 25、0.062 5、0.125、0.25、0.5、1、2、4、8 μmol/L组,每组设有6个平行实验。孵育培养24 h后,每孔加入含有10 μLCCK-8后孵育2 h,在不含细胞的100 μL培养基中加入10 μL CCK-8作为空白对照,随后使用酶标仪检测450 nm的吸光值。细胞存活率%=(实验组吸光值-空白对照吸光值)/(对照组吸光值-空白对照吸光值)×100%。
1.4Annexin V-FITC/PI法检测鼻咽癌细胞的凋亡 将5-8F细胞以1×106每孔的密度种植于6孔板中,培养过夜后换为不含血清的培养基饥饿4 h,根据加入ABT-263药物浓度的不同分为0、0.5、1 μmol/L组,细胞使用0、0.5 μmol/L及1 μmol/L ABT-263处理24 h,随后消化收集细胞,计数,调整细胞浓度,均使用Annexin V-FITC/PI染液染色15 min后,在1 h内使用流式细胞仪检测。凋亡率为Q1-UR和Q1-LR两个象限细胞数的合计。
1.5免疫印迹法检测目的蛋白的表达 将5-8F细胞以3×106的密度铺于10 mm培养皿中,同样培养过夜后换不含血清的培养基饥饿4 h,随后根据加入ABT-263药物浓度的不同将细胞分为0、0.5、1 μmol/L组。分别使用0、0.5、1 μmol/L ABT-263处理24 h后,收集细胞,每皿细胞加入200 μL含有蛋白酶抑制剂的细胞裂解液,冰上放置40 min,随后4 ℃,18 800×g,离心15 min,将上清转移至新的EP管。测定细胞裂解液中的蛋白浓度后调整至浓度一致,随后使用聚丙烯酰胺凝胶电泳进行蛋白分离,每孔加入20 μg蛋白,电泳完毕后,将蛋白转印至聚偏氟乙烯膜。转印后的聚偏氟乙烯膜使用5%的脱脂牛奶封闭1 h,随后与一抗(1∶1 000)在4 ℃孵育过夜,使用洗涤缓冲液洗膜3次,每次15 min,然后与二抗(1∶5 000)孵育2 h,再使用洗涤缓冲液洗膜3次,每次15 min,最后利用化学发光液在显影仪上进行曝光。曝光结果通过Amersham Imager仪器(美国)采集,使用Image J软件计算蛋白条带灰度,最后以Actin蛋白作为内标计算蛋白浓度变化。
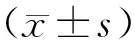
2 结 果
2.1ABT-263抑制鼻咽癌细胞5-8F的增殖 各组ABT-263处理后细胞吸光值比较差异有统计学意义(P<0.01),0.125、0.25、0.5、1、2、4、8 μmol/L组吸光值低于0 μmol/L组(P<0.05),见表1。

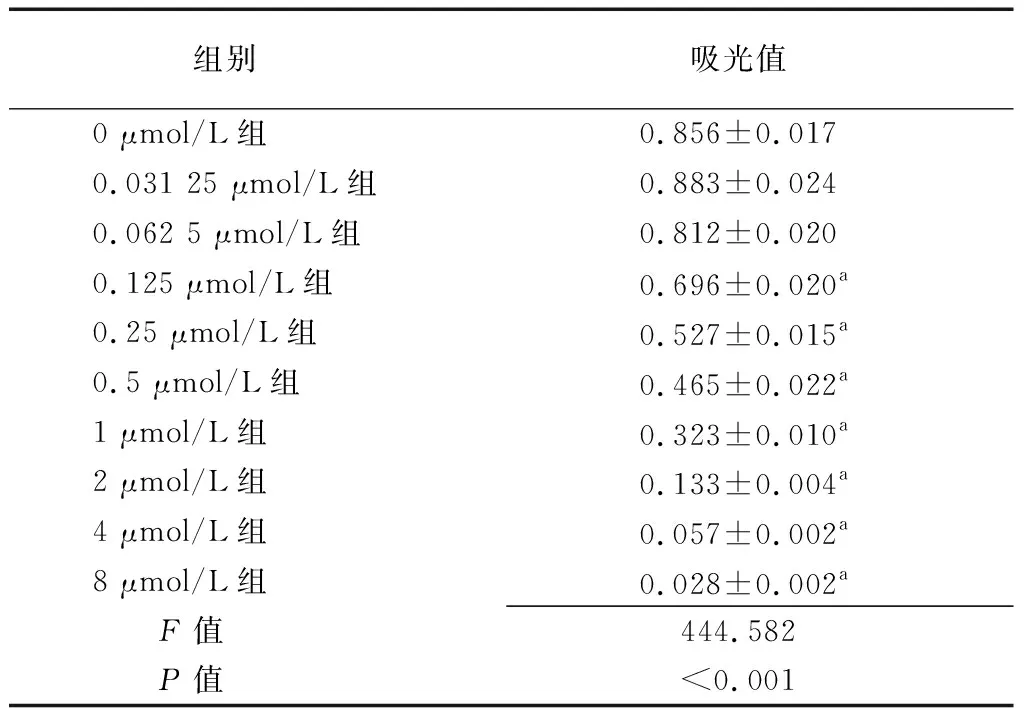
组别 吸光值0 μmol/L组0.856±0.0170.031 25 μmol/L组0.883±0.0240.062 5 μmol/L组0.812±0.0200.125 μmol/L组0.696±0.020a0.25 μmol/L组0.527±0.015a0.5 μmol/L组0.465±0.022a1 μmol/L组0.323±0.010a2 μmol/L组0.133±0.004a4 μmol/L组0.057±0.002a8 μmol/L组0.028±0.002aF值 444.582P值 <0.001
a与0 μmol/L组比较,P<0.05
2.2ABT-263诱导鼻咽癌细胞5-8F的凋亡 Annexin V-FITC/PI双染细胞凋亡实验结果显示,加入0.5 μmol/L ABT-263后引起约6% 5-8F细胞凋亡,1 μmol/L ABT-263能诱导约10%的细胞凋亡,见图1A。同时免疫印迹实验结果显示,在0.5 μmol/L ABT-263的作用下,较0 μmol/L组caspase-3剪切体蛋白含量升高约28%,1 μmol/L ABT-263引起约30% caspase-3剪切体蛋白的增加,见图1B。
2.3ABT-263影响Bcl-2家族蛋白的表达 将ABT-263处理5-8F细胞后,使用免疫印迹法检测Bcl-2家族蛋白的结果显示,与0 μmol/L 组相比,0.5 μmol/L与1 μmol/L ABT-263处理后鼻咽癌细胞中抑凋亡蛋白的表达变化:两种浓度下Bcl-xL蛋白表达升高20%~30%,Mcl-1蛋白的表达量约升高为原来的2倍,Bcl-2的表达量为其80%左右;促凋亡蛋白的表达变化:Bak的表达量在两种浓度下略有增加,Bim相关蛋白表达量变化不大,在两种浓度处理下Noxa表达量分别升高为0 μmol/L 组的3.3倍及7倍。见图2、表2。

A:流式细胞术分析ABT-263处理后引起5-8F的细胞凋亡;B:ABT-263处理后引起caspase-3蛋白的切割激活
图1ABT-263诱导5-8F细胞的凋亡

图2 免疫印迹法检测ABT-263处理后5-8F细胞中Bcl-2家族蛋白的表达量变化表2 不同浓度ABT-263处理后引起Bcl-2家族蛋白表达的相对变化
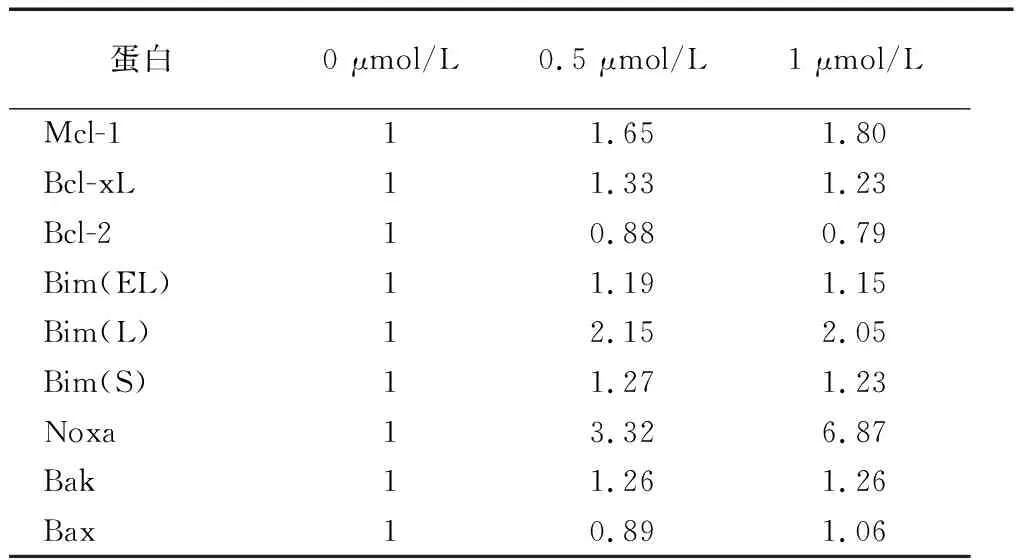
蛋白0 μmol/L0.5 μmol/L1 μmol/LMcl-111.651.80Bcl-xL11.331.23Bcl-210.880.79Bim(EL)11.191.15Bim(L)12.152.05Bim(S)11.271.23Noxa13.326.87Bak11.261.26Bax10.891.06
3 讨 论
鼻咽癌是中国南方地区高发癌症,常见于男性,发病率可达(10~30)/100 000,在各类头颈癌中具有较高的转移率,严重威胁人们身体健康[6]。多数鼻咽癌患者早期无明显症状或症状不典型,所以早期诊断率低,在其发展过程中通常伴随着肿瘤的远端转移,包括骨转移、肺转移、肝转移及远端淋巴结转移,增加了鼻咽癌的治疗难度,患者5年生存率仍停留在60%~70%[7-8]。目前,鼻咽癌的治疗方案以放疗为主,辅以化疗。但对于复发及发生转移的鼻咽癌患者,放疗方案治疗的存活率显著下降且不良反应发生率较高,而靶向治疗由于不良反应较小,在癌症治疗中逐渐发挥越来越重要的作用。但目前靶向治疗在鼻咽癌治疗方面的研究尚不成熟,寻找可以作为鼻咽癌治疗靶点的蛋白及靶向药物将有助于提高鼻咽癌患者的生存期及生活质量[9]。
凋亡是一种人体清除由外界刺激造成的基因异变细胞的程序性死亡途径。越来越多的研究表明,凋亡途径的异常是很多癌症发病的重要原因之一,包含促凋亡及抑制凋亡蛋白的Bcl-2蛋白家族是凋亡的关键开关[10-12]。Bcl-2家族中抑凋亡作用蛋白(Bcl-2、Bcl-xL、Mcl-1等)在很多肿瘤组织的表达量增高,且抑制这些蛋白可以促进肿瘤细胞凋亡,从而抑制肿瘤生长[13]。基于这一现象,多种Bcl-2家族蛋白抑制剂进入临床研究。这些抑制剂包括翻译核苷酸类oblimersen(G3139)[14]、天然产物类(Gossypol)[15]及基于蛋白结构合成的小分子化合物,其中艾伯维公司研究的一系列小分子抑制剂(ABT-263、ABT-737、ABT-199等)效果较为良好。其中,Bcl-2蛋白的选择性抑制剂ABT-199第一个通过美国食品药品管理局批准用于临床治疗17p缺失的慢性淋巴细胞白血病/小淋巴细胞白血病,并取得了较好的疗效。然而,该抑制剂在实体瘤治疗中效果欠佳,研究该类抑制剂在实体瘤中的治疗作用,将有助于基础研究及肿瘤治疗的临床应用[16]。
80%的鼻咽癌细胞中Bcl-2蛋白表达量高于正常鼻咽上皮细胞。中国华南地区鼻咽癌患者中,95%以上伴随有EB病毒感染,机制研究表明EB病毒蛋白潜伏膜蛋白1及B-Raf原癌基因,丝氨酸/苏氨酸激酶1是导致鼻咽癌细胞中Bcl-2蛋白高表达及癌变的可能原因[17]。Zhen等[18]研究表明程序性死亡因子4的低表达与鼻咽癌中Bcl-2蛋白的高表达具有相关性。研究表明该蛋白的高表达可能是导致鼻咽癌细胞对化疗药物抗性的原因之一[4]。Bcl-2蛋白的选择性抑制剂对鼻咽癌细胞的单独杀灭效果并不明显[2],所以研究工作多集中在该类抑制剂联合顺铂等化疗药物的应用上。单独使用Bcl-2家族蛋白靶向药物抑制鼻咽癌生长的研究较少[19]。针对这一空白,本课题组在之前的研究发现Bcl-2抑制剂ABT-199单独使用也可以有效促进鼻咽癌细胞的凋亡,且与Mcl-1抑制剂联合具有协同效应,为Bcl-2蛋白家族蛋白靶向抑制剂在鼻咽癌治疗中的应用提供了基础[20]。然而以往的研究中单独应用Bcl-2抑制剂对于鼻咽癌细胞杀灭效果不佳,究其原因可能是给药后Bcl-2家族其他互补蛋白(Bcl-xL、Mcl-1)的高表达中和了抑制效果。在之前的研究中[20],使用选择性Bcl-2蛋白抑制剂ABT-199时同样伴有Bcl-xL及Mcl-1高表达。ABT-199可以通过正调控Noxa高表达来促进肿瘤细胞凋亡,而化疗药物顺铂同样是通过正调控Noxa来杀灭肿瘤细胞的[21]。这一结果表明该类分子具有实现鼻咽癌治疗的潜力且可以不必与细胞毒性较高的化疗药物联用。并且Bcl-2与Mcl-1抑制剂联用可以达到更好的鼻咽癌抑制效果[22]。
本研究以ABT-263作为研究对象,相对于ABT-199,ABT-263不仅对Bcl-2有良好的抑制作用,对该家族抑凋亡蛋白Bcl-2样蛋白2(Bcl-w)及Bcl-xL的抑制活性也在微摩尔以下,对其他促凋亡蛋白,如Bcl-2相关蛋白A1(>1 μmol/L)及Mcl-1(>0.55 μmol/L)也有抑制作用。在其他肿瘤的研究中ABT-263通过抑制Bim与抗凋亡蛋白之间的结合,促进Bax移位、细胞色素C的释放及caspase-3激活[23]。然而本研究结果显示,在鼻咽癌细胞系中虽然Bim在ABT-263处理后表达量略有增加,但ABT-263处理后的鼻咽癌细胞中促凋亡蛋白Noxa的表达显著增高,在0.5 μmol/L及1 μmol/L给药浓度下Noxa的表达量升高了约3.3及7倍。Noxa可以与抑凋亡蛋白Mcl-1结合释放游离的Bim。而给药后Mcl-1的表达量虽增加为0 μmol/L组的 2倍左右,但其表达可以被Noxa的过表达中和。同时研究中caspase-3剪切体表达量在ABT-263给药后增高,证实了该分子可促进鼻咽癌细胞的凋亡。
综上所述,ABT-263对于正常细胞的低毒性及对于Bcl-2家族蛋白的靶向性,使其在鼻咽癌治疗中具有较高的潜力。由于Bcl-xL是人体血小板生存的必需蛋白[24],所以进一步临床应用中ABT-263的用药需尽量避免对血小板的损伤,发展新的给药途径或联合用药降低剂量进一步减少其对血小板的伤害将会进一步提高该分子在鼻咽癌治疗中的应用潜力。

