奶牛隐性乳房炎三种致病菌的多重PCR检测方法的建立
王 宇,李 碧,阳明贤,左之才
(四川农业大学 动物医学院,环境公害与动物疾病四川省高校重点实验室,动物疫病与人类健康四川省重点实验室,四川 雅安 625014)
奶牛隐性乳房炎是一种奶牛乳房与乳汁均没有临床肉眼可见症状和病理变化的非临床型乳房炎[1],它发病范围广(全世界奶牛场均有发生),感染率高,极易发展为临床型乳房炎而导致奶牛的淘汰[2]。最为常见的隐性乳房炎病原是金黄色葡萄球菌、无乳链球菌,极具危害性的病原是绿脓杆菌[1,3]。目前,对于隐性乳房炎的主流检测方法是细胞学检测,根据乳汁中体细胞数含量的多少来判断是否患有隐性乳房炎[4]。这种方法是不完善的,缺点是结果判定的主观性较强,容易出现主观误差[5]。目前,国内外对临床样本中病原菌的检验大多沿用细菌培养及鉴定方法,检验步骤繁琐,周期较长,需要将病原菌从样本中分离纯化出来,才能作进一步的鉴定,难以满足临床需求。
聚合酶链式反应(polymerase chain reaction,PCR)技术能弥补微生物学培养和生化方法进行细菌分离鉴定的局限性,是一种新的分子水平细菌分类和鉴定方法,在医学和兽医学临床诊断中有很广阔的前景。多重PCR(multiplex PCR)技术因具有高效快捷、特异敏感、实验成本低等优点而得到广泛应用。1988年,Chamberlain等[6]首先使用多重PCR技术对人的杜氏营养不良症(DMD)进行检测,随后,多重PCR技术在动物疫病检测方面得到了广泛的应用和发展。QIAGEN公司研制出适于多重PCR反应的新型缓冲系统,并已研制出多重PCR试剂盒,可以直接用于相关基因的检测分析。国内运用该技术检测病原菌已日渐成熟,在临床诊断方法已经取得一些较有意义的结果。覃芳芸等[7]分别根据链球菌属特异性gdh、猪链球菌种特异性16S rRNA和猪链球菌2型特异性cps2J等基因设计3对特异性引物,在猪链球菌病的临床诊断上取得了一定的成果。与传统的细菌学培养法相比,马保臣等[8]建立的检测乳房炎病原菌的多重PCR方法对金黄色葡萄球菌和酵母真菌具有更高的检出率。
目前,乳汁病原微生物检查、普通PCR、实时荧光定量PCR、环介导等温扩增(LAMP)、基因芯片、凝集法等均应用于细菌检测领域[9]。但奶牛隐性乳房炎经常出现多种病原混合感染的情况,以上的方法检测通量均不高。为此,本研究拟建立无乳链球菌、金黄色葡萄球菌、绿脓杆菌多重PCR检测体系,以期为奶牛隐性乳房炎快速诊断提供技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株
金黄色葡萄球菌、无乳链球菌、绿脓杆菌(分离于隐性乳房炎奶牛)、芽孢杆菌、大肠埃希菌、粪球菌、柠檬酸杆菌、不动杆菌、腐生葡萄球菌(分离于隐性乳房炎奶牛)由四川农业大学动物医学院提供。
1.1.2 主要试剂与仪器
主要试剂有:TSA肉汤培养基、TSA琼脂培养基、KF培养基、卵黄甘露醇高盐培养基、伊红美蓝培养基、脑心浸液肉汤、Taq酶等。主要仪器有:NanoDrop2000超微量分光光度计、高压灭菌锅、PCR仪器、电泳仪、超净工作台、光学显微镜等。
1.2 方法
1.2.1 引物的设计与合成
根据GenBank上发表的无乳链球菌16S rRNA基因(GenBank登录号为X59032.1)、金黄色葡萄球菌NUC基因(GenBank登录号为DQ507382.1)、绿脓杆菌ETA基因(GenBank登录号为KC847702.1)并参考文献各设计一对特异性引物,由生工生物工程(上海)股份有限公司合成(表1)。
1.2.2 细菌基因组DNA的提取
按照Ezup柱式细菌基因组DNA抽提试剂盒说明书操作(上海生工公司),提取细菌DNA模板,置-20 ℃保存。
1.2.3 单一PCR检测的条件优化
单一PCR的反应体系是50 μL,其中初始值是Taq酶的混合物(Mix)25 μL、上游引物和下游引物各1 μL(10 mmol·L-1)、细菌DNA 2 μL、双蒸水21 μL。跟据实际情况,调整引物浓度(10~100 mmol·L-1)、细菌DNA浓度、酶(Mix)的浓度等变量。PCR反应条件为:95 ℃ 5 min; 95 ℃ 1 min,退火温度50 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min。
1.2.4 多重PCR反应条件优化与体系的建立
双重PCR模板:以金黄色葡萄球菌与绿脓杆菌的基因组DNA为模板,各加入1 μL DNA(金黄色葡萄球菌DNA浓度为59.7 ng·μL-1、绿脓杆菌DNA浓度为50 ng·μL-1);以无乳链球菌与金黄色葡萄球菌的基因组DNA为模板,按2∶1加入无乳链球菌DNA 2 μL,金黄色葡萄球菌DNA 1 μL(金黄色葡萄球菌DNA浓度为59.7 ng·μL-1、无乳链球菌DNA浓度为66.8 ng·μL-1);以无乳链球菌与绿脓杆菌的基因组DNA为模板,加入无乳链球菌DNA 2 μL,绿脓杆菌DNA 1 μL(无乳链球菌DNA浓度为66.8 ng·μL-1、绿脓杆菌DNA浓度为50 ng·μL-1)。多重PCR模板:绿脓杆菌与金黄色葡萄球菌基因组DNA模板各1 μL(金黄色葡萄球菌DNA浓度为59.7 ng·μL-1、绿脓杆菌DNA浓度为50 ng·μL-1)、无乳链球菌基因组DNA模板2 μL(DNA浓度为66.8 ng·μL-1)。
根据单重PCR优化结果,以无乳链球菌、金黄色葡萄球菌、绿脓杆菌3种菌的基因组DNA为常量,退火温度(42~62 ℃)、引物浓度、Mix浓度为变量,95 ℃ 5 min;95 ℃ 1 min,退火温度42~62 ℃(梯度PCR) 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min;以确定最佳反应条件。
1.2.5 三重PCR的重复性试验
多重PCR优化完成后,根据优化完成的条件体系进行5次重复性试验。
1.2.6 PCR检测的特异性试验
在完成PCR检测的优化之后,对其进行特异性检验。在相同的条件和引物(加入特异性引物与16S rRNA通用引物)下分别对金黄色葡萄球菌、无乳链球菌、绿脓杆菌与阴性对照组(大肠埃希菌、粪球菌、假单孢菌、表皮葡萄球菌、腐生葡萄球菌、不动杆菌)进行PCR反应,反应条件体系应用优化完成的(先单一PCR反应,再双重PCR反应,最后三重PCR反应),重复试验2次,检测其特异性。
1.2.7 PCR检测的灵敏性试验
对无乳链球菌、金黄色葡萄球菌、绿脓杆菌进行菌液浓度测定,计算1 mL菌液的浓度。将计算好的1 mL菌液进行DNA提取,稀释成10-1、10-2、10-3、10-4、10-5、10-66个浓度梯度分别为模板进行PCR反应,反应条件体系应用优化完成的(先单一PCR反应,再双重PCR反应,最后三重PCR反应),检测其灵敏性。
1.2.8 PCR产物电泳检测
PCR产物进行1.5%琼脂糖凝胶电泳检测,电压为120 V,时间30 min。
表1引物名称、序列、扩增片段大小
Table1Name of primers, primer sequences and size of product
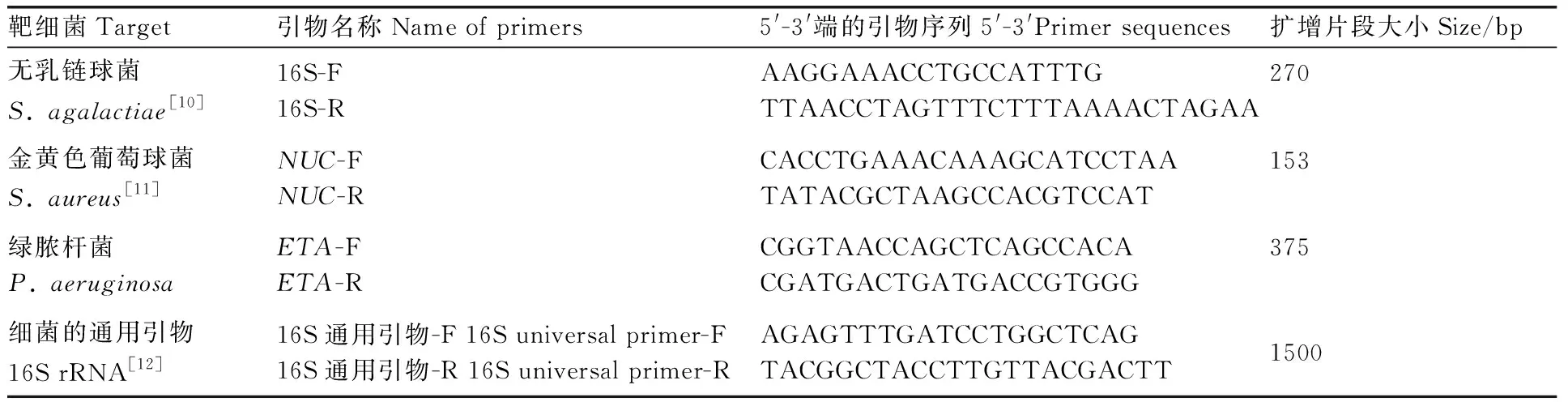
靶细菌Target引物名称Name of primers5'-3'端的引物序列5'-3'Primer sequences扩增片段大小Size/bp无乳链球菌S. agalactiae[10]16S-F16S-RAAGGAAACCTGCCATTTGTTAACCTAGTTTCTTTAAAACTAGAA270金黄色葡萄球菌S. aureus[11]NUC-FNUC-RCACCTGAAACAAAGCATCCTAATATACGCTAAGCCACGTCCAT153绿脓杆菌P. aeruginosaETA-FETA-RCGGTAACCAGCTCAGCCACACGATGACTGATGACCGTGGG375细菌的通用引物16S rRNA[12]16S通用引物-F 16S universal primer-F16S通用引物-R 16S universal primer-RAGAGTTTGATCCTGGCTCAGTACGGCTACCTTGTTACGACTT1500
2 结果与分析
2.1 多重PCR优化结果
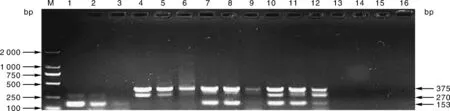
多重PCR最佳反应条件为(50 μL体系):25 μL的Mix、3种细菌特异性引物的上游和下游引物各1 μL、绿脓杆菌与金黄色葡萄球菌基因组DNA模板各1 μL(金黄色葡萄球菌DNA浓度为59.7 ng·μL-1、绿脓杆菌DNA浓度为50 ng·μL-1)、无乳链球菌基因组DNA模板2 μL(DNA浓度为66.8 ng·μL-1)、15 μL的双蒸水。反应程序为:95 ℃ 5 min;95 ℃ 30 s、56.9 ℃ 30 s、72 ℃ 30 s,35个循环;72 ℃ 7 min;12 ℃保存(图1)。
2.2 PCR特异性结果
2.2.1 无乳链球菌特异性结果
无乳链球菌与芽孢杆菌、大肠埃希菌、粪球菌、柠檬酸杆菌、不动杆菌、腐生葡萄球菌在相同的条件下加入无乳链球菌特异性引物与16S rRNA通用引物进行PCR反应,结果具有高特异性(图2)。
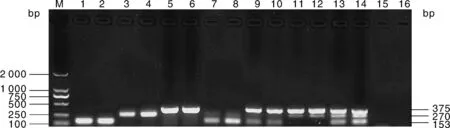
M,DNA分子量标准DL2000;1~2,金黄色葡萄球菌;3~4,无乳链球菌;5~6,绿脓杆菌;7~8,无乳链球菌与金黄色葡萄球菌;9~10,金黄色葡萄球菌与绿脓杆菌;11~12,绿脓杆菌与无乳链球菌;13~14,无乳链球菌、金黄色葡萄球菌与绿脓杆菌;15~16,阴性对照组。M, DNA marker DL2000; 1-2, S. aureus; 3-4, S. agalactiae; 5-6, P. aeruginosa; 7-8, S. agalactiae and S. aureus; 9-10, S. aureus and P. aeruginosa; 11-12, P. aeruginosa and S. agalactiae; 13-14, S. agalactiae, S. aureus and P. aeruginosa; 15-16, Negative control group.图1 单重PCR与多重PCR结果Fig.1 Single and multiplex PCR results
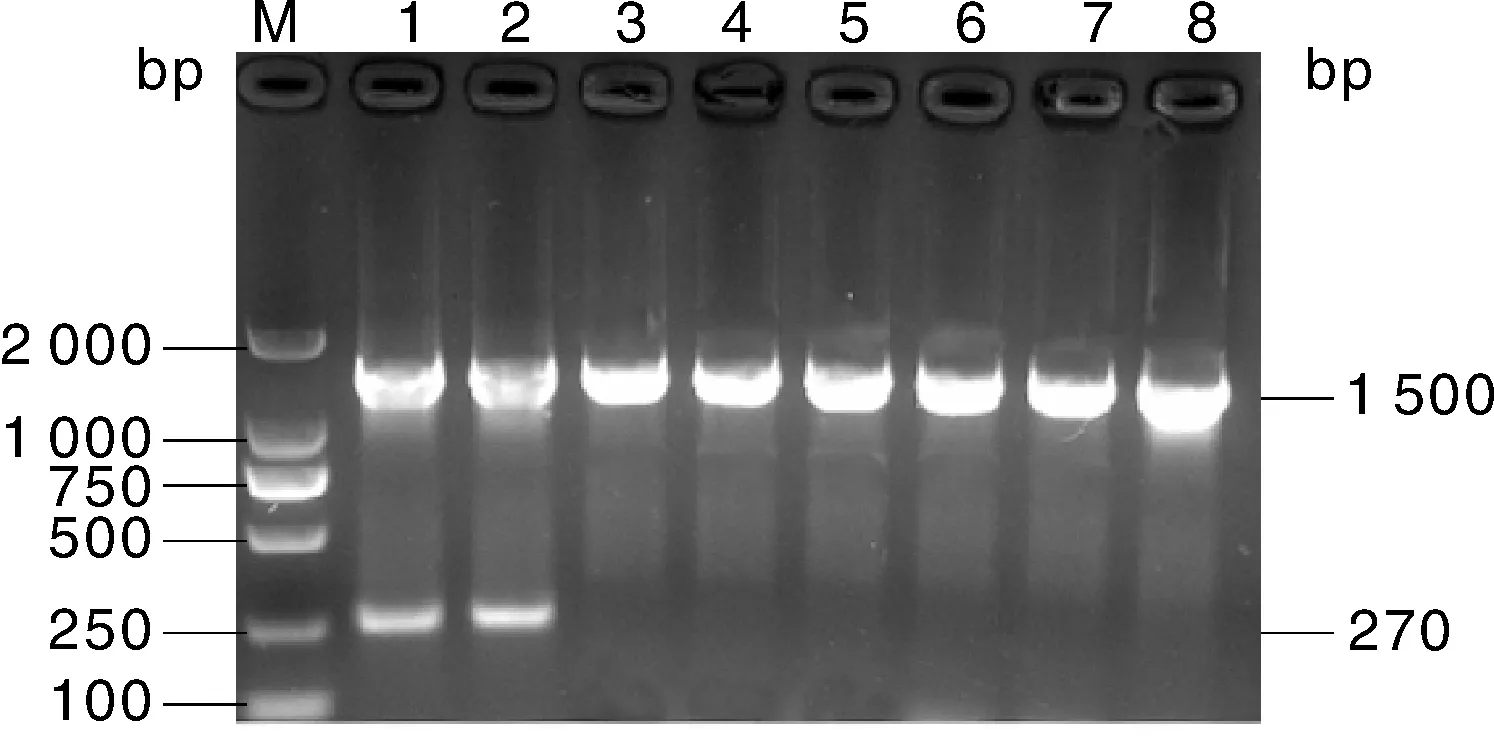
M,DNA分子量标准DL2000;1~2,无乳链球菌;3,芽孢杆菌;4,大肠埃希菌;5,粪球菌;6,柠檬酸杆菌;7,不动杆菌;8,腐生葡萄球菌。1~8均加入无乳链球菌特异性引物与16S通用引物。M, DNA marker DL2000; 1-2, S. agalactiae; 3, Bacillus; 4, E. coli; 5, Dungococcus; 6, Citrobacter; 7, Acinetobacter; 8, Staphylococcus saprophyticus. 1-8 were added with S. agalactiae-specific primers and 16S universal primers.图2 无乳链球菌特异性试验结果Fig.2 Specificity test results for S. agalactiae
2.2.2 绿脓杆菌特异性结果
绿脓杆菌与芽孢杆菌、大肠埃希菌、粪球菌、柠檬酸杆菌、不动杆菌、腐生葡萄球菌在相同的条件下加入绿脓杆菌特异性引物与16S通用引物进行PCR反应,结果具有高特异性(图3)。
2.2.3 金黄色葡萄球菌特异性结果
金黄色葡萄球菌与芽孢杆菌、大肠埃希菌、粪球菌、柠檬酸杆菌、不动杆菌、腐生葡萄球菌在相同的条件下加入金黄色葡萄球菌特异性引物与16S通用引物进行PCR反应,结果具有高特异性(图4)。
2.2.4 无乳链球菌与金黄色葡萄球菌双重PCR的特异性结果
无乳链球菌与金黄色葡萄球菌双重PCR具有高特异性(图5)。

M,DNA分子量标准DL2000;1~2,绿脓杆菌;3,芽孢杆菌;4,大肠埃希菌;5,粪球菌;6,柠檬酸杆菌;7,不动杆菌;8,腐生葡萄球菌。1~8均加入绿脓杆菌特异性引物与16S通用引物。M, DNA marker DL2000; 1-2, P. aeruginosa; 3, Bacillus; 4, E. coli; 5, Dungococcus; 6, Citrobacter; 7, Acinetobacter; 8, Staphylococcus saprophyticus. 1-8 were added with P. aeruginosa-specific primers and 16S universal primers.图3 绿脓杆菌特异性试验结果Fig.3 Specific test results for P. aeruginosa

M,DNA分子量标准DL2000;1~2,金黄色葡萄球菌;3,芽孢杆菌;4,大肠埃希菌;5,粪球菌;6,柠檬酸杆菌;7,不动杆菌;8,腐生葡萄球菌。1~8均加入金黄色葡萄球菌特异性引物与16S通用引物。M, DNA marker DL2000; 1-2, S. aureus; 3, Bacillus; 4, E. coli; 5, Dungococcus; 6, Citrobacter; 7, Acinetobacter; 8, Staphylococcus saprophyticus. 1-8 were added with S. aureus-specific primers and 16S universal primers.图4 金黄色葡萄球菌特异性试验结果Fig.4 Specific test results for Staphylococcus aureus
2.2.5 无乳链球菌与绿脓杆菌双重PCR的特异性结果
无乳链球菌与绿脓杆菌双重PCR与阴性对照相比具有高特异性(图6)。
2.2.6 金黄色葡萄球菌与绿脓杆菌双重PCR的特异性结果
金黄色葡萄球菌与绿脓杆菌双重PCR与阴性对照相比具有高特异性(图7)。
2.2.7 无乳链球菌、绿脓杆菌、金黄色葡萄球菌多重PCR特异性试验结果
无乳链球菌、绿脓杆菌、金黄色葡萄球菌多重PCR与阴性对照相比具有高特异性(图8)。

M,DNA分子量标准DL2000;1~2,金黄色葡萄球菌与无乳链球菌;3,芽孢杆菌;4,大肠埃希菌;5,芽孢杆菌与大肠埃希菌。1~5均加入金黄色葡萄球菌与无乳链球菌的特异性引物、16S通用引物。M, DNA marker DL2000; 1-2, S. agalactiae and S. aureus; 3, Bacillus; 4, E. coli; 5, Bacillus and E. coli. 1-5 were added with specific primers for S. agalactiae and S. aureus, as well as 16S universal primers.图5 无乳链球菌与金黄色葡萄球菌双重PCR的特异性结果Fig.5 Dual-PCR specific results for S. agalactiae and S. aureus
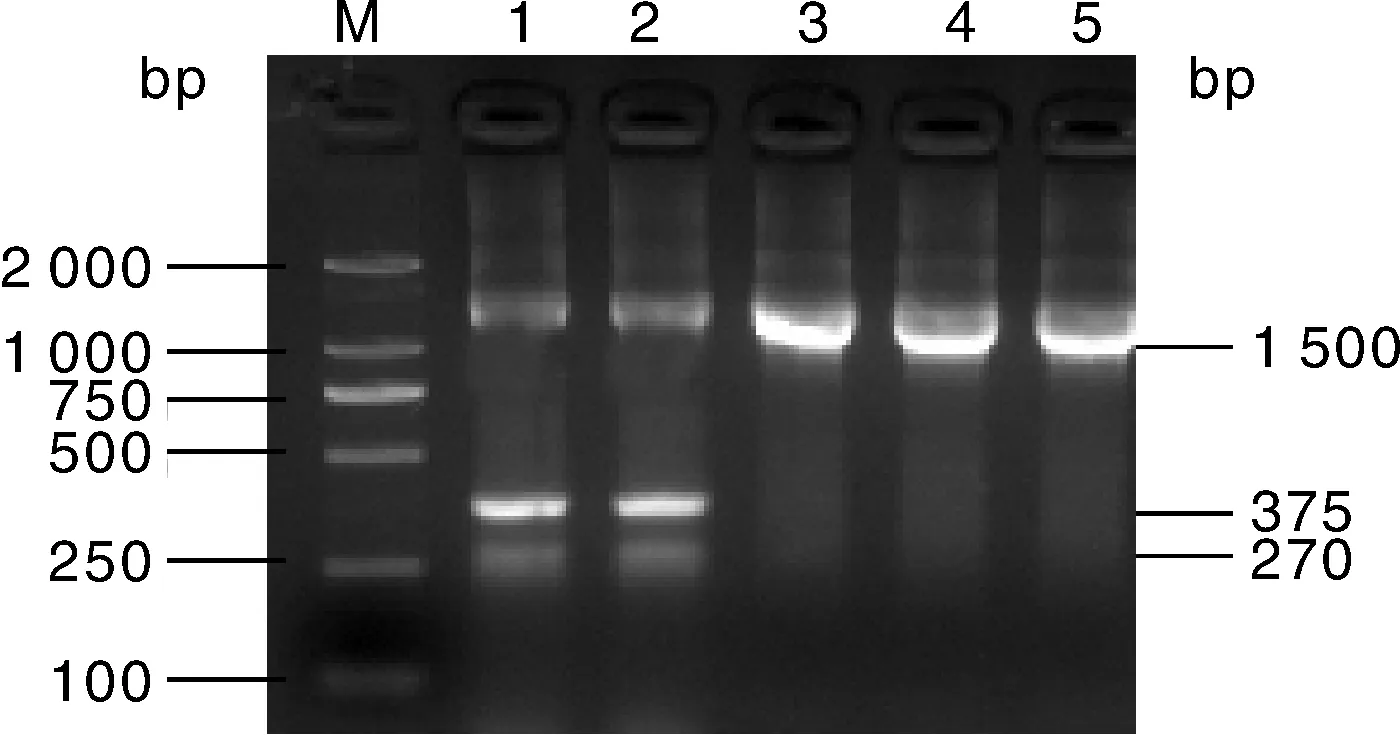
M,DNA分子量标准DL2000;1~2,无乳链球菌与绿脓杆菌;3,粪球菌;4,柠檬酸杆菌;5,粪球菌加柠檬酸杆菌。1~5均加入无乳链球菌与绿脓杆菌的特异性引物,16S通用引物。M, DNA marker DL2000; 1-2, S. agalactiae and P. aeruginosa; 3, Dungococcus; 4, Citrobacter; 5, Dungococcus and Citrobacter. 1-5 were added with specific primers for S. agalactiae and P. aeruginosa, as well as 16S universal primers.图6 无乳链球菌与绿脓杆菌双重PCR的特异性结果Fig.6 Dual-PCR specific results for S. agalactiae and P. aeruginosa
2.3 PCR灵敏性试验结果
2.3.1 单重PCR灵敏性试验结果
无乳链球菌、金黄色葡萄球菌、绿脓杆菌在1 mL脑心浸液肉汤37 ℃培养24 h后经过菌落计数测出浓度分别为8×107、4×107、1.5×109CFU·mL-1。无乳链球菌、金黄色葡萄球菌、绿脓杆菌1 mL菌液经试剂盒抽提DNA,用NanoDrop2000超微量分光光度计测定DNA浓度,分别为66.8、59.7、50.0 ng·μL-1。无乳链球菌的灵敏性在8×104CFU·mL-1-6.68×10-2ng·μL-1、金黄色葡萄球菌的灵敏性在4×104CFU·mL-1-5.97×10-2ng·μL-1、绿脓杆菌的灵敏性在1.5×105CFU·mL-1-5×10-3ng·μL-1(图9-图11)。

M,DNA分子量标准DL2000;1~2,金黄色葡萄球菌与绿脓杆菌;3,不动杆菌;4,腐生葡萄球菌;5,不动杆菌加腐生葡萄球菌。1~5均加入金黄色葡萄球菌与绿脓杆菌的特异性引物与16S通用引物。M, DNA standard DL2000; 1-2, S. aureus and P. aeruginosa; 3, Acinetobacter; 4, Staphylococcus saprophyticus; 5, Acinetobacter and Staphylococcus saprophyticus; 1-5 were added with specific primers for S. aureus and P. aeruginosa, as well as 16S universal primers.图7 金黄色葡萄球菌与绿脓杆菌双重PCR的特异性结果Fig.7 Dual-PCR specific results for S. aureus and P. aeruginosa

M,DNA分子量标准DL2000;1~2,无乳链球菌加金黄色葡萄球菌加绿脓杆菌;3,芽孢杆菌加大肠埃希菌加粪球菌;4,不动杆菌加腐生葡萄球菌加柠檬酸杆;5,芽孢杆菌加大肠埃希菌加不动杆菌;6,不动杆菌加腐生葡萄球菌加大肠埃希菌;7,芽孢杆菌加大肠埃希菌加腐生葡萄球菌;8,不动杆菌加腐生葡萄球菌加芽孢杆菌。1~8均加入无乳链球菌、金黄色葡萄球菌、绿脓杆菌的特异性引物与16S通用引物。M, DNA marker DL2000; 1-2, S. agalactiae, S. aureus and P. aeruginosa; 3, Bacillus, E. coli and Dungococcus; 4, Acinetobacter, Staphylococcus saprophyticus and Citrobacter; 5, Bacillus, E. coli and Acinetobacter ; 6, Acinetobacter, Staphylococcus saprophyticus and E. coli; 7, Bacillus, E. coli and Staphylococcus saprophyticus; 8, Acinetobacter and Staphylococcus saprophyticus and Bacillus. 1-8 were added with 4 primers including S. agalactiae, S. aureus, P. aeruginosa-specific primers and 16S universal primers.图8 无乳链球菌、绿脓杆菌、金黄色葡萄球菌多重PCR特异性试验结果Fig.8 Multiplex PCR specific test results for S. agalactiae, P. aeruginosa and S. aureus

M,DNA分子量标准DL2000;1,8×106 CFU·mL-1-6.68×100 ng·μL-1;2,8×105 CFU·mL-1-6.68×10-1 ng·μL-1;3,8×104 CFU·mL-1-6.68×10-2 ng·μL-1;4,8×103 CFU·mL-1-6.68×10-3 ng·μL-1;5,8×102 CFU·mL-1-6.68×10-4ng·μL-1;6,8×101 CFU·mL-1-6.68×10-5 ng·μL-1;7,阴性对照。M, DNA marker DL2000; 1, 8×106 CFU·mL-1-6.68×100 ng·μL-1; 2, 8×105 CFU·mL-1-6.68×10-1 ng·μL-1; 3, 8×104 CFU·mL-1-6.68×10-2 ng·μL-1; 4, 8×103 CFU·mL-1-6.68×10-3 ng·μL-1; 5, 8×102 CFU·mL-1-6.68×10-4 ng·μL-1; 6, 8×101 CFU·mL-1-6.68×10-5 ng·μL-1; 7, Negative control.图9 无乳链球菌灵敏性试验结果Fig.9 Sensitivity test results for S. agalactiae

M,DNA分子量标准DL2000;1,1.5×108 CFU·mL-1-5×100 ng·μL-1;2,1.5×107 CFU·mL-1-5×10-1 ng·μL-1;3,1.5×106 CFU·mL-1-5×10-2 ng·μL-1;4,1.5×105 CFU·mL-1-5×10-3ng·μL-1;5,1.5×104 CFU·mL-1-5×10-4 ng·μL-1;6,1.5×103 CFU·mL-1-5×10-5 ng·μL-1;7,阴性对照。M, DNA marker DL2000; 1, 1.5×108 CFU·mL-1-5×100 ng·μL-1; 2, 1.5×107 CFU·mL-1-5×10-1 ng·μL-1; 3, 1.5×106 CFU·mL-1-5×10-2 ng·μL-1; 4, 1.5×105 CFU·mL-1-5×10-3 ng·μL-1; 5, 1.5×104 CFU·mL-1-5×10-4 ng·μL-1; 6, 1.5×103 CFU·mL-1-5×10-5 ng·μL-1; 7, Negative control.图10 绿脓杆菌灵敏性试验结果Fig.10 Sensitivity test results for P. aeruginosa

M,DNA分子量标准DL2000;1,4×106 CFU·mL-1-5.97×100 ng·μL-1;2,4×105 CFU·mL-1-5.97×10-1 ng·μL-1;3,4×104 CFU·mL-1-5.97×10-2ng·μL-1;4,4×103 CFU·mL-1-5.97×10-3 ng·μL-1;5,4×102 CFU·mL-1-5.97×10-4ng·μL-1;6,4×101 CFU·mL-1-5.97×10-5 ng·μL-1;7,阴性对照。M, DNA marker DL2000; 1, 4×106 CFU·mL-1-5.97×100 ng·μL-1; 2, 4×105 CFU·mL-1-5.97×10-1 ng·μL-1; 3, 4×104 CFU·mL-1-5.97×10-2ng·μL-1; 4, 4×103 CFU·mL-1-5.97×10-3 ng·μL-1; 5, 4×102 CFU·mL-1-5.97×10-4ng·μL-1; 6, 4×101 CFU·mL-1-5.97×10-5 ng·μL-1; 7, Negative control.图11 金黄色葡萄球菌灵敏性试验Fig.11 Sensitivity test results for S. aureus
2.3.2 多重PCR灵敏性试验结果
无乳链球菌与金黄色葡萄球菌双重PCR在稀释度10-2处能检出基因条带。无乳链球菌与绿脓杆菌双重PCR在稀释度10-3处能检出基因条带。绿脓杆菌与金黄色葡萄球菌双重PCR在稀释度10-2处能检出基因条带。无乳链球菌与绿脓杆菌、金黄色葡萄球菌的多重PCR在稀释度10-3处能检出基因条带(图12)。
2.4 三重PCR重复性试验结果
三重PCR重复试验5次,结果具有良好的重复性(图13)。
3 讨论
奶牛乳房炎是目前尚未彻底解决的奶牛常见和多发的疾病之一,是奶牛乳腺受到蚊虫叮咬、物理刺激、病原微生物等环境刺激时,产生的一系列不同程度的炎症反应[13]。根据是否出现明显临床症状,将其分为临床乳房炎和隐性乳房炎,其中隐性乳房炎发病率最高,占牛群无明显临床乳房炎症状的奶牛的20%~50%,给奶牛场造成极为严重的经济损失[14]。引起奶牛隐性乳房炎的病原较多,临床上可在隐性乳房炎奶牛体内同时分离到多种微生物病原,如细菌、支原体、真菌、病毒等。已有文献研究表明,较常见的隐性乳房炎病原有23种,其中细菌占14种,霉形体2种,真菌与病毒各7种[15]。本实验着重通过构建细菌检测方法分析隐性乳房炎的发病情况。目前,从致病菌的传染性、普遍性及危害程度等角度来看,导致奶牛乳房炎最重要的致病菌主要为金黄色葡萄球菌、无乳链球菌和绿脓杆菌[16-17]。
M,DNA分子量标准DL2000;1,无乳链球菌与金黄色葡萄球菌稀释梯度为10-1的双重PCR;2,无乳链球菌与金黄色葡萄球菌稀释梯度为10-2的双重PCR;3,无乳链球菌与金黄色葡萄球菌稀释梯度为10-3的双重PCR;4,无乳链球菌与绿脓杆菌稀释梯度为10-1的双重PCR;5,无乳链球菌与绿脓杆菌稀释梯度为10-2的双重PCR;6,无乳链球菌与绿脓杆菌稀释梯度为10-3的双重PCR;7,绿脓杆菌与金黄色葡萄球菌稀释梯度为10-1的双重PCR;8,绿脓杆菌与金黄色葡萄球菌稀释梯度为10-2的双重PCR;9,绿脓杆菌与金黄色葡萄球菌稀释梯度为10-3的双重PCR;10,无乳链球菌、绿脓杆菌、金黄色葡萄球菌稀释梯度为10-1的多重PCR;11,无乳链球菌、绿脓杆菌、金黄色葡萄球菌稀释梯度为10-2的多重PCR;12,无乳链球菌、绿脓杆菌、金黄色葡萄球菌稀释梯度为10-3的多重PCR;13~16,阴性对照。M, DNA marker DL2000; 1, Double PCR for S. agalactiae and S. aureus with dilution gradient of 10-1; 2, Double PCR for S. agalactiae and S. aureus with dilution gradient of 10-2; 3, Double PCR for S .agalactiae and S .aureus with dilution gradient of 10-3; 4, Double PCR for S. agalactiae and P. aeruginosa with dilution gradient of 10-1; 5, Double PCR for S. agalactiae and P. aeruginosa with dilution gradient of 10-2; 6, Double PCR for S. agalactiae and P. aeruginosa with dilution gradient of 10-3; 7, Double PCR for P. aeruginosa and S .aureus with dilution gradient of 10-1; 8, Double PCR for P. aeruginosa and S. aureus with dilution gradient of 10-2; 9, Double PCR for P. aeruginosa and S. aureus with dilution gradient of 10-3; 10, Multiplex PCR for S. agalactiae, S. aureus and P. aeruginosa with dilution gradient of 10-1; 11, Multiplex PCR for S. agalactiae, S. aureus and P. aeruginosa with dilution gradient of 10-2; 12, S. agalactiae, S. aureus and P. aeruginosa with dilution gradient of 10-3; 13-16, Negative control.图12 多重PCR灵敏性试验结果Fig.12 Sensitivity test results for multiplex PCR

M,DNA分子量标准DL2000;1~5,无乳链球菌与金黄色葡萄球菌与绿脓杆菌;6,阴性对照。M, DNA marker DL2000; 1-5, S. agalactiae, S. aureus and P. aeruginosa; 6, Negative control.图13 三重PCR重复试验结果Fig.13 Repeat test results for triple PCR
无乳链球菌亦称B群链球菌,是一种专性乳腺寄生的具有高度传染性的致病菌,多发于隐性乳房炎,也可造成乳腺组织的纤维化[18],还可引起新生儿败血症、肺炎和脑膜炎,奶牛乳腺炎及鱼类脑膜炎[19],是一种人兽共患病的病原菌。无乳链球菌的致病性与其产生的多种毒力因子有关,已报道的有纤维蛋白原蛋白、菌毛蛋白、β溶血素和脂磷壁酸等[20-21]。在奶牛乳房炎中,乳腺组织发生损伤,为了修复损伤和改造炎性渗出物,奶牛机体成纤维细胞转化为肌纤维母细胞,分泌细胞外基质,造成乳腺组织的纤维化。金黄色葡萄球菌属于传染性致病菌,是引起奶牛隐性乳房炎最主要的病原微生物之一,它不仅能逃逸宿主牛的天然防御系统,还能摧毁宿主的免疫系统[22-23],常由乳头管侵入,寄居于乳头管后再向乳腺组织内部蔓延,造成急性乳房炎或慢性乳房炎;除降低产奶量外,还会导致乳区纤维化和小胳肿,造成永久性实质病变[24]。金黄色葡萄球菌也是最易产生抗性菌株的病原菌之一,它通过产生青霉素酶、L-型缺失细胞壁变种株等机制,使其对抗生素耐药性大大增强,临床治疗日渐困难[25]。绿脓杆菌为假单胞菌属条件性致病菌,该菌广泛存在于自然界的水、土壤,空气及动物的肠道和皮肤中。其代谢产物中有一种毒力很强的外毒素A,是一种致死性外毒素。外毒素A可用福尔马林脱毒成为类毒素,使其毒力减弱,有防治绿脓杆菌感染的作用[26]。另外还有一种溶血毒素为磷脂酶C,它能给入侵的细菌提供营养,增加绿脓杆菌的毒力[27]。常常是因为奶牛乳房炎其他病原菌感染而引起的继发感染,绿脓杆菌引起的乳房炎常为混合感染。由绿脓杆菌引起的隐性乳房炎往往会在很短的时间内转变成临床型乳房炎,严重的会导致奶牛直接淘汰[28]。
无乳链球菌16S rRNA基因具有高度的保守性和特异性并且该基因序列足够长,金黄色葡萄球菌NUC基因具有热稳定性是检测金黄色葡萄球菌的重要标志[29],绿脓杆菌ETA基因是编码外毒素的重要基因,是绿脓杆菌标志性基因。因此本研究根据无乳链球菌16S rRNA基因、金黄色葡萄球菌NUC基因、绿脓杆菌ETA基因参考文献设计出3对特异性引物。单一PCR灵敏性试验结果表示,无乳链球菌最低检出限是DNA浓度为6.68×10-2ng·μL-1,对应菌液浓度为8×104CFU·mL-1;金黄色葡萄球菌最低检出限为DNA浓度5.97×10-2ng·μL-1,对应菌液浓度为4×104CFU·mL-1;绿脓杆菌最低检出限为DNA浓度5×10-3ng·μL-1,对应菌液浓度为1.5×105CFU·mL-1。多重PCR灵敏性试验结果显示,无乳链球菌与金黄色葡萄球菌双重PCR在稀释度10-2处能检出基因条带;无乳链球菌与绿脓杆菌双重PCR在稀释度10-3处能检出基因条带;绿脓杆菌与金黄色葡萄球菌双重PCR在稀释度10-2处能检出基因条带;无乳链球菌与绿脓杆菌、金黄色葡萄球菌的多重PCR在稀释度10-3处能检出基因条带。因此,无论是多重PCR,还是单重PCR,在稀释度为10-2以下均能检测出基因条带,对应的菌液浓度范围为1.5×106CFU·mL-1以上均能检测出基因条带。单一PCR与多重PCR特异性结果显示,3种特异性引物与16S rRNA通用引物之间分别具有较高的特异性,3种特异性引物扩增条带与GenBank上和细菌基因序列同源性为99%。三重PCR试验结果表明,具有良好的重复性。综上所述,本实验建立的多重PCR方法具有快速、简便、特异性强、灵敏度高的特征,可有效用于奶牛隐性乳房炎中无乳链球菌、绿脓杆菌、金黄色葡萄球菌的检测。

