CT扫描联合磁共振诊断原发性肝癌及评估其介入治疗术后的临床效果
杨德顺,甘椿银
(邻水县人民医院 四川 广安 638500)
原发性肝癌属于临床常见的恶性肿瘤,发病率占肿瘤第3位,并且死亡率较高,仅次于肺癌,位居第二。这主要是由于大部分患者在发病早期,并无典型临床症状,诊断难度较大,通常在确诊时,患者病情已经发展到中晚期,错失了早期肝癌手术治疗的机会[1]。因此,对于中晚期肝癌患者,临床主要以介入手术进行治疗。肝动脉化疗栓塞术(TACE)也是肝癌介入治疗中的重要方法之一。目前,CT扫描与MRI均为临床诊断肝癌以及评估其介入治疗术后效果的依据,研究表明[2],应用MRI对于癌灶直径≤3cm的小肝癌比应用CT扫描的敏感度与特异度高;而CT扫描对于小囊肿与血管断面的诊断效果则较MRI好,考虑两种方式在肝癌临床诊断中可能具有互补的作用。因此,为探究CT扫描联合MRI在原发性肝癌诊断以及介入治疗预后效果评估中的应用效果,故而选取了本院2014年1月—2016年1月收治的146例患者进行回顾性研究分析。
1 资料与方法
1.1 一般资料
随机选取本院2014年1月—2016年1月就本院治疗的原发性肝癌患者146例患者为研究对象,纳入患者均满足中国抗癌协会专业委员会对于原发性肝癌的临床诊断标准,同时患者均为中晚期,有单发病灶,也有多发病灶。将单纯MRI检查的80例患者纳入MRI组;其中男性46例、女性34例,年龄为33~76岁、平均(50.12±6.12)岁,44例为肝右叶、36例为肝左叶,病灶共97个,病灶平均直径在(7.12±2.01)cm有47例,在(13.32±2.54)cm有33例。行CT联合MRI检查的66例患者则纳入联合组;其中男性42例、女性24例,年龄为35~74岁、平均(51.08±5.74)岁,37例为肝右叶、29例为肝左叶,病灶共81个,病灶平均直径在(7.12±2.01)cm有47例,在(13.32±2.54)cm有33例。两组上述资料对比差异不具有统计学意义(P>0.05)。
1.2 方法
MRI组患者术前、术后行单纯MRI扫描;联合组则给予患者C扫描与MRI联合扫描,两项检查时间间隔不超过1周。同时,在对两组患者进行术前诊断后,均给予TACE介入手术治疗,即对患者行单侧股动脉穿刺后,选择插管化疗栓塞,经治疗1个月后进行复诊。
CT检查:检查前叮嘱患者禁食12h,并于扫描前20min指导患者摄入600~1000ml温开水;而后,应用飞利浦螺旋CT在患者平静呼吸下屏气实施全肝一次性扫描,以初步掌握其全肝情况与病灶大小、邻近组织等情况。随后,采用专用高压注射器将碘海醇或碘帕醇等非离子型等渗造影剂经患者肘静脉注入,对全肝动脉期、门静脉期以及延迟期的增强扫描;对于瘸灶区,则加扫2~3层薄层。
MRI检查:在实施扫描前,叮嘱患者禁食,禁水4h,患者取仰卧位、头先进,并叮嘱患者放轻松;而后采用GE Signa Twinspeed1.5T进行扫描,选择矩阵205×256,于患者腹部包绕线圈,扫描野为280mm×280mm×350mm×350mm。随后给予患者常规T1W1,SE序列、T2W1,FSE序列进行横断位、冠状位扫描,结合STIR扫描;而后即为患者注射10~15ml/支的钆喷酸葡甲胺盐注射液行增强扫描,采用快速梯度回波T1WI序列。
1.3 评价指标与判定标准
由本院具有10年以上腹部影像学阅片、诊断经验的2名影像学诊断医师采用双盲评估与评分法进行诊断,对CT,MRI平扫与增强图像进行判断;同时观察患者介入治疗术后动脉期强化区残留情况。按5级评分法可疑病灶区进行评分,1分表示无残留强化区,2分表示可能没有残留强化区,3分表示不确定有无残留强化区,4分则表示可能有残留强化区,5分表示存在残留强化区。同时,对于评分到达4~5分的CT、MRI图像,对其最大长径与最小短径进行测量。采用Kappa对2名阅片师诊断一致性进行检验,当Kappa值<0.40时,表示一致性较差,在0.41~0.75之间表示一致性好,>0.75则表示一致性非常好[3]。
1.4 统计学方法
文中数据分析、处理采用SPSS20.0软件进行,计量资料以(±s)表示,以t检验,(%)表示计数资料,以卡方检验,P<0.05表明两组数据对比差异具有统计学意义。
2 结果
2.1 影像学表现
两组患者经检查诊断显示,MRI组80例患者中,MRI影像学检查显示癌灶存在富血供,T1WI上呈稍低或等信号,脂肪变性或出血区呈高信号,坏死囊变区呈低信号;肿瘤假包膜呈低信号环。T2WI及STIR上肿瘤呈稍高信号,T1WI增强后显示明显强化为高信号。联合组共66患者中,均行CT检查,影像学图像平扫显示病灶呈低或等密度,增强后动脉期呈高低混杂密度,门静脉期病灶则呈等密度,平衡期呈相对低密度,全部增强过程呈“快进快出”现象;又行MRI扫描检查;其中有3例患者MRI检查发现合并有籽灶,CT检查未发现,其原因则与CT对小肝癌不敏感、同时对邻盘组织成像不清晰有关。其中2例患者CT检查发现合并籽灶而MRI检测未发现,未检出原因主要与病灶距心底层面、大血管、肝脏包膜较近有关。
2.2 两组术前检出率对比
MRI组80例经病理确诊的患者中,经MRI诊断显示为阳性的有68例,阳性检出率为85.00%,Kappa值为0.50;联合组66例经病理确诊的患者中,经CT联合MRI诊断显示为阳性的有63例,阳性检出率为95.45%,Kappa值为0.88;经比较,联合组阳性检出率与诊断一致性系数高于MRI组(P<0.05),见表1。

表1 两组术前检出率对比[n(%)]
2.3 两组患者介入治疗术后疗效评估
两组患者均接受多次介入(TACE)治疗,通过对患者进行为期3年的随访,146例患者均全部随访,随访率为100%,其中有56例患者随访期间死亡,死亡率为38.36%;最终完成随访的90例患者中,共有114个肿瘤病灶;两名阅片师具有较高的一致性,Kappa值为0.50。两组患者在治疗后对残留动脉期强化区进行评估与测量,结果显示,联合组与MRI组患者残留动脉期强化区评分比较以及最长直径比较差异并无统计学意义(P>0.05),但联合组对于最小短径的测量值则小于MRI组,且对比差异具有统计学意义(P<0.05),详见表2。
表2 两组患者介入术治疗后疗效评估(±s)
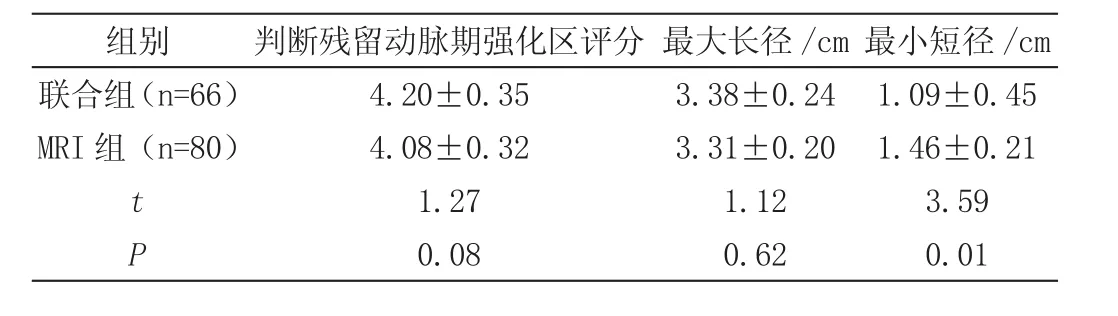
表2 两组患者介入术治疗后疗效评估(±s)
组别 判断残留动脉期强化区评分 最大长径/cm最小短径/cm联合组(n=66) 4.20±0.35 3.38±0.24 1.09±0.45 MRI组(n=80) 4.08±0.32 3.31±0.20 1.46±0.21 t 1.27 1.12 3.59 P 0.08 0.62 0.01
3 讨论
原发性肝癌由于病因复杂,同时早期并无典型症状,临床诊断难度较大,大部分患者经临床确诊时病情多已发展到中晚期。目前,CT与MRI扫描是临床筛查、初步诊断原发性肝癌的有效手段,两者对于肿瘤脂肪性变性、侵犯血管以及包膜存在等情况均具有较好的影像学依据[4]。在临床诊断中,对于小肝癌的诊断是术前诊断以及术后预后效果评估的重要影响因素。但单独应用CT或MRI检查在小肝癌中的诊断效果均不是很理想。而基于两种影像学检查的优势与不足,故而将CT、MRI联合用于原发性肝癌的诊断以及介入治疗术后评估中。
经研究结果显示,联合组患者的阳性检出率(95.45%)高于MRI组(85.00%),并且联合组两名阅片师诊断的一致性相对于MRI组更高(P<0.05)。这就表明,CT联合MRI检查在原发性肝癌的诊断中,诊断准确性更高。其中,CT在原发性肝癌检查中,主要通过对患者肝脏的大小、形态以及组织病变的密度差对疾病进行判断。由于肝癌实质为松散型结构,其密度相对于周围的正常组织较低,故而在扫描时,能够对其病理改变形态进行清晰显示。而MRI则能够实现多方位,多参数成像,且其不具有电离辐射,能够实现对横断面、冠状面以及矢状面成像,对于软组织的反映较好,具备较高的分辨能力;同时,对于肝内的血管以及胆管结能够清晰成像,尤其是在包膜的检查中,能够表现出低信号。但两者在单独使用时,对于影响原发性肝癌介入治疗预后效果的主要因素小肝癌的检出率均不高。对于CT检查而言,其在对小肝癌诊断过程中,对于乏血供,等密度病灶容易漏诊;另外由于可能存在伪影干扰,故而容易出现假阴性或假阳性情况;在肝密度与微小病灶密度相似时,CT难以检查出直径在3cm以下的肝肿瘤[5]。而MRI虽然对小肝癌具有较好的敏感性,但其对于较小的肿瘤以及血管断面难以进行区分,另外病灶距心底层面、大血管、肝脏包膜较近者,伪影干扰,故而检出率较低。而通过将两者联合使用,能够起到互补的作用,通过发挥两者的优势以弥补各自存在的局限,从而有效促进诊断效果的提升,并且具有较高的一致性。而两者在介入治疗术后的评估中,对于残留动脉期强化区具有较好的评估效果,尤其是对于最短小径病灶的评估效果更好。这一点在本次研究中,联合组最小短径小于MRI组(P<0.05)即能够表明。但需要注意的是,两种方法联合使用会使得检查费用增加,而这也是限制两者联合使用的主要原因。
4 结论
综上所述,CT联合MRI在原发性肝癌的诊断中具有较高的检出率,而在介入治疗术后,对于微小残存病灶的评估,具有较好的评估效果,临床应用价值较高。

