热休克蛋白-90α在乳腺癌诊断和疗效监测及复发预测中的临床价值
胡南林 李明舟 朱安婕 王佳玉 罗扬 马飞 李青 张频 徐兵河 袁芃
乳腺癌位居全世界女性恶性肿瘤发病率第1位,乳腺癌患者转移后的5年生存率为27%或更低[1]。肿瘤标志物水平可在影像学改变出现数月前即可有变化[2-3],具有早期诊断、监测复发的价值,但目前对于复发诊断的临界值,国际上尚无统一标准[4]。热休克蛋白-90α(heat shock protein-90α,HSP-90α)是在肿瘤发生发展中起着重要作用的高度保守蛋白伴侣[5],可在患者外周血中持续检测到,并且其水平与肿瘤良恶性及是否有远处转移相关[6-8]。目前HSP-90α在乳腺癌中的诊断敏感性、特异性数据缺乏,因此评估其在乳腺癌中的诊断效能具有重要意义。
1 材料与方法
1.1 材料
1.1.1 研究对象 选取2016年6月至2016年9月就诊中国医学科学院肿瘤医院615例女性患者的临床病理资料,分为试验组399例和对照组216例。试验组399例均为乳腺癌(包括导管原位癌)患者,再分为静态组289例及动态组110例,将有单次标本的患者归入静态组,根据TNM分期、组织学类型和分子分型进行分析,有连续2次或以上标本的患者归入动态组并仅用于动态连续分析,289例静态组中159例Ⅰ~Ⅲ期患者定义为随诊组,97例治疗后局部和远处转移患者定义为复发组并用于预测复发分析,余33例患者分期无法获得不纳入分析;对照组216例包括健康对照人群103例,乳腺良性肿瘤患者51例及非乳腺系统恶性肿瘤患者62例。51例乳腺良性肿瘤患者以乳腺纤维瘤为主(35例),还包括乳腺腺病、导管内乳头状瘤、乳腺腺肌症等(16例),62例非乳腺系统恶性肿瘤患者包括妇科肿瘤32例、呼吸系统9例、淋巴瘤7例、消化系统14例。限于试剂盒检测特性,不纳入处于妊娠、哺乳期患者。本研究采用乳腺癌AJCC指南(第七版)行TNM分期,2013年St.Gallen共识定义行分子分型。以影像学(CT或MRI)作为诊断复发的金标准。本研究获得本院伦理委员会批准,且得到受试者知情同意。
1.2 方法
1.2.1 血样采集及处理 使用EDTA-K2抗凝管采集所有患者的空腹外周静脉血样4 mL,混匀后置于4℃离心机,以3 000 r/min离心15 min分离血浆。手术患者至少术前24 h、术后1周采血,化疗患者至少于化疗前3日内、化疗后7日后采血。
1.1.2 血浆HSP-90α表达水平检测 采用酶联免疫法对HSP-90α表达水平行定量检测,按试剂盒说明书步骤测定,试剂盒购自烟台普罗吉生物科技发展有限公司(批号为20151203)。绘制标准曲线,受试者工作曲线(ROC)评估肿瘤标志物诊断效能,计算约登指数,选取其最大值对应的肿瘤标志物水平为最佳诊断临界值值。
1.3 统计学分析
应用SPSS20.0软件进行统计学分析,使用Graph-Pad Prism 7进行图表绘制。两组非配对分析使用Mann-Whitney U检验,两组配对样品分析采用Wilcoxon检验,3组以上比较采用Kruskal-Wallis检验,等级数据应用秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1 乳腺癌及其他人群血浆中的HSP-90α分布差异
乳腺癌患者血浆中的HSP-90α表达水平明显高于对照组中的健康对照人群(123.49 ng/mLvs.40.48 ng/mL,P<0.05)及乳腺良性肿瘤患者(56.36 ng/mL,P<0.05),但在乳腺癌与非乳腺系统恶性肿瘤(115.8 ng/mL)之间表达水平无显著性差异(P>0.05,图1)。浸润性乳腺癌患者的Luminal A型、Luminal B型、HER-2过表达型及三阴性乳腺癌各分子亚型间的HSP-90α表达水平无显著性差异(P>0.05)。乳腺癌TNM分期的Ⅳ期患者血浆中的HSP-90α表达水平显著高于Ⅰ、Ⅱ、Ⅲ期患者(P<0.05),但Ⅰ、Ⅱ、Ⅲ期患者间无显著性差异(P>0.05,表1)。
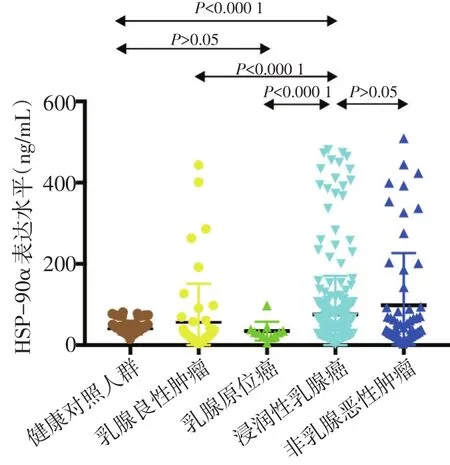
图1 各人群血浆中的HSP-90α分布
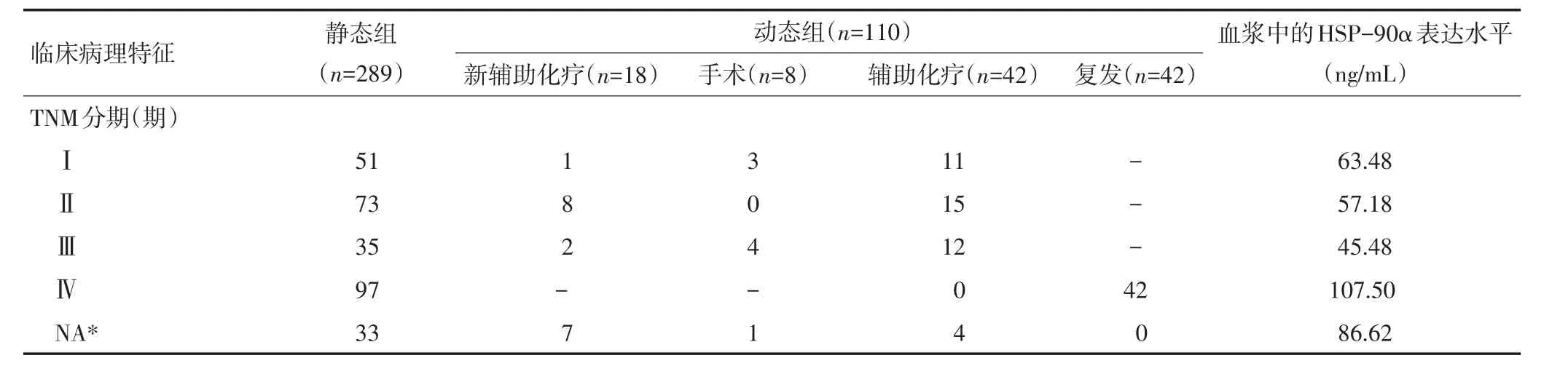
表1 399例试验组乳腺癌患者临床病理特征及血浆中HSP-90α表达水平

表1 399例试验组乳腺癌患者临床病理特征及血浆中HSP-90α表达水平(续表1)
2.2 血浆中的HSP-90α表达水平在乳腺癌诊断中的价值
检测经穿刺活检病理确诊的乳腺癌术前患者与对照组中健康对照人群血浆中的HSP-90α表达水平,绘制ROC曲线,曲线下面积(area under curve,AUC)为0.834(95%CI:0.715~0.952,P<0.0001)。在乳腺癌诊断中,选择血浆中的HSP-90α表达水平59.7 ng/mL作为截断值,灵敏度和特异度分别为78.6%和90.3%,阳性和阴性预测值分别为66.67%和93.88%(图2)。
2.3 血浆中的HSP-90α表达水平对乳腺癌复发的监测作用
检测随诊组和复发组乳腺癌患者血浆中的HSP-90α表达水平,绘制ROC曲线,评价血浆中的HSP-90α表达水平对乳腺癌复发的监测价值。选取血浆中HSP-90α表达水平43.22 ng/mL为截断值时,AUC为0.877(95%CI:0.833~0.922,P<0.0001),其灵敏度和特异度分别为95.7%和74.5%,阳性和阴性预测值分别为71.54%和96.2%(图3)。
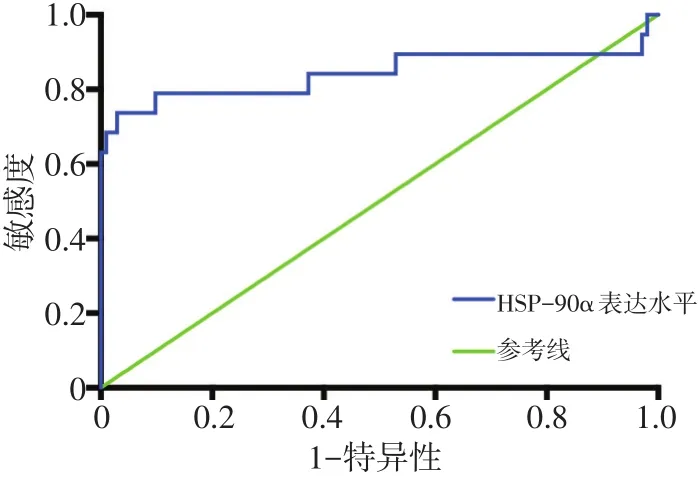
图2 血浆中的HSP-90α表达水平在乳腺癌诊断中的ROC曲线
2.4 动态监测疗效
8例乳腺癌手术患者,切除肿瘤负荷后,血浆中HSP-90α表达水平的平均值由术前的141.41 ng/mL降至术后的47.87 ng/mL,呈明显降低趋势(P<0.05)。18例行新辅助化疗患者,达部分缓解(partial response,PR)后行手术切除患者血浆中的HSP-90α表达水平下降87.82%(P<0.05),平均值由165.22 ng/mL降至术后20.12 ng/mL,疾病稳定(stable disease,SD)患者血浆中的HSP-90α表达水平平均下降34.36%(P>0.05)。
3 讨论

图3 血浆中的HSP-90α表达水平在乳腺癌复发诊断中的ROC曲线
乳腺癌为45岁以下女性最常见的癌症死因[9],复发转移后中位生存期为1~2年[10-11]。寻找早期诊断及监测复发相关的肿瘤标志物十分必要。本研究发现,HSP-90α对诊断乳腺癌及监测复发具有潜在价值,乳腺癌患者血浆中的HSP-90α表达水平显著高于健康对照人群、乳腺良性肿瘤以及乳腺原位癌(P<0.001),但乳腺癌与非乳腺系统恶性肿瘤血浆中的HSP-90α表达水平差异无统计学意义(P>0.05)。同时,在肺癌、肝癌、结肠癌、胃癌患者中都发现HSP-90α表达水平升高[7-8],血浆中的HSP-90α表达水平可作为肿瘤标志物发挥协助诊断及预测复发的作用[12],与本研究结果一致。
评价肿瘤标志物的诊断效能时,AUC越大对患者与健康人群的鉴别能力越强,目前临床上使用的CEA、CA15-3、CA125的AUC为0.70~0.82[13]。本研究选取血浆中的HSP-90α表达水平为59.7 ng/mL作为诊断乳腺癌临界值时,AUC为0.834,灵敏度和特异度分别为90.3%和78.6%,提示具有较高的诊断效能。
肿瘤标志物在随诊时,应具有良好监测复发的能力。研究显示,CEA、CA15-3与影像学存在一定的一致性,并可在影像学改变出现数月前即有变化,可作为乳腺癌术后随访指标之一[2-3]。目前,临床上常用的CEA和CA15-3在乳腺癌不同的分子亚型间存在显著性差异,在HER-2阳性型及三阴性乳腺癌患者中的表达水平较Luminal型偏低[4],导致各分子分型间预测复发或转移的临界值无统一标准。本研究显示,血浆中的HSP-90α表达水平不受乳腺癌分子分型的影响,当选取HSP-90α表达水平为43.22 ng/mL作为预测乳腺癌术后是否复发临界值时,其AUC为0.877,灵敏度和特异度分别为95.7%和74.5%,提示与肿瘤复发有较好的相关性,阴性预测值为96.2%,可能一定程度上降低假阳性率。
综上所述,本研究首次系统阐述了血浆中的HSP-90α作为乳腺癌肿瘤标志物,在早期辅助诊断及治疗后监测复发的临床价值,但因标本数量和种类尚不够充分和全面,还需进一步进行研究。

