压力刺激对组织工程骨替代物构建的促进作用研究
吕兰欣,颜晓庆,杨红宁,韩 东,胡书群
(徐州医科大学卫生应急研究所,徐州医科大学附属医院急救中心,江苏徐州221002)
0 引言
由于疾病、车祸、自然灾害等原因引起的大尺寸长骨缺损日益增多,其修复问题一直是困扰临床治疗的难题,组织工程概念的提出为这一问题的解决提供了可能[1]。经过近四十年的发展,骨组织工程研究已经取得了很大进展,大量的可降解生物材料用于制备组织工程支架,其中聚乳酸-聚乙醇酸共聚物(poly lactic-co-glycolic acid,PLGA)因其降解速率可调以及良好的生物相容性而获得广泛关注[2-4]。PLGA多孔支架具有高孔隙率和联通性,有利于细胞长入以及营养物质输送,在骨组织工程中被大量研究[5-6]。 然而,目前大部分骨组织工程的体外实验都是静态培养,与体内环境差异较大。 有研究[7-8]表明,动态培养如压力刺激等能够模拟体内环境,促进干细胞向成骨细胞分化,加速骨再生。本研究将微流控法与颗粒沥滤法相结合,制备PLGA多孔支架,与人骨髓间充质干细胞(human mesenchymal stem cells,hMSCs)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)共培养于压力型生物反应器中,研究压力刺激对共培养系统成骨作用的影响,进一步的,将压力刺激后的组织工程骨替代物植入鸡尿囊胚模型中,观察其成骨效果。
1 资料和方法
1.1 材料本实验所用hMSCs购自LONZA,HUVECs购自GIBCO;所用PLGA购自Sigma;细胞培养所需试剂均购自 Hyclone;细胞培养耗材均购自NUNC;细胞示踪染料PKH26购自Sigma;所用CCK-8试剂盒购自VICMED;羊抗人CD31一抗以及FITC标记的驴抗羊二抗均购自Santa Cruz。
1.2 方法
1.2.1 PLGA多孔支架制备 PLGA多孔支架的制备参照以前发表的文章进行[9]。简单介绍如下,利用本实验室搭设的微流控设备制备直径为300 μm左右的明胶微球,自组装法获得规则排列的具有蛋白石结构的明胶微球模板;将10%wt/v的PLGA溶液倾注于规则排列的明胶微球模板上,-20℃速冻2 h后冷冻干燥过夜去除溶剂;45℃水浴中搅拌过夜去除明胶微球,获得具有规则形貌的PLGA多孔支架。支架浸泡于70%的酒精中2 h转移至超净工作台,用磷酸盐缓冲液冲洗3次风干备用。
1.2.2 细胞培养 将第3代hMSCs离心5 min收集,用PKH26染色试剂盒对其进行示踪染色。具体步骤按说明书进行,简述如下:将收集的hMSCs用无血清培养基洗两遍,按1∶1将PKH26染液与稀释液C混合获得染料工作液,将工作液按1∶250的浓度加入稀释液C中与hMSCs混匀室温孵育10 min。加入等体积血清终止染色,用PBS洗3次获得荧光标记的hMSCs,计数备用。
收集HUVECs,将两种细胞按以下比例进行混合,hMSCs∶HUVECs=9 ∶1,以2×106/mL的浓度接种于PLGA多孔支架,进行静态培养,获得组织工程骨替代物。于接种后第1、3、7天用激光共聚焦显微镜观察细胞分布情况,第 3、5、7、9天用 CCK-8检测细胞增殖情况。
1.2.3 压力刺激 静态培养10 d后,将支架-细胞复合物转移至六孔板中,用专用的压力型生物反应器进行刺激,刺激频率为1 Hz,每次压力刺激时间为1 h,每天进行一次,共7 d。
动态培养7 d后取部分样品进行检测,micro-CT用来检测支架-细胞复合物经压力刺激后的成骨情况,扫描过程按照说明书以及仪器配置的软件进行。首先,将PLGA多孔支架作为空白对照进行扫描,分辨率为8 μm,确定钙化阈值为190,PLGA支架阈值为110。然后将静态培养和动态培养的支架-细胞复合物分别进行扫描,选择阈值190以上为钙化区域,110以下为PLGA支架区域。
扫描完成后,立即将支架-细胞复合物取出进行免疫荧光染色。4%多聚甲醛固定后用3%牛血清白蛋白封闭1 h,羊抗人CD31一抗稀释100倍4℃孵育过夜,PBS洗2次后加FITC标记的驴抗羊二抗进行室温孵育2 h,最后加入DAPI进行细胞核染色,用激光共聚焦显微镜观察。
1.2.4 CAM实验 将动态培养7 d后的组织工程骨替代物植入鸡尿囊胚模型(CAM)中,37℃孵育7 d,取出后用4%多聚甲醛固定30 min,用micro-CT来检测压力刺激后的支架-细胞复合物在模拟体内环境中的成骨情况,扫描过程按照说明书以及仪器配置的软件进行,具体同上。
1.3 统计学处理实验数据使用SPSS12.0统计软件进行分析,分析结果均以±s表示。统计采用单因素方差分析(One-Way ANOVA);两组比较时采用Student'st-test,P<0.05为差异具有统计学意义。
2 结果
2.1 细胞增殖及活性
2.1.1 细胞示踪 图1为PKH26染料对hMSCs进行细胞膜染色示踪结果,接种后第1、3、7天激光共聚焦显微镜观察,可见红色荧光显著增多,hMSCs在观察期增殖显著,表明PLGA多孔支架具有较好的细胞相容性。
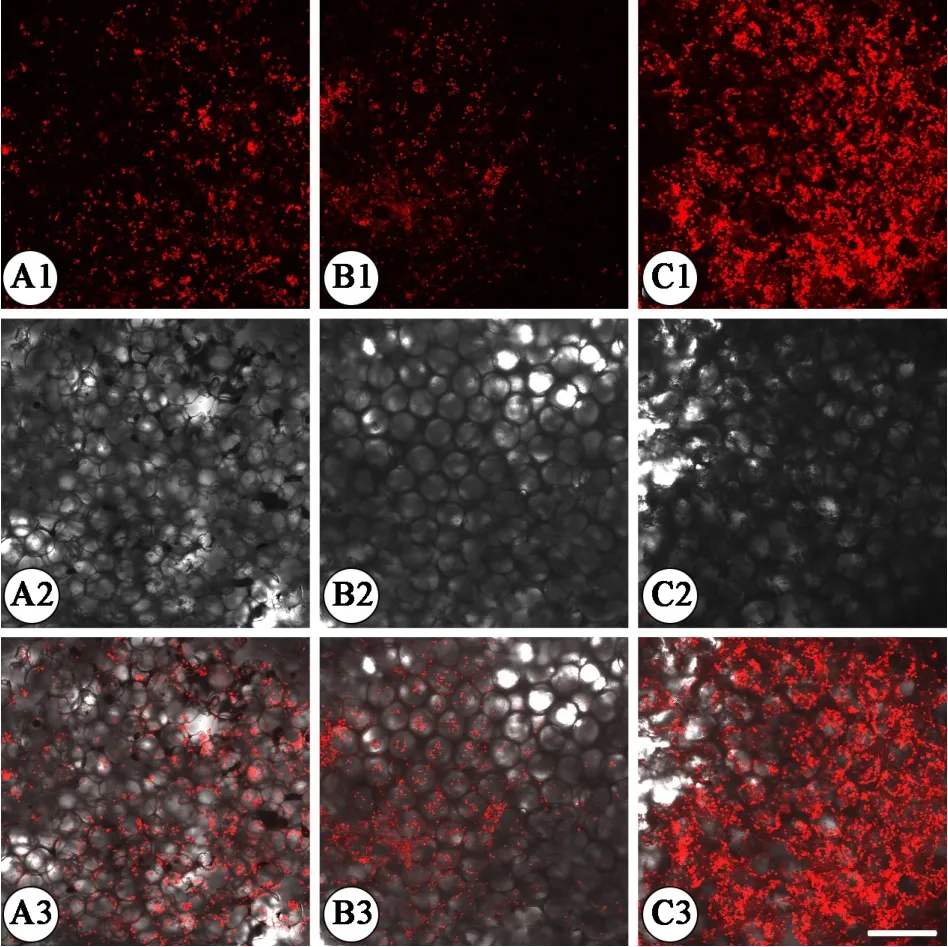
图1 hMSCs接种于PLGA多孔支架后第1、3、7天激光共聚焦显微镜观察结果
2.1.2 细胞增殖 图2为细胞接种后第3、5、7、9天CCK-8检测结果,可见在相应的检测时间点,吸光值逐渐增加,细胞增殖明显,这一结果与细胞示踪结果一致。

图2 hMSCs/HUVECs接种于 PLGA 多孔支架第 3、5、7、9天CCK-8检测结果
2.2 压力刺激对骨替代物构建的作用
2.2.1 PLGA多孔支架钙沉积 为检测压力刺激对细胞-支架复合物成骨的影响,在动态培养1周后进行了micro-CT检测。图3为micro-CT检测细胞-支架复合物在动态培养1周后的钙沉积情况。其中图3A为细胞-支架复合物静态培养,可见红色区域接近于0,表明hMSCs几乎没有成骨分化;而图3B为动态培养,可见有较为明显的红色区域,表明接种于PLGA多孔支架的hMSCs在压力刺激下可以向成骨细胞分化,并且在2周左右即出现明显钙沉积。

图3 Micro-CT检测PLGA多孔支架接种hMSCs并经压力刺激一周后的钙沉积情况
2.2.2 血管化 为检测压力刺激对细胞-支架复合物成血管的影响,在动态培养1周后进行了CD31染色。图4为细胞-支架复合物动态培养1周后CD31免疫荧光染色结果,其中图4A1~A4为静态培养组,图4B1~B4为动态培养组。由CD31绿色荧光染色可见,两组之间并没有显著差异,表明压力刺激对血管生成没有显著作用。

图4 细胞-支架复合物在动态培养1周后CD31免疫荧光染色结果
2.2.3 CAM培养后的钙沉积 为模拟体内环境,制备了CAM模型,将静态和动态培养的细胞-支架复合物植入其中,培养7 d后对其钙沉积状况进行了检测。由图可见在CAM模型中细胞-支架复合物的钙沉积情况明显优于体外培养组,并且压力刺激组钙沉积显著优于静态培养组(图5)。这一结果表明在模拟体内环境中,压力刺激能够显著提高细胞-支架复合物的钙沉积。
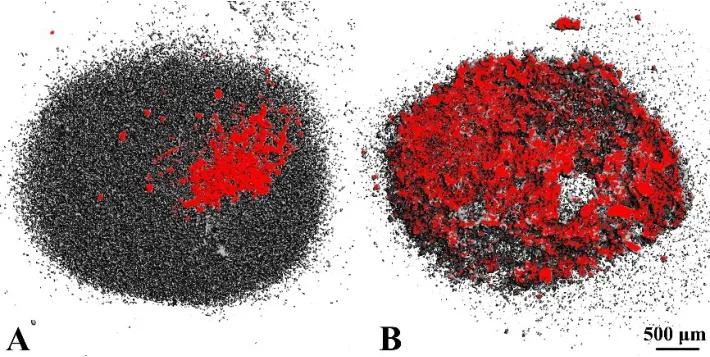
图5 细胞-支架复合物在CAM模型中培养7 d后检测钙沉积结果
3 讨论
骨组织工程研究为大片段骨缺损修复提供了可能。目前骨组织工程研究主要集中在骨组织工程支架设计以及诱导因子缓释上,在体外诱导干细胞成骨分化以及体内诱导骨再生方面取得了良好进展[10-12]。 在骨组织工程支架材料选取上,很多生物材料因其组织相容性好以及可降解特性被广泛关注,如PLGA、聚氨酯类(PHA)等;在支架设计上,多孔支架因为具有很好的孔隙率和联通性,有利于氧气和营养物质运输,有利于细胞和组织长入而被广泛关注和研究[13-16]。 多孔支架的制备方法很多,如盐颗粒沥滤、冷冻干燥、相分离等,其中研究[1,17-18]报道的明胶微球沥滤法可以获得孔径十分均一,且联通性极佳的多孔支架,并且不会因盐颗粒的残留影响后续研究,是一种有良好应用前景的骨组织工程支架制备方法。本研究采用微流控装置收集了直径300 μm左右(304.5±12.7 μm)的明胶微球,将其整齐排列成各微球间紧密连接的三维模板,采用溶剂流延颗粒沥滤法获得PLGA多孔支架,孔隙联通性接近100%,孔径大小适宜且均一性好,有报道[9]称此尺寸的孔径有利于血管长入以及快速成骨。PLGA是一种FDA认证的生物材料,具有良好的相容性,降解速率可调,被广泛应用于骨组织工程研究中。本研究通过细胞示踪技术以及细胞活性检测也表明,PLGA多孔支架具有很好的细胞相容性,hMSCs与HUVECs联合种植于PLGA多孔支架可以获得细胞-支架复合物。
虽然目前骨组织工程研究很多,但大部分都是直接将支架与细胞结合植入体内研究其成骨效果,其成骨速度较慢[3]。 有研究[7]聚焦于快速成骨,探讨了压力刺激对于成骨的促进作用。各种生物反应器也用于研究组织工程骨替代物的构建,加速骨缺损的修复,如灌注型生物反应器(perfusion-based bioreactor systems)、旋转型生物反应器(spinner flask bioreactor,rotating bioreactor systems)、压力型生物反应器(direct mechanical strain system)[19]。 本研究采用了压力型生物反应器对细胞-支架复合物进行间歇性压力刺激,结果表明与普通的静态培养法相比,该方法可以有效提高hMSCs的成骨能力;进一步通过CAM模型来模拟体内环境进行研究,发现压力刺激后的细胞-支架复合物能够产生更多的钙沉积,这也表明压力刺激可以有效提高组织工程骨替代物构建的速度,预示着压力刺激后的骨组织工程替代物在植入体内后能够更快地成骨,缩短骨缺损修复的时间。Reinwald等[20]报道压力刺激作用下,人骨髓间充质干细胞培养于静电纺丝纳米纤维基底,成骨标志物Ⅰ型胶原、碱性磷酸酶,以及Runx2均显著上调。这与本研究结果相一致。
血管化情况对于骨组织工程替代物能否有效促进骨缺损修复有重要参考价值,因为血管长入后可以将氧气和营养物质运输至多孔支架内部,会加快骨再生速度[21]。有很多血管生长因子被引入骨组织工程支架中以期达到促血管新生的目的[22-23]。 有研究[4,24]将内皮细胞与干细胞共培养,发现内皮细胞可以促进干细胞表达新生血管标志物CD31。本研究通过将hMSCs与HUVECs共培养于PLGA多孔支架形成细胞-支架复合物,分别进行动态培养和静态培养后进行CD31染色,检测复合物血管化情况,结果显示静态培养和动态培养组CD31的表达均较高,但是二者之间并无明显差异。这一结果表明,HUVECs与hMSCs共培养能够提高CD31表达,但压力刺激对于血管化并无明显助益。理论上血管生成是血液输送的需求所驱动,研究[3]发现,三维支架植入动物体内后新生血管可以长入支架内部,本研究暂未发现压力刺激对血管化的显著作用,后续我们将进一步进行动物实验来研究在有血液输送需求的情况下动态培养和静态培养对于血管新生的作用差异。
综上所述,本研究将hMSCs与HUVECs共培养于PLGA多孔支架形成细胞-支架复合物,通过体外培养及压力刺激构建了组织工程骨替代物,在模拟体内环境的CAM模型中对其进行培养,可以实现快速骨化,是一种有潜在应用前景的组织工程骨替代物。

