山楝中杀虫活性化学成分的提取与研究
樊世瑞,蔡洁云,杨碧娟,王宜挺,陈铎之,郝小江
(1.云南大学 化学科学与工程学院,云南 昆明 650091;2.中国科学院 昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650201;3.云南烟草质量监督检测站,云南 昆明 650091)
山楝属是楝科植物的重要组成,其化学成分结构复杂多变,活性独特,是植物化学研究的一个关注焦点.山楝的拉丁名为Aphanamixispolystachya(Wall.) R. N. Parker,在孟加拉被称为“tiktaraj”[1].主要分布于印度、中南半岛、马来西亚.我国产4种,分布于广东、广西和云南及台湾等省区[2].山楝之所以备受关注,是源于其种子、树皮、叶子、果实等作为植物药在民间的广泛使用[3].山楝的树皮具有收敛止血的功效,常用于脾脏及肝脏方面的疾病、癌症及腹部的各种不适;其种油可制成针对风湿病的搽剂(liniment)[4].其种子辛辣味苦,有泻下及驱蠕虫的功效,并可治愈胃溃疡[5- 6].此外,山楝的果实在去除苦味的油脂后,通常为用作肥料[7].山楝同时还是一类重要的农药来源植物,其中柠檬苦素类化合物如川楝素、印楝素等是重要的驱虫农药.文中对澜沧产山楝枝叶的次生代谢产物及其生物活性进行系统性研究并从山楝中得到5个具有良好杀虫活性的化合物,报告倍半萜化合物4个、甾体类化合物1个.
1 实验
1.1 原料、试剂及仪器
Bruker AM-400、Bruker DRX-500或Avance Ⅲ600 超导核磁共振仪.Finnigan MAT 90 和VG Auto Spec-3000 质谱仪.UV用Shimadzu-210A double-beam spectrophotometer测定.IR用KBr片通过Bruker-Tensor-27 spectrometer测定.熔点由X-4显微熔点仪测定.柱层析(Column chromatography,CC)用硅胶(60~80 目,200~300目,300~400目,青岛海洋化工厂生产)、MCI gel(CHP20P, 75~150 μm, Mitsubishi Chemical Industries Ltd, Tokyo, Japan)、C8反相硅胶(20~45 μm, Merck, Darmstadt, Germany)、C18反相硅胶(40-63 μm, Merck, Darmstadt, Germany)或Sephadex LH-20 gel (40~70 μm, Amersham Pharmacia Biotech AB, Uppsala, Sweden).TLC用预制硅胶板 GF254 (青岛海洋化工厂生产) 和预制硅胶板60 F254 (Merck, Darmstadt, Germany) .半制备HPLC用Hypersil Gold RP-C18柱(i.d. 10 mm × 250 mm; Thermo Fisher Scientific Inc., Waltham, Massachusetts, USA),条件为室温下用CH3CN-H2O洗脱.
山楝A.polystachya(Wall.) R. N. Parker 的枝叶于2015年8月采自云南省澜沧地区,样品由中国科学院昆明植物研究所的陈瑜研究员鉴定.
1.2 山楝中化学成分的提取方法
取自然风干的山楝枝叶30 kg,粉碎后,用90%乙醇提取,浓缩得浸膏,分别用石油醚、乙酸乙酯萃取.乙酸乙酯萃取部分依次用V(石油醚)∶V(丙酮)=50∶1~1∶1、V(氯仿)∶V(甲醇)=10∶1~ 0∶1梯度洗脱,得到7个组分(Fr.1~7).
其中,Fr.5经MCI柱层析、C8反相硅胶柱层析、反复Sephadex LH-20柱层析、硅胶柱层析、HPLC半制备C18反相柱柱层析,得到化合物1(270 mg)、2(120 mg)、3(50 mg)、4(28 mg)、5(80 mg),提取路线如图1所示.
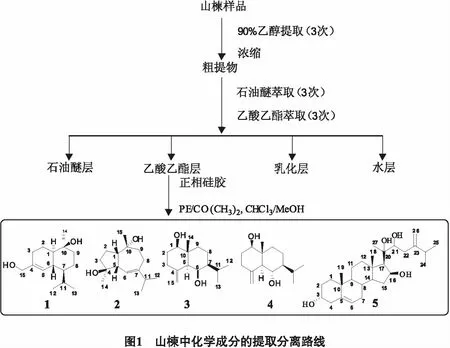
1.3 提取化合物波谱数据
化合物115-羟基-α-杜松醇, 白色无定型粉末. ESI-MS (m/z): 261 [M+H]+,分子式为C15H26O2;1H NMR和13C NMR (MeOD,600 MHz) 具体数据见表1.
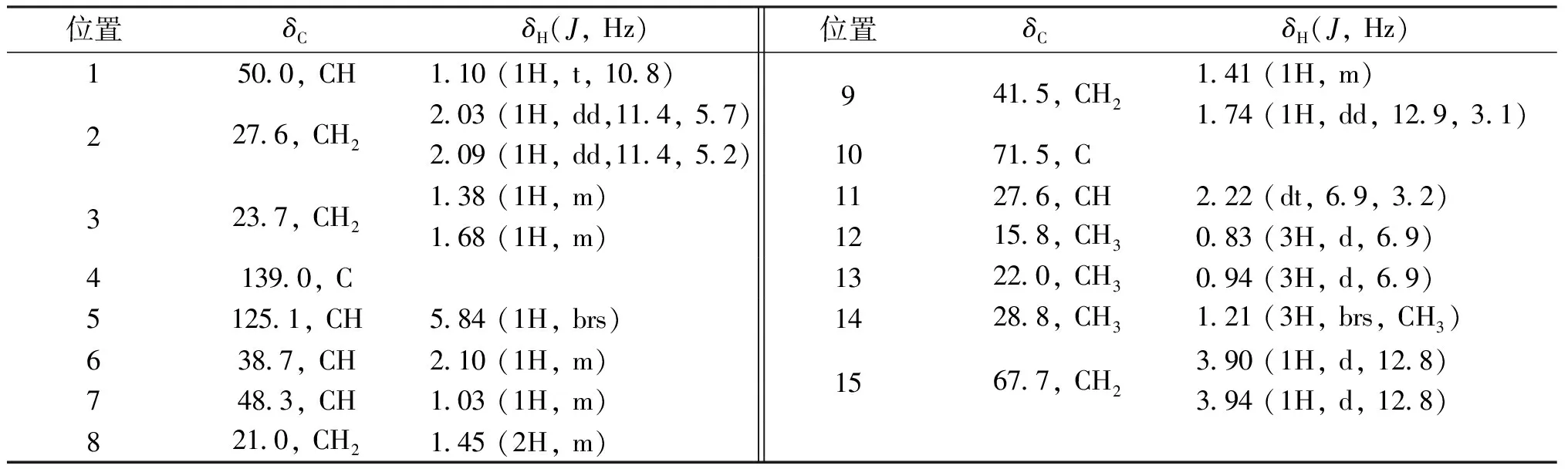
表1 化合物1核磁数据
化合物21S,4S,5S,10R-4,10-愈创木烷二醇,白色无定型粉末. ESI-MS (m/z): 239 [M+H]+,分子式为C15H28O2.13C NMR (CDCl3, 100 MHz) 149.6,(s, C-7), 121.2 (d, C-6), 80.2 (s, C-4), 75.3 (s, C-10),50.6 (d, C-1), 50.2 (d, C-5), 42.5 (t, C-9), 40.4 (t, C-3), 37.3 (d, C-11), 22.5 (q, C-15), 21.5 (t, C-2),21.5 (t, C-8), 21.4 (q, C-12), 21.3 (q, C-13), 21.1 (q, C-14).
化合物34(15)-桉叶烯-1β,6β-二醇,白色无定型粉末. ESI-MS (m/z): 847 [2M + Na]+.1H NMR (400 MHz, CDCl3)δ: 0.70 (3H, s, H-14), 0.86 (3H, d,J= 7.0, H-12), 0.94 (3H,s,J= 7.0, H-13), 3.41 (dd,J= 4.7, 11.5, H-1), 3.70 (t,J= 9.8, H-6), 4.73 (s, H-5β), 5.01 (s, H-5α).13C NMR (100 MHz, CDCl3)δ: 11.6 (C-14), 16.1 (C-13), 18.0 (C-8), 21.1 (C-12), 25.9 (C-11), 31.8 (C-2), 35.0 (C-3), 36.2 (C-9), 41.6 (C-10), 49.2 (C-7), 55.8 (C-5), 66.9 (C-6), 78.9 (C-1), 107.8 (C-15), 146.2 (C-4).
化合物44(15)-桉叶烯-1β,6α-二醇,白色无定型粉末.ESI-MS(m/z):239[M+H]+, 分子式为C15H26O2.1H NMR (400 MHz, CDCl3)δ: 1.04 (3H, s, H-30), 1.20 (3H, d,J= 7.0, H-12), 1.29 (3H, d,J= 7.0, H-13), 3.71 (dd,J= 4.1, 11.2, H-1), 4.03 (t,J= 9.7, H-6), 5.08 (s, H-5β), 5.33 (s, H-5α).13C NMR (100 MHz, CDCl3)δ: 12.7 (C-14), 17.0 (C-13), 19.4 (C-8), 22.3 (C-12), 27.1 (C-11), 32.9 (C-2), 36.5 (C-3), 37.5 (C-9), 43.1 (C-10), 51.2 (C-7), 56.7 (C-5), 68.3 (C-6), 79.9 (C-1), 109.1 (C-15), 147.0 (C-4).
化合物53α,16β,20,22-四羟基麦角甾-5,24(28)-二烯,白色无定型粉末.ESI-MS (m/z):469 [M + Na]+,分子式为C28H46O4.1H NMR (600 MHz, CDCl3)δ: 1.09 (3H, d,J= 2.2, H-27), 1.11 (3H, s, H-19), 1.12 (3H, d,J= 2.2, H-26), 1.52 (3H, s, H-21), 1.58 (3H, s, H-18), 3.89 (br.s, H-22), 4.62 (1H, d,J= 9.7, H-16), 4.94 (s, H-28), 4.90 (br.s, H-28), 5.44 (d,J= 5.7, H-6) .13C NMR (150 MHz, CDCl3)δ: 15.7 (C-18), 20.1 (C-19), 21.2 (C-11), 21.6 (C-21), 22.7 (C-27), 22.0 (C-26), 31.8 (C-8), 31.2 (C-7), 31.4 (C-2), 34.1 (C-25), 37.4 (C-10), 38.3 (C-1), 38.6 (C-23), 39.0 (C-15), 41.1 (C-12), 44.0 (C-4), 44.2 (C-13), 51.0 (C-9), 55.4 (C-14), 58.1 (C-17), 71.7 (C-3), 73.5 (C-16), 75.5 (C-22), 80.2 (C-20), 108.8 (C-28), 121.6 (C-6), 142.6 (C-5), 155.3 (C-24).
1.4 杀虫活性检测
卤虫 [brine shrimp (Artemiasalina)] 杀虫活性模型,样品溶于DMSO或水中取适量加于96孔板上.每空加28 ℃人工海水孵化48 h的卤虫15~25头,并以人工海水分别将样品稀释至100、50、10(μmol/L)、每个浓度重复3次.空白对照为溶解样品所用溶剂.28 ℃下培养24 h后显微镜下观察卤虫死亡个数.
活性用校正死亡率表示:
校正死亡率 (corrected mortality)=(处理组死亡率-对照组死亡率)/(1-对照组死亡率)× 100%.
2 结果与分析
2.1 化合物结构解析
化合物1白色粉末,质谱显示其分子式为C15H26O2;不饱和度为3,碳谱显示化学位移48.3(d)与71.5(d)为2个环内CH,而139.0(s)与125.1(s)信号提示该化合物具有环内双键结构,同时15.8(q)、22.0(q)、28.8(q)3处信号表明该化合物具有3个环外甲基,结合该化合物不饱和度为3,具备杜松烷型倍半萜结构特征,经过进一步分析核磁数据发现该化合物还具备2个羟基(其中1个为羟甲基),1个丙叉基通过查阅文献,其波谱数据与文献[8]对照一致,因此确定其结构为15-羟基-α-杜松醇.
化合物2白色粉末,质谱显示其分子式为C15H26O2;不饱和度为3,通过碳谱数据可以看出与化合物1类似该化合物具有2个角甲基,1个丙叉基,2个羟基,1个双键,但是不同的是,该化合物丙叉基与环内双键中的1个碳原子相连,提示该类化合物很可能是1个愈创木烷型双环倍半萜.通过与已知文献[9]对照,确定该化合物为1S,4S,5S,10R-4,10-愈创木烷二醇.
化合物3分子式 C15H26O2,由 ESI-MS 上的m/z847 [2M + Na]+确定.不饱和度为3,碳谱信号107.8 (s), 146.2 (t)表明该化合物结构中存在1个末端烯键结构,结合不饱和度为3,以及分子中具有丙叉基结构,考虑该化合物为双环体系桉烷型双环倍半萜.波谱数据与文献[10-11]对照一致,因此确定其结构为4(15)-桉叶烯-1β,6β-二醇.
化合物4分子式C15H26O2,由ESI-MS确定.该化合物核磁数据与化合物3相似程度较高,仅1个位置羟基取代基构型不同,碳谱显示该化合物同样具有1个角甲基,1个环外末端双键,1个丙叉基,2个羟基,1个双键.波谱数据与文献[11-12]对照一致,因此确定其结构为4(15)-桉叶烯-1β,6α-二醇.
化合物5分子式C28H46O4,由ESI-MS 上的m/z469 [M + Na]+确定,不饱和度为6,从碳谱信号121.6 (C-6), 142.6 (C-5), 108.8 (C-28), 155.3 (C-24)得出化合物具有2个双键,其中1个为环内双键另1个为末端双键,此外,该化合物具有3个角甲基,基于以上信息,考虑该化合物为1个甾体.核磁波谱数据与文献[13]对照一致,因此确定其结构为3α,16β,20,22-四羟基麦角甾-5,24(28)-二烯.
2.2 化合物杀虫活性
上述化合物均进行了杀虫(A.salina)活性测试(表2).结果表明,化合物2、3、4表现出良好的杀虫活性,提示这类倍半萜在杀虫领域也许具有一定的应用前景.而甾体化合物1和5并未表现出显著的杀虫活性.
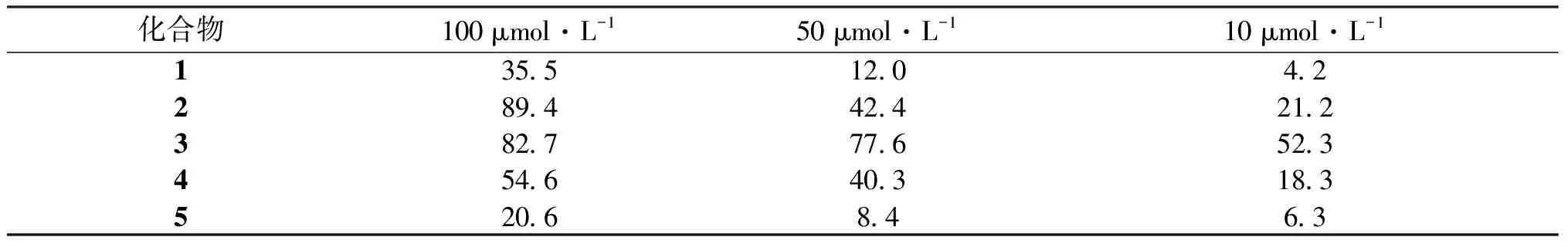
表2 化合物不同浓度下校正死亡率 %
3 结语
通过对山楝进行系统的化学成分研究,成功分离得到4个倍半萜类化合物以及1个甾体化合物,其结构通过核磁共振、质谱等检测手段予以确认,其中化合物1和2为本属首次分离得到.对分离得到的化合物进行了杀虫活性测试,结果表明,倍半萜类化合物2、3以及4表现出良好的杀虫活性,提示这类倍半萜在杀虫领域也许具有一定的应用前景.

