丝棉木果实多糖制备及其体外抑瘤活性
丁 业,张继元,刘楚含,李泽鸿
(1吉林农业大学 生命科学学院,吉林 长春130118;2长春大学 旅游学院,吉林 长春130600)
丝棉木(Euonymusbungeanus)又名白杜、明开夜合、华北卫矛,为卫矛科(Celastraceae)卫矛属(Euonymus)落叶灌木或小乔木[1]。其产地丰富,在我国各省区均有分布,具有观赏价值,是园林、绿地的常用观赏树种。其根、茎、皮、枝、叶、果均可入药[2],在东北地区其果实在中药使用中常替代合欢花[3],性寒,味苦涩,有小毒,能止血、泄热[4],其枝叶可以祛风除湿、活血通络、解毒止血、衄血、消疖疮肿毒[5],具有较大的药用价值和经济价值。
许多研究表明,植物多糖具有提高免疫力[6-7]、抗肿瘤[8]、抑菌[9]、抗病毒[10]等生物活性,但有关丝棉木果实中多糖的提取方法及其抗肿瘤活性却鲜有报道。为此,本试验采用响应面法对丝棉木果实多糖提取工艺进行优化,用结晶紫法检测该多糖体外抗小鼠骨髓瘤活性的IC50,旨在为丝棉木的进一步开发利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材 料 丝棉木果实,采自吉林农业大学植物园;小鼠骨髓瘤细胞(SP2/0细胞)、仓鼠肾细胞(BHK细胞),均由中国人民解放军军事兽医研究所6室惠赠;浓硫酸、苯酚、葡萄糖,购自北京化工厂,均为分析纯;RPMI-1640培养基、双抗,购于普洛麦格(北京)生物技术有限公司;胎牛血清,由上海四季青生物科技有限公司提供。
1.1.2 主要仪器与设备 T6新世纪紫外可见分光光度计,北京普析通用实验仪器有限公司;恒温水浴锅,北京中兴伟业仪器有限公司;JA2003A电子天平,上海精天电子仪器有限公司;AP-01D真空抽滤器,天津奥特赛恩斯仪器有限公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;D-63450二氧化碳培养箱,Heraeus(德国)科技集团;DL-CJ-1ND超净台,北京东联哈尔仪器制造有限公司;COIO-0829倒置显微镜,南京冀飞科技有限公司;F500多功能酶标仪,迪奥生物(上海)公司。
1.2 方 法
1.2.1 多糖标准曲线的绘制 按照文献[11]的方法,以葡萄糖含量为横坐标(X)、OD值为纵坐标(Y)绘制标准曲线,得回归方程为Y=0.009X+0.013 8,R2=0.998 8。
1.2.2 样品预处理 采摘丝棉木果实,阴干,粉碎,过孔径380 μm筛后,用索氏提取器加入4倍体积石油醚提取4 h,然后脱脂并除去小分子杂质和色素等。
1.2.3 多糖提取条件的单因素试验 精确称取经预处理的样品粉末1.000 g,以蒸馏水为提取液,分别进行料(g)液(mL)比、提取温度、提取时间3个单因素试验。
(1)料液比。 称取预处理样品粉末1.000 g共5份,分别以料(g)液(mL)比1∶10,1∶20,1∶30,1∶40和1∶50加入蒸馏水,80 ℃水浴提取1.5 h,考察料液比对多糖得率的影响。
(2)提取温度。 称取预处理样品粉末1.000 g共5份,料液比1∶20,分别在60,70,80,90和100 ℃水浴中提取1.5 h,考察提取温度对多糖得率的影响。
(3)提取时间。 称取预处理样品粉末1.000 g各5份,料液比1∶20,水浴温度80 ℃,分别提取0.5,1.0,1.5,2.0和2.5 h,考察提取时间对多糖得率的影响。
(4)多糖得率的计算。取1 mL提取液,按1.2.1节中的方法测定吸光度,根据回归方程计算得提取液中多糖的质量浓度,再按下式计算提取液中的多糖得率(Y,%):
式中:C为提取液中多糖的质量浓度(μg/mL),V为提取液总体积(mL),W为样品质量(g)。
1.2.4 提取工艺的响应面优化 利用Box-Behnken软件,选取料液比、提取温度、提取时间进行3因素3水平试验设计,试验方案见表1。
1.2.5 粗多糖中蛋白的去除 参照刘晓茵等[12]和谢飞等[13]的方法,将优化工艺提取得到的粗多糖按料液比1∶10用蒸馏水溶解,加入等体积Sevage试剂,充分振摇后,3 000 r/min离心5 min。重复5次,回收水层真空干燥,以去除多糖中的蛋白杂质。
1.2.6 粗多糖中杂质的去除 称取除蛋白的多糖用蒸馏水溶解,上D101大孔树脂柱,以蒸馏水为洗脱液进行洗脱,流速为1.0 mL/min,自动收集器收集[14-15],回收浓缩洗脱液至原体积的1/10,加入无水乙醇至终体积分数为85%,冷藏24 h后3 000 r/min离心5 min,取沉淀真空干燥,获得除去杂质的丝棉木果实多糖,保存备用。
1.3 多糖的理化性质分析
对除蛋白和除杂后的多糖进行DNS反应[16]、考马斯亮蓝反应[17]、间羟基联苯反应[18],鉴别多糖的性质。
1.4 多糖抗肿瘤活性的鉴定
1.4.1 多糖溶液的配制 精确称取纯化的丝棉木果实多糖100 μg,用1 mL PBS溶解,使其质量浓度达100 μg/mL,0.22 μm滤膜除菌备用。
1.4.2 瘤细胞的培养及处理 将SP2/0和BHK细胞分别置于30 mL培养瓶中,加入3 mL RPMI-1640培养基,24 h换1次培养基,72 h传代1次。取生长对数期的BHK细胞,倒掉培养基,用PBS洗涤2次后,加入1.5 mL胰酶;37 ℃、体积分数5% CO2条件下消化3~5 min,观察到细胞变圆后,倒掉胰酶;加入3 mL培养基用无菌胶头滴管吹打成单细胞悬浮液。SP2/0细胞培养至对数期后,用无菌胶头滴管直接吹打成单细胞悬浮液[19-20]。
1.4.3 多糖对瘤细胞形态的影响 将BHK细胞(对照)、SP2/0细胞悬浮液分别铺于96孔细胞培养板(调节密度至2×104个/孔)中,培养2 h待细胞稳定后,分别加入0(对照),20,40,60 μL质量浓度为100 μg/mL的多糖溶液(每组平行加样3孔),用RPIM-1640培养基补足至每孔100 μL,使每孔多糖质量浓度分别为0,20,40,60 μg/mL,37 ℃、体积分数5% CO2条件下培养36 h,用倒置显微镜观察细胞形态[21]。
1.4.4 多糖对瘤细胞的IC50用结晶紫法检测IC50。将生长对数期的单细胞悬液(2×104个/孔)铺在新的96孔板上,培养贴壁后,按倍比稀释方法加入多糖溶液,37 ℃、体积分数5% CO2条件下培养72 h后加入结晶紫试剂,12 min后弃染液加50 μL脱色液,570 nm下用酶标仪检测吸光度[22],计算多糖对肿瘤的抑制率。
抑制率=(对照组细胞平均OD值-待测细胞平均OD值)/对照组细胞平均OD值×100%。
以多糖质量浓度为横坐标、抑制率为纵坐标绘
制曲线,计算IC50。
2 结果与分析
2.1 丝棉木果实多糖提取的单因素试验
2.1.1 料液比 由图1可知,料液比对丝棉木果实多糖得率的影响较大,随着料液比增大,多糖得率不断升高,当料液比为1∶30时达到最高,得率为8.72%,当料液比为1∶40和1∶50时得率又呈下降趋势,所以选取1∶20,1∶30,1∶40为响应面试验的3个水平。
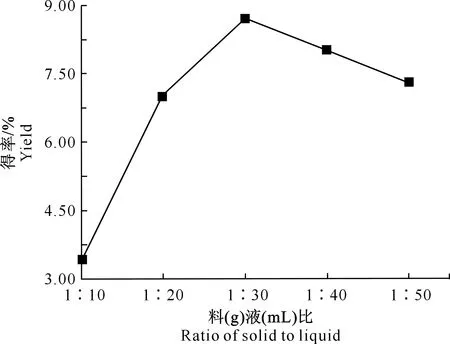
图1 料液比对丝棉木果实多糖得率的影响Fig.1 Effect of liquid to solid ratio on polysaccharides yield from Euonymus bungeanus fruits
2.1.2 提取温度 由图2可知,丝绵木果实多糖得率随提取温度上升而升高,100 ℃时得率最高,为6.44%。由于水浴提取温度最高只能达到100 ℃,所以选择80,90,100 ℃为响应面试验水平。
2.1.3 提取时间 由图3可知,丝棉木果实多糖得率随提取时间的延长而升高,在提取1.5 h达到最高,得率为6.14%,之后随时间推移逐渐下降,提取2.5 h时得率降为5.94%。可见多糖得率与提取时间呈抛物线关联,时间太长得率反而下降,这可能是因为提取时间过长使糖苷键断裂,导致提取含量降低,所以提取时间选1.0,1.5和2.0 h作为后续响应面试验的水平。

图2 温度对丝棉木果实多糖提取率的影响Fig.2 Effect of temperature on polysaccharides yield from Euonymus bungeanus fruits
2.2 丝棉木果实多糖提取工艺的响应面试验优化
2.2.1 响应面试验结果 提取温度、提取时间及料液比对丝棉木果实多糖得率影响的响应面试验结果见表2。
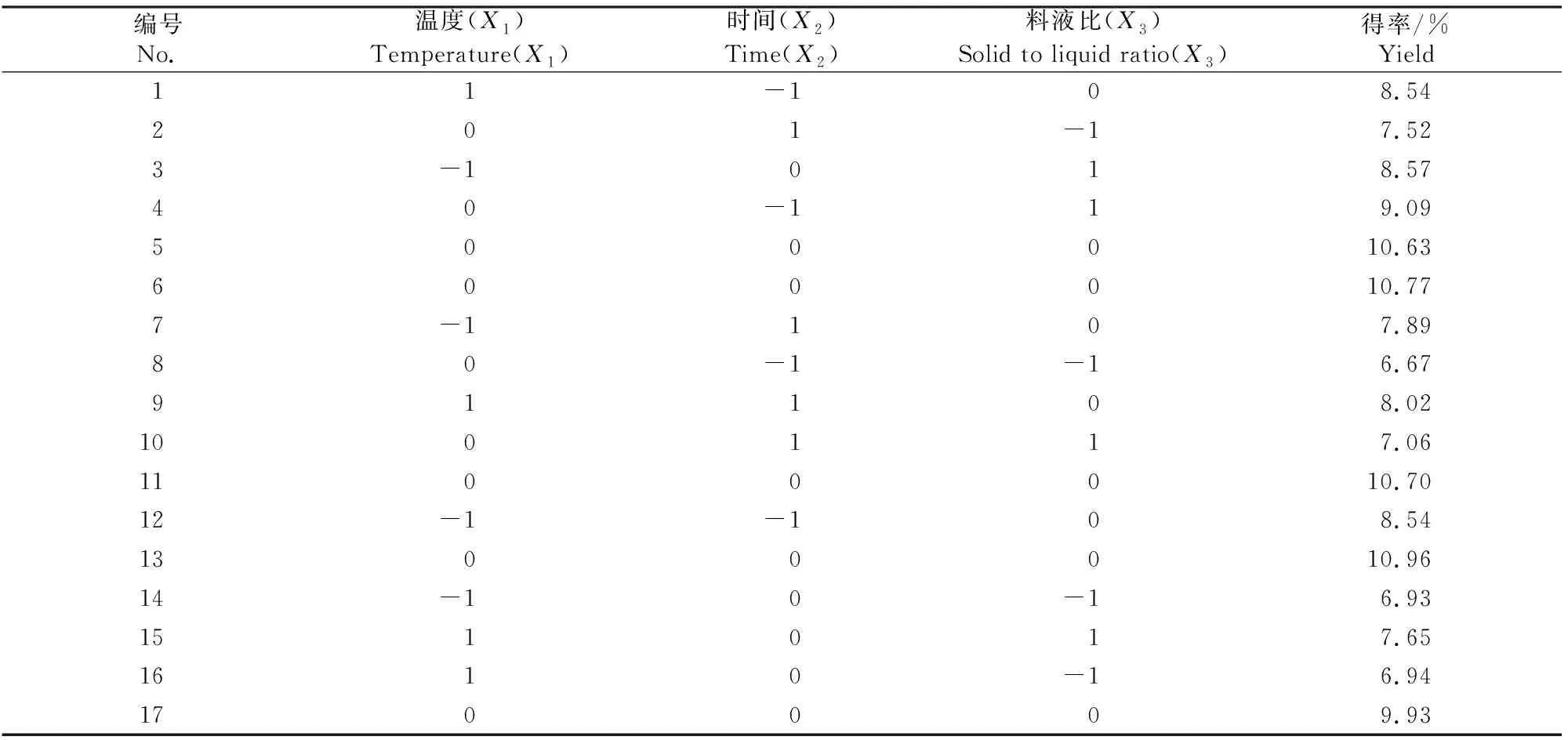
表2 丝棉木果实多糖提取工艺的响应面试验优化Table 2 Optimization of polysaccharides extraction from Euonymus bungeanus fruits by response surface test
2.2.2 数学模型的建立 丝棉木果实多糖得率(Y)对提取温度(X1)、提取时间(X2)、料液比(X3)响应的二次多项回归方程为:

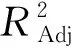
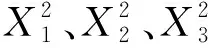
(1)时间与温度的交互作用。 由图4可知,提取温度在80~100 ℃、提取时间在1.0~2.0 h时,丝棉木果实多糖含量呈先升高后降低的趋势。提取时间曲面较提取温度曲面平缓,说明提取时间对丝棉木果实多糖得率影响较为明显。等高线图呈椭圆形,说明提取时间与温度之间有明显的交互作用。

表3 丝棉木果实多糖提取工艺响应面试验结果的方差分析Table 3 Analysis of polysaccharides extraction from Euonymus bungeanus fruits by response surface variance
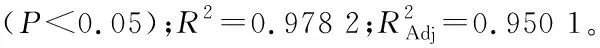
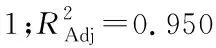
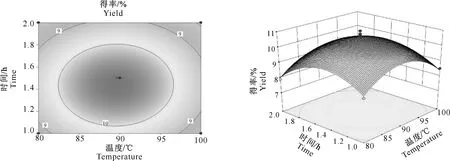
图4 时间与温度对丝棉木果实多糖提取的交互作用Fig.4 Interaction of time and temperature on polysaccharides yield from Euonymus bungeanus fruits
(2)温度与料液比的交互作用。由图5可知,等高线为椭圆形,说明温度与料液比的交互作用对丝棉木果实多糖得率影响显著。料液比曲面比提取温度曲面变化平缓,说明料液比对丝棉木果实多糖得率的影响大于提取温度。

图5 温度与料液比对丝棉木果实多糖得率的交互作用Fig.5 Interaction of temperature and liquid to solid ratio on polysaccharides yield from Euonymus bungeanus fruits
(3)时间与料液比的交互作用。 由图6可知,提取温度为90 ℃,当提取时间在1.0~2.0 h时,丝棉木果实多糖得率呈现先增大后减小的趋势;料液比在1∶20~1∶30时丝棉木果实多糖得率明显增大,而在大于1∶30后变化缓慢。椭圆形等高线说明料液比与提取时间之间的交互作用对得率有显著影响。料液比曲面缓于提取时间曲面,说明料液比对丝棉木果实多糖得率的影响大于提取时间。

图6 料液比与时间对丝棉木果实多糖提取的交互作用Fig.6 Interaction of liquid to solid ratio and time on polysaccharides yield from Euonymus bungeanus fruits
2.2.4 最佳提取工艺的确定 通过响应面回归方程,得到丝棉木果实多糖提取的最佳条件为:料液比1∶31.84,温度89.39 ℃,时间1.41 h。修正后为:料液比1∶30,温度90 ℃,提取时间1.5 h,此条件下多糖得率为10.90%。
2.3 丝棉木果实多糖的纯化及其理化性质
用D101大孔树脂对多糖洗脱后能出现一个很好的单峰,经大孔树脂除杂后,得到纯度达90.23%(质量分数)的多糖,根据绘制的多糖标准曲线计算得洗脱液中多糖质量浓度为320.36 μg/mL,其中还原性糖质量分数为53.71%,蛋白质量分数为0.83%,糖醛酸质量分数为21.32%。
2.4 丝棉木果实多糖的抑瘤活性
2.4.1 对瘤细胞形态的影响 将丝绵木果实多糖提取物作用于BHK细胞、SP2/0细胞36 h后,通过倒置显微镜观察的结果见图7。
图7虽然只展示了60 μg/mL丝棉木果实多糖提取物对BHK细胞和SP2/0细胞的影响,但实际观察中发现,各质量浓度(20,40,60 μg/mL)多糖处理组的SP2/0细胞外形均发生不规则变化,出现细胞死亡后亮泡,且随着多糖质量浓度增大,死亡细胞量增加,面积变大,其中60 μg/mL处理组细胞出现大量死亡,而0 μg/mL处理组细胞形态正常无死亡。各处理组BHK细胞形态无明显变化,初步判定丝棉木果实多糖提取物对SP2/0有一定的抑制作用。
2.4.2 对瘤细胞的IC50丝棉木果实多糖对体外肿瘤细胞SP2/0的抑制结果见图8。由图8可以看出,丝棉木果实多糖对SP2/0细胞有明显的抑制作用,且抑制作用随多糖质量浓度增大而增强,丝棉木果实多糖对SP2/0的IC50为37.753 μg/mL。
3 结 论
本试验结果表明,料液比、提取温度、提取时间对丝棉木果实多糖得率均有显著影响。这3个因素进行Box-Behnken响应面优化得到的最佳工艺条件为:以蒸馏水作为提取剂,料液比1∶30,提取温度90 ℃,提取时间1.5 h,在此条件下,丝棉木果实多糖得率为10.90%。经过D101大孔树脂色谱柱纯化除杂后,得到纯度为90.23%的多糖,其中还原性糖质量分数为53.71%,蛋白质量分数为0.83%,糖醛酸质量分数为21.32%。丝绵木多糖对SP2/0细胞有一定的抑制作用,对SP2/0细胞的IC50为37.753 μg/mL,对正常细胞BHK则无明显作用,说明丝棉木可能含有消除毒素功效的成分,因此可对多糖提取成分进行进一步研究。

