Podocalyxin基因沉默对足细胞结构和功能的影响
胡雪晴 林芙君 吴伟斌 王 瑞 许 娜 王福奔张兆永 王增慧 张 琦 李向阳 华 卉 汤仁仙 任红旗,
足细胞损伤是导致蛋白尿的重要原因[1]。足细胞内系列蛋白分子(如nephrin,podocin,CD2AP,PODXL等)表达变化和(或)分子结构改变均可导致肾小球滤过屏障结构和功能异常[1-2]。PODXL和Nephrin是高度唾液酸化的分子,其唾液酸化被认为是形成和维持足细胞的独特细胞结构的关键[3]。其中,PODXL是顶端细胞表面的主要组成成分,通过电荷排斥作用维持足突间复杂的空间结构[4]。既往研究发现,尿液中可检出PODXL,并用作肾小球疾病的标志物,如IgA肾病和膜性肾病[5],此外,PODXL是局灶节段性肾小球硬化(FSGS)的致病基因,PODXL完全缺乏将导致先天性肾病综合征[6]。ezrin是ezrin-radixin-moesin(ERM)蛋白质家族的成员,PODXL通过NHERF(钠 /氢交换调节因子)结合于ezrin,并通过小GTP酶Rho的活化来维持足突结构[7]。 RhoA是细胞骨架丝束聚合的正调节剂,可磷酸化并激活ezrin,活化的ezrin(即p-ezrin)把PODXL及各种其他质膜蛋白连接到细胞骨架[8]。本文旨在探讨PODXL是否通过影响足细胞骨架排列、促进足细胞凋亡参与足细胞损伤过程,以及探讨PODXL基因表达下调导致足细胞结构和功能的变化的机制。
材料与方法
足细胞培养与分组MPC-5条件永生化小鼠足细胞系由刘志红院士惠赠。小鼠足细胞在含10%胎牛血清(Excell Biology,上海)、100 U/ml青霉素及100 mg/L链霉素(Gibco,美国)、10 U/ml干扰素-γ(IFN-γ)(Sigma,美国)的RPMI 1640培养液中,33 ℃、5%CO2条件下增殖传代。在37 ℃、5%CO2条件下用无IFN-γ的培养基培养10~14d获得分化表型。本实验所有足细胞实验均在分化成熟后进行。细胞分为空白组(Vehicle)、模拟组(Mock)、阴性对照组(Sh-nc)、SiRNA组(Si)、ezrin抑制组(NSC305787);转染时空白组仅加入不完全培养基,模拟组加入转染试剂,阴性对照组加入转染试剂及无义序列,Si组加入转染试剂及siRNA序列(靶序列CCACTACACACAAACCATT)(锐博生物,广州),6h后更换成完全培养基;而ezrin抑制组则加入ezrin抑制剂(10 μmol/L,MCE,美国)。
瞬时转染按照美国Invitrogen公司LipofectamineTMRNAiMAX转染说明书操作。在足细胞汇合度达30%~50%进行转染。将分别配制转染试剂Lipofectamine的无血清培养基和siRNA的无血清稀释液混合,室温静置20 min后加入含有不完全培养基的细胞培养板中,轻轻摇晃混匀。培养6h后更换为完全培养基。转染48~72h后,收集细胞进行实验。
足细胞骨架染色处理过的足细胞爬片,37 ℃ 预热的PBS洗涤3遍后用4%多聚甲醛固定10 min后洗涤;0.5% Triton X-100通透5 min,洗涤5 min×3次;室温避光条件下鬼笔环肽(10 μg/mL,sigma,美国)孵育40 min,洗涤,甘油封片,共聚焦荧光倒置显微镜(Olympus,日本)扫描采集图像。
划痕愈合实验检测细胞的迁移能力各组细胞转染48h后用200 μl的枪头对12孔板中的细胞进行划痕,并于培养箱中继续培养。分别于划痕后0h、24h在观察并记录细胞迁移情况。用 Image-Pro Plus 6.0软件检测各时间点细胞未覆盖的面积。每组细胞实验3个样本,重复3次。
划痕愈合率=1-(各时间点划痕面积/开始的划痕面积×100%)
Transwell实验检测细胞的迁移能力收集转染后48h的各组细胞,用不完全培养基重悬细胞至1×105/ml,采用含孔径8.0 μm聚碳酸酯膜的transwell小室(24孔),在上室中加入200 μl足细胞悬液,下室中加入600 μl 完全培养基。在培养箱培养24h后取出小室,棉签擦去小室膜上部的细胞,用4%多聚甲醛固定15 min后,结晶紫染色。400倍光镜下随机选择5个视野计数穿膜细胞数,取平均值,作为穿过聚碳酸酯膜的细胞数量。
流式细胞仪检测细胞凋亡按照美国BD公司Annexin V PE/7-AAD细胞凋亡检测试剂盒说明书操作。预冷PBS洗涤2遍后收集各组细胞,用 1×Binding Buffer重悬细胞至1×106/ml,各组取100 μl细胞悬液加入PE Annexin、7AAD避光常温孵育15 min,在1h内用流式细胞仪检测细胞凋亡。
蛋白免疫印迹取细胞蛋白测蛋白浓度,加蛋白上样缓冲液煮沸;每孔上样80 μg经电泳分离、转膜、5%脱脂奶粉室温封闭,TBST洗膜,一抗(PODXL 1∶ 1 000,Novus),(p-ezrin 1∶ 800,Sigma),(ezrin 1∶ 1 500,Abcam),(β-actin1∶ 1 000,碧云天),4 ℃摇床孵育过夜,TBST洗膜,二抗(1∶ 5 000 Santa Cruz)室温孵育2h,TBST洗膜,滴加超敏ECL发光液显影,Image J 软件分析各组蛋白表达。
足细胞RhoA活性测定按照美国Cytoskeleton公司G-LISA试剂盒说明方法操作,用酶标仪在490 nm处测定各组吸光度值,读数三次,计算平均值。
实时荧光定量PCR(RT-qPCR) 提取RNA后测定RNA的纯度和浓度,反转录RNA。按照SYBR Green PCR试剂盒说明书操作检测目的基因表达。引物序列如下表1。

表1 PODXL、Ezrin、β-actin引物序列
统计学方法采用SPSS 16.0软件对实验数据进行统计学分析,计量资料用均数±标准差表示。多组间比较,若方差齐用单因素方差分析,方差不齐则采用秩和检验,P<0.05为差异有统计学意义。
结 果
足细胞骨架结构的变化Vehicle组足细胞骨架肌纤维排列有序、肌丝强劲有力、密度大,荧光显示清晰;Si组、ezrin抑制组足细胞微丝解聚、胞体回缩,骨架排列紊乱,荧光明显模糊减弱;Mock及Sh-nc组与Vehicle组无明显差异。
划痕愈合实验检测细胞的迁移能力PODXL沉默组、ezrin抑制组足细胞的划痕愈合速度显著慢于其他三组(P<0.05)(图1),表明沉默PODXL或抑制ezrin磷酸化可抑制足细胞的迁移能力。

图1 细胞划痕愈合实验结果(倒置相差显微镜,×100)Vehicle:空白组、Mock:模拟组、Sh-nc:阴性对照组、Si:SiRNA组、NSC305787:ezrin抑制组;a:与Si组比较,P<0.05;b:与NSC305787组比较,P<0.05
Transwell实验检测细胞的迁移能力PODXL沉默组、ezrin抑制组的足细胞透过 Transwell 小孔的细胞数量明显少于空白组,Mock及Sh-nc组与空白组无差异,表明PODXL表达量或p-ezrin表达量与足细胞的迁移能力呈正相关关系。
细胞凋亡检测Annexin V PE/7AAD双染检测细胞凋亡情况,结果显示与其他三组相比,Si组、ezrin抑制组凋亡率增加(P<0.05)(图2),提示沉默PODXL、抑制ezrin磷酸化会诱导足细胞凋亡。

图2 流式细胞检测各组足细胞凋亡水平Vehicle:空白组、Mock:模拟组、Sh-nc:阴性对照组、Si:SiRNA组、NSC305787:ezrin抑制组;a:与Si组比较,P<0.05;b:与NSC305787组比较,P<0.05
PODXL、p-ezrin、ezrin蛋白表达Western Blot结果显示,与Vehicle组相比,Si组PODXL蛋白表达明显下调,且PODXL敲低后p-ezrin蛋白表达下调,Mock及Sh-nc组与Vehicle组无明显差异;但各组间总ezrin表达量无统计学差异(图3);ezrin抑制组p-ezrin蛋白表达较vehicle组下调(P<0.05)。

图3 足细胞PODXL、p-ezrin、ezrin的蛋白表达Vehicle:空白组、Mock:模拟组、Sh-nc:阴性对照组、Si:SiRNA组、NSC305787:ezrin抑制组;A-C:敲低PODXL后p-ezrin、ezrin蛋白表达的改变;D、E:ezrin抑制剂对p-ezrin、ezrin蛋白表达的影响;a:与Si组比较,P<0.05;b:与NSC305787组比较,P<0.05
RhoA活性检测与Vehicle组比较,Si组、ezrin抑制组足细胞RhoA活性明显降低;Mock及Sh-nc组与Vehicle组无明显差异(图4)。
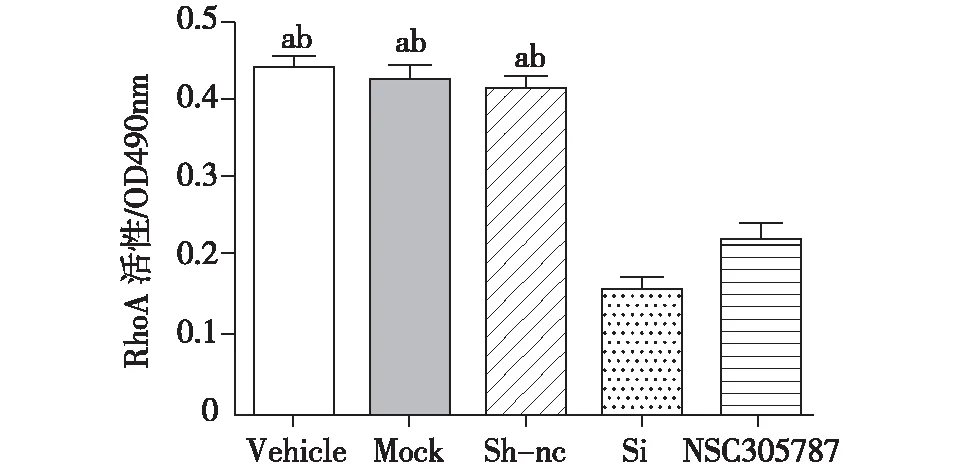
图4 各组小鼠足细胞RhoA活性Vehicle:空白组、Mock:模拟组、Sh-nc:阴性对照组、Si:SiRNA组、:NSC305787:ezrin抑制组;OD值:吸光光度值;a:与Si组比较,P<0.05;b:与NSC305787组比较,P<0.05
PODXL和ezrin的mRNA表达与其他组比较,Si组PODXL mRNA表达明显下调,PODXL敲低或抑制ezrin磷酸化后各组ezrin mRNA表达无明显差异(图5)。

图5 各组足细胞PODXL、ezrin的mRNA表达Vehicle:空白组、Mock:模拟组、Sh-nc:阴性对照组、Si:SiRNA组、NSC305787:ezrin抑制组;a:与Si组比较,P<0.05;b:与NSC305787组比较,P<0.05
讨 论
足细胞是排列在肾小球毛细血管外的终末分化细胞,作为肾小球滤过屏障的重要组成部分,几乎所有的肾小球疾病的蛋白尿均与足细胞损伤有关[1-2]。足细胞上膜蛋白牢固地锚定于肌动蛋白细胞骨架,从而为细胞膜提供结构支持,确定细胞形状,并创建独特的膜结构域和微区。PODXL是足细胞中锚定于肌动蛋白的关键顶膜蛋白,对维持足突特征和裂孔隔膜是结构必不可少的。其具有多种功能,包括控制细胞粘附和迁移等[9-10]。在与足细胞相关的肾小球疾病中,通常广泛存在足细胞的细胞骨架重排和PODXL低表达[11-13],但具体机制尚不清晰。
本研究探讨了PODXL对足细胞骨架肌丝排列和细胞凋亡的影响,结果显示,敲低足细胞PODXL基因表达后,足细胞骨架排列紊乱,迁移能力下降,细胞凋亡增加。我们研究进一步证明PODXL在维持足细胞骨架稳定性过程中起着重要作用。PODXL敲低后导致足细胞活动力降低的直接原因是该分子参与了细胞骨架肌丝排列,当PODXL基因表达下调后,导致细胞迁移能力下降,细胞凋亡增加。
PODXL敲低后足细胞骨架结构紊乱、迁移能力下降的机制目前尚不清楚。文献报道PODXL通过NHERF和ezrin与肌动蛋白连接,形成维持正常足突结构的PODXL/NHERF/ezrin/actin复合物,并且这些复合物在肾病的实验模型中结构发生改变[14-16],因而我们推测PODXL敲低后可能通过改变PODXL/NHERF/ezrin/actin复合物结构影响ezrin磷酸化,从而引起足细胞骨架结构紊乱、迁移能力下降、细胞凋亡增加。
ezrin是ERM蛋白家族的成员,主要表达于上皮组织(包括肾脏和胃肠组织),并在其中起着不同的生理功能[13,17-18]。ezrin不仅作为跨膜蛋白的支架,而且可以作为小GTP酶Rho的调节剂。ezrin能够与Rho GDP解离抑制剂(Rho-GDI)相互作用,并通过促进Rho-GDI 与GDP结合的Rho-GTP酶的解离来间接活化Rho-GTP酶。Rho-GTP酶包括RhoA,Cdc42和Rac1,在细胞骨架重组调控中起重要作用[19-20]。Fukasawa等[21]研究表明PODXL在Ser415处的磷酸化防止了PODXL与ezrin的直接结合,影响RhoA活性,并且干扰PODXL锚定到细胞骨架。Wasik等[22]通过敲低足细胞上的ezrin,发现p-ezrin表达下调后细胞肌丝断裂、细胞骨架重排。我们研究发现在敲低足细胞PODXL基因后, p-ezrin表达下调,RhoA活性降低,而总ezrin表达无明显改变;通过ezrin抑制剂抑制p-ezrin表达后,RhoA活性降低、细胞骨架微丝解聚、迁移减慢、凋亡增加;提示PODXL可能通过p-ezrin、RhoA通路引起足细胞骨架结构紊乱;导致细胞迁移能力下降,细胞凋亡增加。
F-actin的解聚是凋亡过程中所必需的,其解聚出现在凋亡小体形成之前。既往研究发现,细胞凋亡过程中,细胞骨架重排导致凋亡细胞形态发生改变,微丝及中间丝迅速解聚,微管结构重组,形成凋亡微管网,维持凋亡细胞形态,并与凋亡微丝共同包裹细胞器形成凋亡小体[23]。我们通过敲低PODXL发现p-ezrin、RhoA表达下调,引起足细胞骨架结构紊乱;因而我们推测细胞骨架结构重排导致细胞凋亡增加。
本研究尚存在一些不足,尽管我们在体外证实了PODXL基因敲低对足细胞骨架排列和细胞凋亡产生了影响,并且发现PODXL引起的足细胞骨架肌丝排列紊乱可能通过p-ezrin信号通路;然而,由于PODXL主要参与形成电荷屏障,敲低PODXL后是否对毛细血管通透性产生影响目前尚未明确;此外,本研究仅研究了p-ezrin、RhoA信号通路,至于PODXL对其他信号通路是否产生影响,亦需进一步研究以明确。最后,由于本研究为体外实验,尚需动物实验进一步明确。
小结:PODXL是维持足细胞骨架稳定性的重要条件, 敲低PODXL基因或使用Ezrin抑制剂抑制ezrin磷酸化后,p-ezrin表达下调、RhoA活性降低,导致足细胞骨架结构紊乱、促进足细胞凋亡。从而说明PODXL基因敲低后引起足细胞损伤可能与p-ezrin、RhoA信号通路有关。

