艾灸对胃荷瘤大鼠瘤体增长的抑制作用*
谭 静,阳仁达,赵 欢,彭卓隽,欧阳里知,林亚平
(湖南中医药大学针灸推拿学院 长沙 410208)
胃癌(gastric carcinoma)是指源于胃粘膜上皮细胞的恶性肿瘤,常以上腹部不适、疼痛、呕吐等为主要症状。据国际癌症研究机构最新统计,胃癌的发病率、死亡率分别位于恶性肿瘤的第5 位、第3 位,70%以上的新发病例集中在中国在内的发展中国家[1]。因此,胃癌的防治工作仍然是我国亟待解决的公共卫生问题。目前胃癌的治疗已形成手术、放化疗为主,免疫治疗、热疗为辅的治疗模式。近年来,随着科学技术的发展,传统医学的科学内涵不断被揭示。艾灸作为中医学的重要组成,通过综合热效应激活体内经络系统诱导各种复杂的反馈响应,实现对疾病的防治,素有“保命之法,灼艾第一”的美誉。研究表明,艾灸已积极运用于各类恶性肿瘤患者生存质量的控制管理中[2-4]。我们的前期研究表明[5]:艾灸后,胃荷瘤大鼠外周血中的自然杀伤细胞、自然杀伤性T 细胞均被激活。但艾灸对瘤体生长的抑制作用尚不明确,为此,进行了以下探索。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠6 只,雄性,160-180 g,用于瘤组织制备;SPF 级SD 大鼠50 只,雌雄各半,200-240 g,用于分组实验。上述动物购自中国食品药品检定研究院动物中心,动物生产许可证号为SCXK(京)2014-0013,动物使用许可证号为SYXK(京)2014-0003。实验在中国医学科学院肿瘤医院动物SPF级动物实验中心完成。饲养环境为12 h 昼夜节律交替,室温25 ±5℃,相对湿度50%-70%,适应性饲养1 周。整个实验过程中对动物的处理均遵照、符合有关的伦理学规定。
1.2 主要试剂及仪器
Walker-256 细胞(中国医学科学院肿瘤医院馈赠);PCNA 抗体(美国BOSTER);TUNEL 试剂盒(江苏凯基);直径0.7 cm 艾条(长沙艾医生物);戊巴比妥钠(上海化学试剂厂);6002B型红外线治疗仪(徐州天飞有限公司);数显表面测温仪(浙江波仕欧);数显游标卡尺(500-151-30,日本三丰);切片机(RM2016,上海徕卡);摊片机(KD-P,浙江科迪);脱水机(JJ-12J,武汉俊杰);包埋机(JB-P5,武汉俊杰);鼓风干燥箱(DHG-9053A,上海一恒);电热恒温培养箱(DHP-9162,上海一恒);显微镜(DM500,德国Leica)。
1.3 模型建立方法
参考文献[6,7],模型建立主要包括腹水瘤制备、皮下瘤组织制备、手术移植三个过程。腹水瘤制备:将3只体重160-180 g 大鼠分别腹腔注射0.3 mL Walker-256细胞的悬液(2×107个·mL-1)。皮下实体瘤组织制备:腹腔注射7 d 后,待明显腹水时处死动物,收集腹水中Walker-256 细胞,调整至0.5 × 107个·mL-1,皮下注射于3 只160-180 g 的大鼠右前、右后肢,每个部位0.2 mL。手术移植:皮下注射7 d 后,待注射处形成大小约1.5 × 1.5 × 1 cm3的皮下实体瘤后,处死动物,切开瘤体,取大小约0.8 × 0.8 × 0.5 cm3新鲜鱼肉样瘤组织通过手术移植于体质量200-240 g 大鼠胃大弯皮区、腺区交界处的胃壁上。7 d后剖腹探查判断造模是否成功。模型成功标准:原种移植处形成体积0.5 cm3以上的瘤体,表面光滑,边界清晰,无粘连及脏器侵犯,组织学证实与皮下实体瘤同源(图1)。
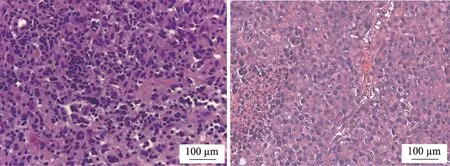
图1 皮下实体瘤(左)、胃部瘤体(右)HE染色观察(×400倍)
1.4 实验分组及治疗
分组方法:实验分为空白组、假手术组、模型组、艾灸组及红外组5 组。采用随机数字表进行随机编号。手术模拟皮下实体瘤组织胃壁移植过程,成功后,随机分入假手术组;通过1.3 中所述方法制备胃荷瘤动物模型,成功后,随机分入模型组、艾灸组及红外组。每组动物10只,雌雄各半,共计50只动物。
治疗方法:造模成功的第2 d,艾灸组参考《实验针灸学》[8]中有关大鼠穴位定位方法,仰卧位固定施灸中脘、关元、足三里(双),隔日俯卧位固定施灸脾俞(双)、胃俞(双)。施灸时,将直径为7 mm 艾条固定在自制艾灸架上于穴位垂直上方点燃。利用表面测温仪实时监测表皮温度,适时去除艾灰、调整施灸高度,确保表皮温度持续在42±1℃之间。每次施灸20 min,1 日1 次,连续21 d。红外组于造模成功后第2 d,使用波长0.4-3 μm.的短波红外线照射,强度1 档、输出功率10W、光斑直径3 cm,隔日交替照射胃脘部及背部T11 至T13 区域,治疗时温度的控制及要求、治疗时间、频次、疗程同艾灸组。空白、假手术、模型组动物在同一时间段,隔日仰卧、俯卧交替捆绑束缚。
1.5 观察指标及检测方法
1.5.1 生存状态积分评定
正常大鼠,活动自如,毛色光亮(5 分);呼吸平稳,对外界刺激反应较敏锐,能站立行走,但步态较缓慢,毛色较光亮(4 分);意识清醒,但不能四肢站立行走,可自主爬行,部分鼠毛脱落,毛质较粗糙、发黄(3分);嗜睡,反应迟钝、呼吸较急促、浅快,呼吸动度可,较多鼠毛脱落,毛质较粗糙、背毛耸立明显(2分);昏迷、静卧不动,只有微弱的腹式呼吸运动(浅慢),或明显节律紊乱、对外界刺激无明显反应,或极度迟钝、被毛耸立(1分);死亡(0分)。
1.5.2 肿瘤生长抑制率
动物处死后,无菌环境下剖开腹腔,手术线结扎大鼠幽门部和贲门部,在两结扎线之间剪下全胃,PBS溶液轻柔冲洗,无菌纱布吸干多余水分后将胃平摊于定型滤纸,暴露肿瘤部位,用电子游标卡尺测量胃部瘤体的最长径(a),最小径(b),根据公式V =(π/6)×[(a+b)/2]³,计算出肿瘤的体积。另可根据以下公式,计算肿瘤生长抑制率。

1.5.3 肿瘤组织形态学观察
取肿瘤组织,4%低聚甲醛固定、脱水、石蜡包埋、切片。苏木精-伊红(HE)染色,普通光镜下观察肿瘤组织坏死,血管等情况。
1.5.4 免疫组化法检测PCNA的表达
具体操作严格按试剂盒说明的要求进行,石蜡切片用微波修复抗原。PCNA 一抗稀释度1∶50,DAB 显色,苏木精复染。PCNA 阳性细胞胞核呈棕黄色。采用北航医学图像分析系统于400倍镜下采集各组肿瘤组织内3个视野的图像,分析其阳性目标数密度。
1.5.5 TUNEL 法检测肿瘤细胞凋亡
按照试剂盒说明进行对标本的固定、封闭、阳性制片、连接、标记、显色、复染操作。制片后,在光学显微镜下观察拍照。凋亡细胞的阳性反应物质位于细胞核内,颜色为棕黄色。采用北航医学图像分析系统于400 倍镜下采集每个样本3 个视野的图像,分析记录阳性细胞数密度。
1.6 统计学处理方法
所有数据使用SPSS 20.0软件进行处理,计量资料以均数±标准差(±s)表示。所有数据资料进行正态性检验和方差齐性检验。满足正态性时,多组间比较采用单因素方差分析,若方差齐时用LSD 法检验,不齐时用Dunnett T3 法检验。不满足正态性时,采用秩和检验。以P<0.05定义差异有统计学意义。
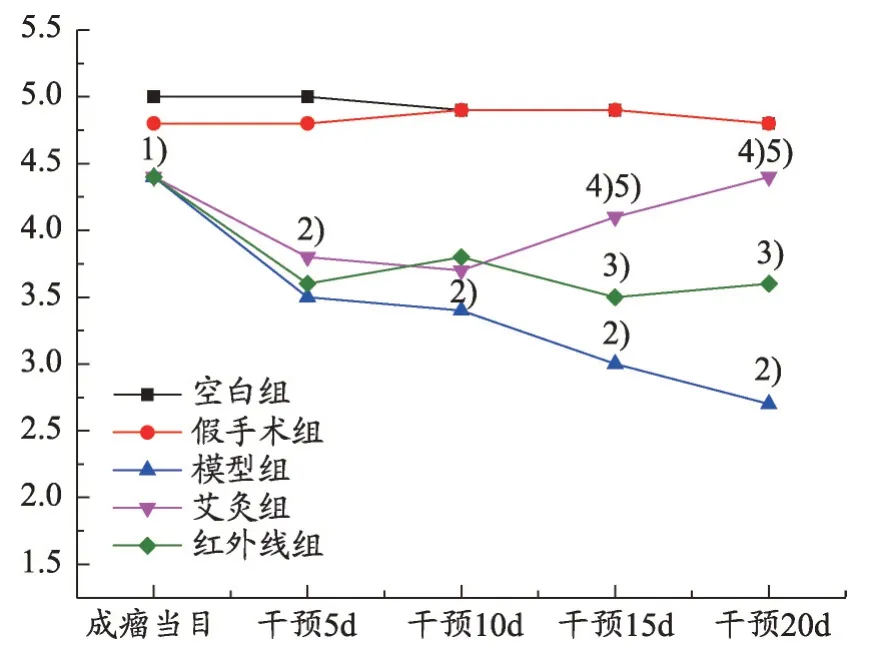
图2 各组大鼠大鼠生存状态积分比较()
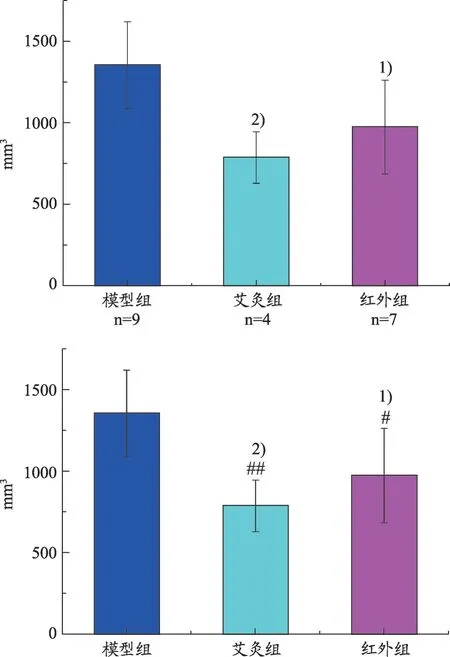
图3 各组大鼠胃瘤体体积比较(±s)
2 结果
2.1 艾灸对荷瘤大鼠生存状态的影响
在观察时间内,各组均未见动物死亡。由图2 可知:与空白组比较,模型组成模后第5 d 起生存状态持续变差(P<0.01);干预15 d 后,与模型组比较,艾灸组、红外组动物生存状态改善,积分值增加(P<0.01,P<0.05),且艾灸组动物的状态优于红外组(P<0.05);干预20 d 后,艾灸组动物的生存状态积分与空白组比较已无差异(P>0.05)。
2.2 艾灸对荷瘤大鼠肿瘤体积及转移的影响
干预期间内无动物死亡。干预结束处死动物、开腹探查后发现模型组、艾灸组、红外组均有瘤体破溃消失,其中模型组1只,艾灸组6只、红外组3只。如图3所示,剩余动物瘤体体积组间出现差异,表现为艾灸组、红外组瘤体体积明显小于模型组(P<0.01,P<0.05),但艾灸、红外组组间无差异(P>0.05)。经计算,艾灸组、红外组的肿瘤生长抑制率分别为41.89%、28.09%。另外,各组均有肿瘤细胞转移,其中模型组4例,艾灸组1 例、红外组6 例,转移部位以腹水及脾脏最多(表1)。
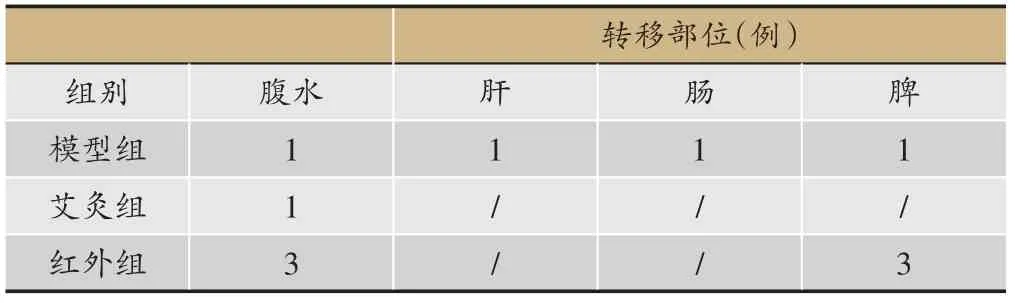
表1 各组肿瘤细胞转移情况
2.3 艾灸对荷瘤大鼠瘤体形态学观察(HE)
如图4所示,模型组瘤体内出现大量增生的血管,血管壁较厚,较少有坏死灶;艾灸组瘤体内出现大量坏死灶,血管较少;红外组瘤体内尽管出现了一定量坏死灶,但也有大量血管增生,且血管壁较薄。
2.4 艾灸对荷瘤大鼠肿瘤细胞增殖的影响
如图5-图6 所示,模型组内肿瘤细胞PCNA 呈强阳性表达,艾灸组内呈弱阳性表达,红外组内呈较强阳性表达。与模型组比较,艾灸组、红外组阳性细胞数密度明显减少(P<0.01,P<0.05),其中,艾灸组比红外组减少更明显(P<0.05)。

图4 各组肿瘤组织形态学×400倍
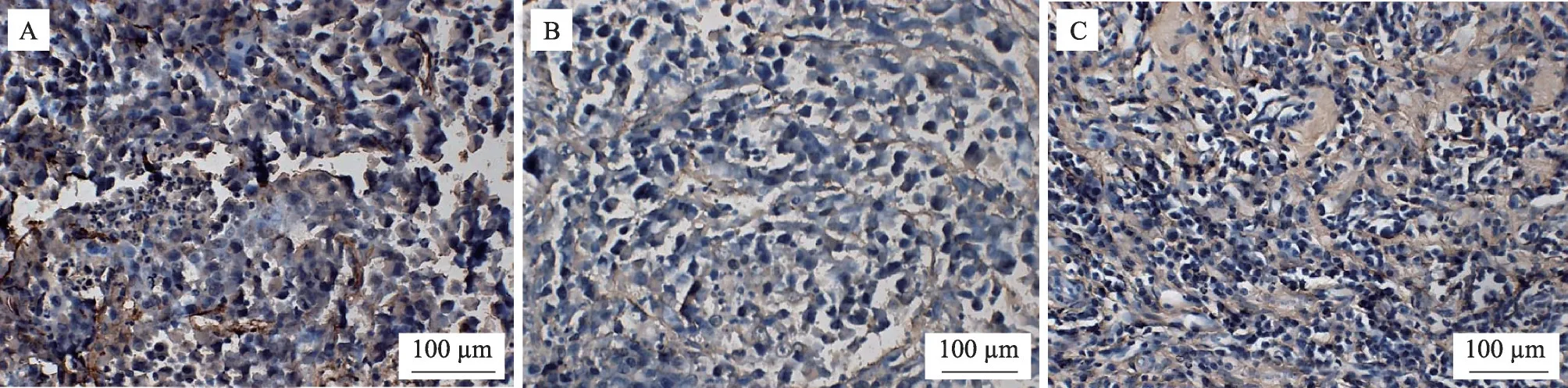
图5 PCNA法检测各组肿瘤细胞增殖×400倍
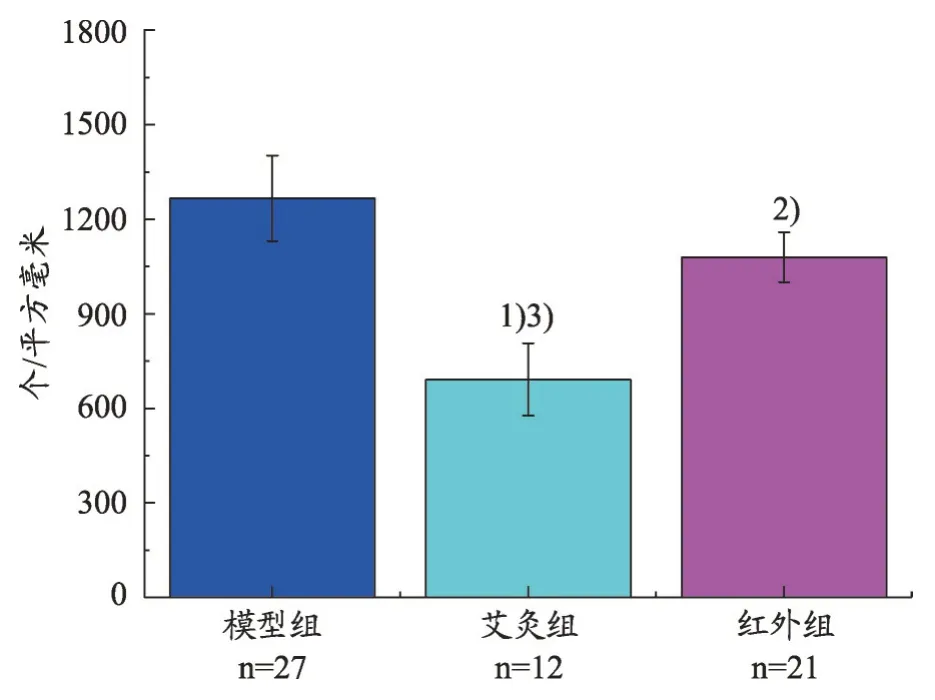
图6 PCNA法检测各组每平方毫米内阳性细胞数密度(±s)
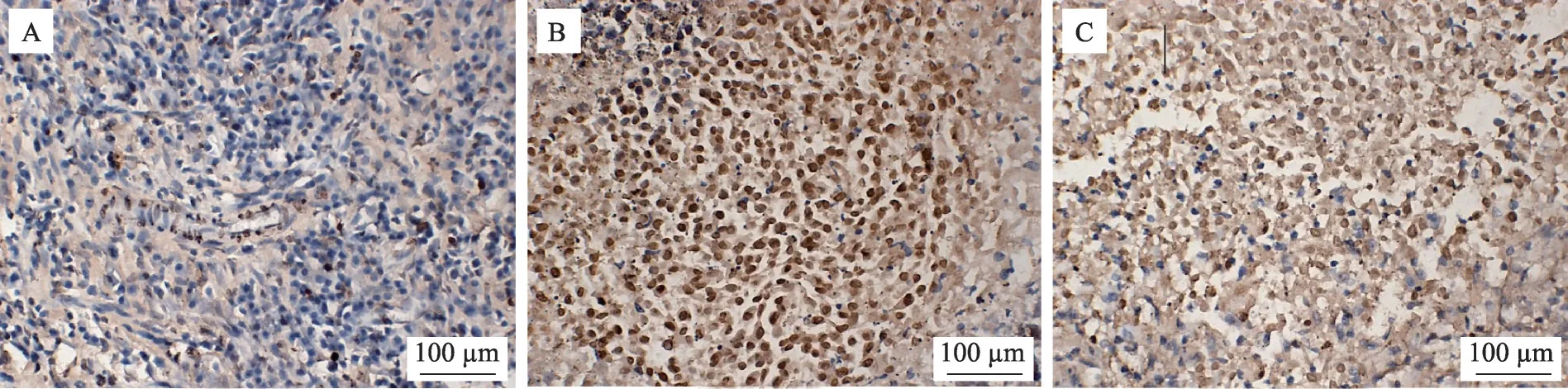
图7 Tuenl法检测各组肿瘤细胞凋亡×400倍

图8 TUENL法检测各组每平方毫米内阳性细胞数密度(±s)
2.5 艾灸对荷瘤大鼠肿瘤细胞凋亡的影响
如图7-图8所示,Tunel法测定模型组瘤体内呈弱阳性表达,艾灸组内呈强阳性表达,红外组内呈较强阳性表达。与模型组比较,艾灸组、红外组阳性细胞数密度明显增加(P<0.01,P<0.05),其中,艾灸组比红外组增加更明显(P<0.05)。
3 讨论
恶性肿瘤是威胁人类健康及社会经济发展的重大公共健康问题。尽管其诊断已相对成熟,但其治疗效果仍不理想,复发、病死率居高不下。手术、放化疗作为常规抗瘤方法,其弊端日益凸显:①非所有恶性肿瘤都符合手术指征;②放化疗带来副作用严重降低了患者的生存质量,削弱了治疗的依从性。由于肿瘤组织内血管丰富,较正常组织更易吸收能量而升温。研究表明[9-10],肿瘤组织内温度升高至40℃以上后,细胞膜的流动性及通透性增加,酶失活、代谢抑制、DNA合成受阻,肿瘤细胞将程序化死亡;另外,升温将加剧血管内瘀阻,导致血管破裂、瘤体破溃;再者,热刺激介导热应激反应,促进热休克蛋白等物质合成释放,,促进抗体、抗原结合,阻止抗原抗体复合物脱落,激活T 淋巴细胞、巨噬细胞等,提高对肿瘤细胞的免疫杀伤[11,12]。基于此,临床多采用红外线、高频电磁波等对全身或局部加热以抗肿瘤。目前,热疗已成为临床第五大抗肿瘤疗法[13]。
艾灸作为中国传统疗法的重要组成,几千年来为保障民生健康做出了重要贡献。古人曾用“保命之法,灼艾第一”、“药之不及,针之不到,必须灸之”高度赞扬了艾灸对重症治疗的重要意义。中医认为,艾灸的温补、温通作用能有效针对肿瘤的“虚”、“寒”、“痰”、“瘀”、“毒”进行治疗。目前,艾灸已广泛应用于肿瘤患者各项症状的控制与管理当中,主要体现在减少放化疗的副作用,增加摄食及免疫力,调节情绪等方面[14-16],对艾灸直接的肿瘤抑制作用观察较少。现代医学认为,艾灸主要通过灸热刺激,兴奋穴位中的感受器,其介导的复杂中枢响应,诱发对神经、内分泌、免疫等多个系统对综合调节。与单一的红外线照射治疗相比,艾灸释放出波长600 nm 左右的红光、2 500 nm 的中长波红外线等综合光线,穿透深度可达皮下1 cm 以上的深层组织,为机体的细胞代谢活动和免疫功能提供必要的能量[17-19]。由于艾灸时光线的谱形、强度、峰值在整个施治过程中都在一定范围内不断变化,很好地避免了温度感受器的耐受[17]。本实验中采用悬灸(温和灸)进行治疗,这是临床艾灸最常使用的施灸方法。施灸时,控制表皮温度在42℃左右,动物肛温在灸后8 min 时上升至40℃并稳定。这种温度既不会灼伤表皮,也能诱导热应激反应产生。施灸过程中,荷瘤动物确无明显的挣扎、撕叫等其他应激反应。
穴位的选择是确保艾灸疗效的关键因素之一。本研究中,通过详细研究胃癌发生的病因病机,确定扶正固本、温通经络、散瘀消滞为主要治则,结合对现有胃癌临床治疗针灸选穴规律的数字挖掘,确定施灸穴位为脾俞、胃俞、中脘、关元、足三里。选穴局部取穴、远端取穴结合辩证取穴,局部以胃募穴——中脘以理气行滞,健脾和胃,提高荷瘤部位温度;远端以胃之下合穴——足三里健脾益气、祛湿化痰,增强机体免疫力。选穴抓住“以虚为本”的主要病机,施灸关元以温肾阳、壮真火,补元气之根;施灸脾俞、胃俞补脏腑之气,调和阴阳之气机升降,促进纳运。前后穴位交替施灸保证了穴位对灸热刺激的敏感。实验过程中,我们发现造模后,荷瘤动物食量、体质量、活动量显著下降,大便稀,体现出中医“阳虚”、“气虚”之证。施灸后,瘤鼠上述异常得以改善。前期研究我们发现,艾灸能激活瘤鼠体内自然杀伤细胞、T 淋巴细胞,诱导大量热应激相关蛋白的表达,但对肿瘤的抑制作用没有详细观察。本研究结果证实艾灸能一定程度减少肿瘤细胞的增殖,促进其凋亡,瘤组织坏死灶增加、血管生成减少,瘤体增长被抑制。这些提示艾灸或具有直接抗癌作用,但是否与前期研究有关,具体机制如何均具有待进一步研究。

