IDH1 R132H、HIF-1α及VEGF在脑胶质瘤中的表达及与临床病理特征的关系
于佳龙,黄南渠,施尚鹏,李 航,刘华庆,罗 勇
(1.遵义医学院第三附属医院 急诊科,贵州 遵义 563000;2.遵义医学院第三附属医院 药物临床试验机构,贵州,遵义 563000;3.遵义医学院第三附属医院 神经外科,贵州 遵义 563000;4.遵义医学院附属医院 病理科,贵州 遵义 563099;5.遵义医学院第三附属医院 神经内科,贵州 遵义 563000)
胶质瘤是最常见的颅内恶性肿瘤,起源于神经胶质细胞,约占原发性脑肿瘤的60%以上,据统计,中国脑胶质瘤年发病率为3~6人/10万人,年死亡人数达3万人[1-2],脑胶质瘤传统上被世界卫生组织(World Health Organization,WHO)按恶性程度划分为4个等级,表示为I至IV,其中I、II型为低级别脑胶质瘤,III、IV型为高级别脑胶质瘤[3]。因其发病机制复杂,而现有的手术及替莫唑胺等药物辅助治疗效果欠佳[4],因此对脑胶质瘤的发病机制及进一步治疗方案的研究成为重点。
近年来,随着基因组学的蓬勃发展,脑胶质瘤的诸多分子标志物相继被发现,有研究显示异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)突变与脑胶质瘤的发生发展关系较为密切。Parsons等2008年在胶质母细胞瘤的外显子组测序中发现超过20%的肿瘤样本中发现了IDH1基因在第132位的精氨酸(R)转换为组氨酸(H),随着对IDH的深入研究,Hartmann等在2009年发现IDH1 R132H基因突变为脑胶质瘤中的最常见的基因突变[5-6],学者在恶性肿瘤的癌前病变中发现缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)的过度表达,其中乳腺癌中最为明显[7]。秦华平等[8]通过用SABC免疫组化法证明HIF-1α蛋白在胶质瘤中明显表达。相关实验结果表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)为脑胶质瘤血管生成的重要环节,且脑胶质瘤中的VEGF均高表达(正常脑组织几乎不表达),参与着脑胶质瘤的血管生成及侵袭过程[9-10]。目前仅偶见有关于三者在脑胶质瘤中的表达及相关机制的研究。因此,本研究拟选取51例脑胶质瘤患者石蜡切片及10例非胶质瘤正常脑组织的存档石蜡切片,通过免疫组织化学法检测IDH1 R132H、HIF-1α及VEGF的表达,研究三者的表达情况及与临床病理特征之间的关系。
1 材料与方法
1.1 标本来源 选取2007年1月~2017年12月遵义市第一人民医院、遵义医学院附属医院、贵州航天医院3家医院的51例脑胶质瘤手术切除标本的石蜡切片及10例正常脑组织切片(交通事故尸体解剖后保留的脑组织),每个组织切4张切片。所有病理切片经HE染色后重新按照脑胶质瘤2016 WHO分级标准进行分级[3]。其中I级13例,II级17例,III级14例,IV级7例。患者术前均未行放化疗治疗,且均为首发病例。男性26例,女性25例。年龄分组[11]:<45岁(青年组)28例,45~59岁(中年组)14例,≥60岁(老年组)9例。肿瘤部位:额叶14例,颞叶13例,枕叶6例,顶叶5例,其他部位13例。
1.2 实验试剂 即用型一抗:兔抗人HIF-1α单克隆抗体、兔抗人VEGF-A多克隆抗体及小鼠抗人IDH1(R132H)单克隆抗体(一抗工作浓度均为1∶100)。二抗:HRP标记的山羊抗小鼠/兔IgG聚合物、增强剂、抗原修复液、PBS、防脱玻片、免疫组化笔均购于北京中杉金桥生物公司。
1.3 实验方法 将存档的51例脑胶质瘤患者及10例正常脑组织的石蜡标本进行切片,切片厚度为4 μm,然后进行免疫组化PV-9000(Polink-2 plus)二步法染色,苏木精复染,中性树胶封固。其中IDH1 R132H 用已有的脑胶质瘤标本作阳性对照,HIF-1α用乳腺癌组织作阳性对照,VEGF用肝癌组织作阳性对照。组织抗原均采用高温修复(微波炉中火加热12 min),上述操作严格按照试剂盒说明书执行。
1.4 结果判读 IDH1R132H及HIF-1α主要表达在细胞核,VEGF蛋白主要表达在细胞质,3个指标的阳性信号主要表现为棕黄色或褐色染色,由2名病理科医师采用双盲法阅片,依照阳性细胞数量进行判定,在5个高倍镜视野下(10×40倍)将无阳性细胞数或阳性细胞数<1%定性为阴性,将阳性细胞>1%定性为阳性[12]。
1.5 统计学处理 采用SPSS 18.0对数据进行统计分析。计数资料采用例(百分比)表示,无序分类变量用χ2检验,等级资料用秩和检验,组间关联性分析用行×列表χ2检验做关联性分析,检验水准均取α=0.05。
2 结果
2.1 脑胶质瘤组与对照组的临床资料及目标蛋白的表达情况 HIF-1α表达方面:对照组10例均阴性,肿瘤组27例阴性表达,24例阳性表达,经分析存在统计学差异(P<0.05)。VEGF表达方面:对照组10例均阴性,肿瘤组20例阴性表达,31例阳性表达,经分析存在统计学差异(P<0.05)。而IDH1R132H方面:对照组10例均阴性,肿瘤组阴性表达30例,阳性表达21例,经分析存在统计学差异(P<0.05,见表1、图1~2)。
表1脑胶质瘤组与对照组的基本情况比较
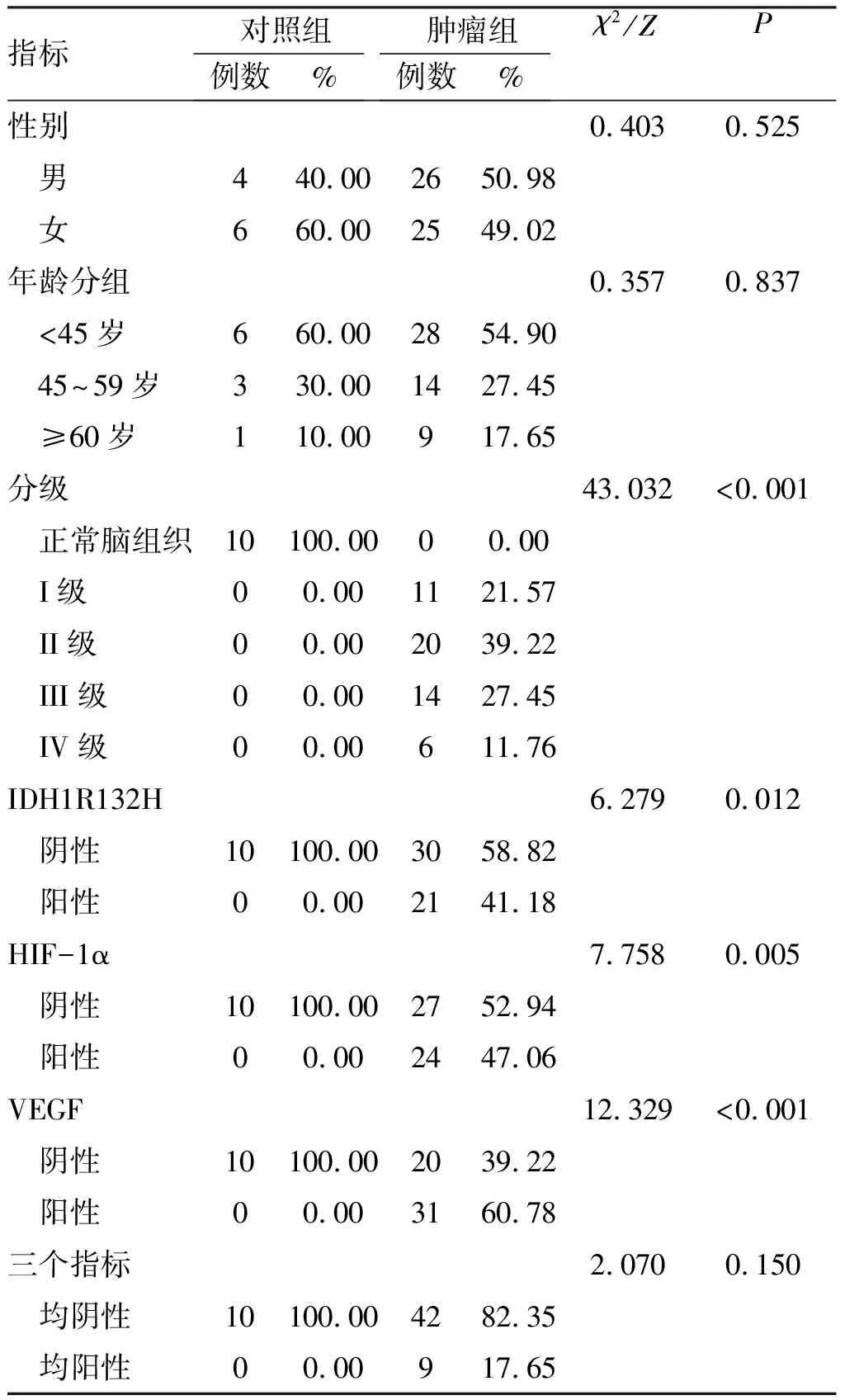
指标对照组例数%肿瘤组例数%χ2/ZP性别0.4030.525 男440.002650.98 女660.002549.02年龄分组0.3570.837 <45岁660.002854.90 45^59岁330.001427.45 ≥60岁110.00917.65分级43.032<0.001 正常脑组织10100.0000.00 I级00.001121.57 II级00.002039.22 III级00.001427.45 IV级00.00611.76IDH1R132H 6.2790.012 阴性10100.003058.82 阳性00.002141.18HIF-1α 7.7580.005 阴性10100.002752.94 阳性00.002447.06VEGF 12.329<0.001 阴性10100.002039.22 阳性00.003160.78三个指标2.0700.150 均阴性10100.004282.35 均阳性00.00917.65
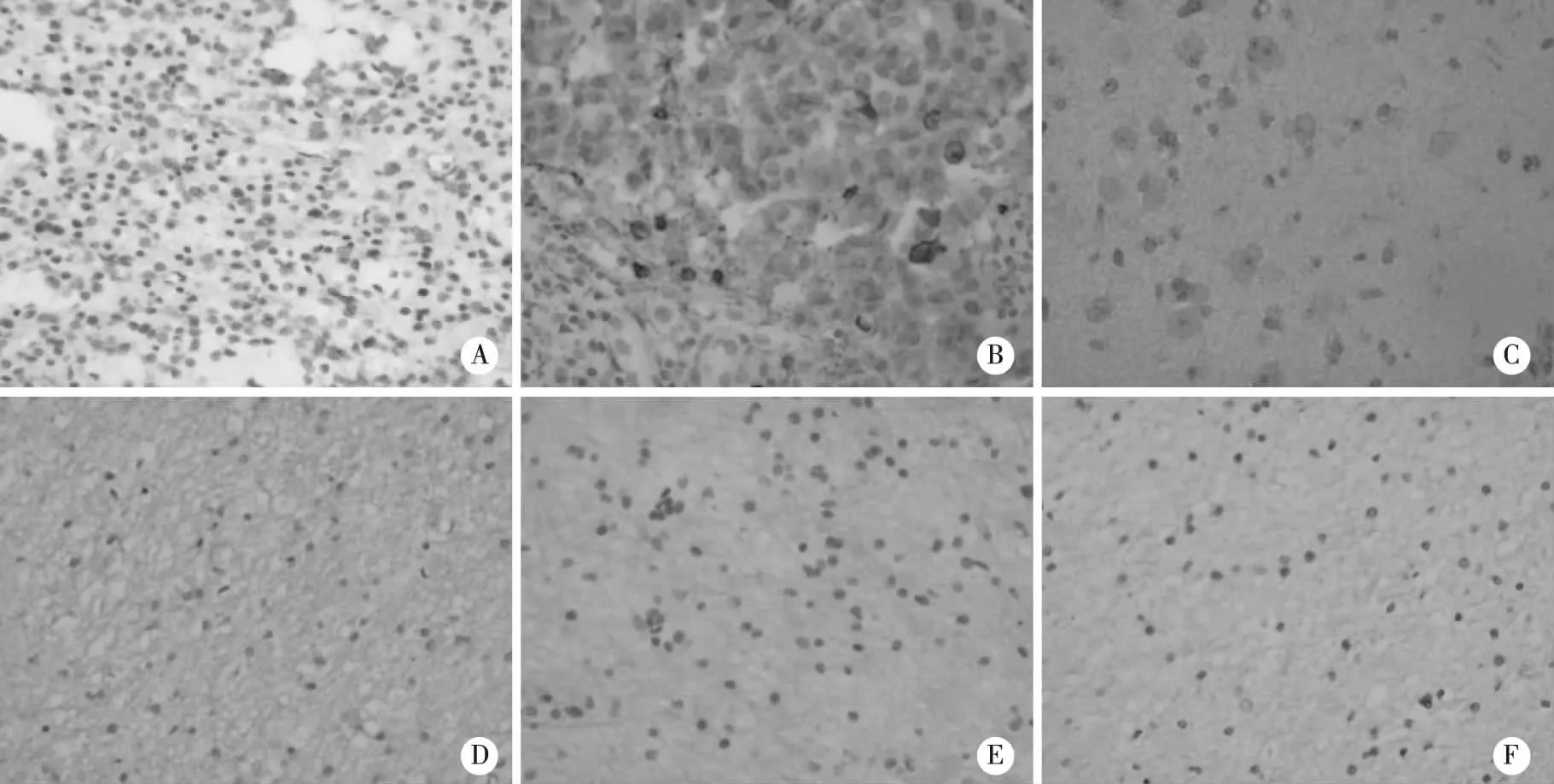
A:IDH1 R132H在脑胶质瘤中的阳性表达(阳性对照); B:HIF-1α在乳腺癌中的阳性表达(阳性对照); C:VEGF在肝癌中的阳性表达(阳性对照); D:IDH1R132H在正常脑组织中的阴性表达(阴性对照); E: HIF-1α在正常脑组织中的阴性表达(阴性对照); F: VEGF在正常脑组织中的阴性表达(阴性对照)。图1 IDH1 R132H、HIF-1α及VEGF的阳性对照及正常脑组织阴性对照(×400)
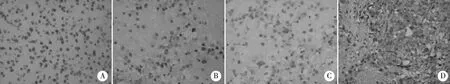
A: IDH1 R132H 在胶质瘤细胞核上阳性表达; B: HIF -1α 在胶质瘤细胞核的阳性表达; C:HIF -1α在胶质瘤细胞核的阳性表达; D: VEGF 在胶质瘤细胞质中的阳性表达。图2 IDH1 R132H、HIF-1α及VEGF在脑胶质瘤中的阳性表达(×400)
2.2 不同病理特征脑胶质瘤的IDH1 R132H、HIF-1α及VEGF的表达 IDH1R132H阳性表达21例,组织分级中:III级表达最高57.14%(8/14),II级表达次之50.00%(10/20),IV级表达最低0(0/6);性别分组中:男性阳性表达较高50%(13/26),女性阳性表达率为32%(8/25);在年龄分组中:中年组(45~59岁)表达最高57.14%(8/14),老年组表达最低33.33%(3/9);在位置分组中:顶叶表达最高80%(4/5),额叶表达最低(3/14);经统计学分析,IDH1R132H蛋白的表达与性别、年龄、组织分级及位置无关(P>0.05)。HIF-1α阳性表达有24例,组织分级中:IV级表达最高83.33%(5/6),II级表达最低35.00%(7/20);性别分组中:男性阳性表达较高53.85%(14/26),女性阳性表达率为40.00%(10/25);年龄分组中:老年组表达最高77.8%(7/9),青年组表达最低32.14%(9/28);位置分组中:颞叶表达较高50.00%(3/6),额叶表达最低21.42%(3/14);经统计学分析,年龄分组中中年及老年差异有统计学意义(P<0.05);HIF-1α的阳性表达与性别、组织分级及位置无关(P>0.05)。VEGF表达阳性有31例,在组织分级中:I级表达最高72.73%(8/11),IV级表达最低50.00%(3/6);性别分组中:女性阳性表达较高64.00%(16/25),男性阳性表达率为57.69%(51/26);年龄分组中:老年组表达最高66.67%(6/9),中年组表达最低57.14%(8/14);在位置分组中:颞叶表达较高76.92%(10/13),枕叶表达最低16.67%(1/6);经分析,VEGF在胶质瘤的位置分组中差异有统计学意义(P<0.05);VEGF阳性表达与性别、年龄、组织分级无关(P<0.05,见表2)。
表2 IDH1R132H、HIF-1α及VEGF阳性表达与临床病理特征的关系

指标例数IDH1R132H阳性(%)χ2PHIF-1α阳性(%)χ2PVEGF阳性(%)χ2P三阳性阳性(%)χ2P性别男2613(50.00)1.710.19214(53.85)0.980.32215(57.69)0.210.6457(26.9)3.140.076女258(32.00)10(40.00)16(64.00)2(8.00)年龄<45岁2810(35.71)2.0470.3599(32.14)6.4810.03917(60.71)0.2090.9013(10.71)2.1780.33745^59岁148(57.14)8(57.14)∗8(57.14)4(28.57)≥60岁93(33.33)7(77.78)6(66.67)2(22.22)分级I级113(27.27)7.050.0695(45.45)0.8060.8488(72.73)1.280.7340(0)4.9370.154II级2010(50.00)7(35.00)11(55.00)5(25.00)III级148(57.14)7(50.00)9(64.29)4(28.57)IV级60(0.00)5(83.33)3(50.00)0(0)位置额叶143(21.42)5.7310.2213(21.42)6.6180.1587(50.00)11.0060.0261(7.14)4.1720.390颞叶136(46.15)7(53.85)10(76.92)3(23.08)枕叶63(50.00)3(50.00)1(16.67)##0(0)顶叶54(80.00)2(40.00)2(40.00)1(20.00)其他部位135(38.46)9(69.23)11(84.62)4(30.77)
*:45~59岁与≥60岁,P<0.05;##:枕叶与其它位置相比,P<0.01。
2.3 IDH1R132H、VEGF及HIF-1α 3个指标之间两两比较的相关性分析 51例脑胶质瘤中,VEGF蛋白阳性表达率为60.78%(31/51),HIF-1α蛋白阳性表达率为47.06 %(24/51);VEGF、HIF-1α蛋白均阳性者18例,均阴性者14例,VEGF蛋白阳性且HIF-1α蛋白阴性者13例,VEGF蛋白阴性且HIF-1α蛋白阳性者6例,VEGF与HIF-1α蛋白表达呈正关联,关联强度:1.67 (χ2=3.84,P=0.05),95%CI:[1.00,2.76](见表3)。IDH1R132H蛋白阳性表达率为41.18%(21/51),HIF-1α蛋白阳性表达率为47.06%(24/51);IDH1R132H、HIF-1α蛋白均阳性者10例,均阴性者16例,IDH1R132H蛋白阳性且HIF-1α蛋白阴性者11例,IDH1 R132H蛋白阴性且HIF-1α蛋白阳性者14例,IDH1R132H与HIF-1α蛋白表达无明显关系, (χ2=0.004,P=0.948,见表4)。VEGF蛋白阳性表达率为60.78%(31/51),IDH蛋白阳性表达率为41.18%(21/51);VEGF、IDH1R132H蛋白均阳性者15例,均阴性者14例,VEGF蛋白阳性且HIF蛋白阴性者16例,VEGF蛋白阴性且HIF-1α蛋白阳性者6例,IDH1R132H与HIF-1α蛋白表达无明显关联(χ2=1.697,P=0.183,见表5)。
表3 VEGF、HIF-1α蛋白在脑胶质瘤组织中表达的相关性分析(n=51)
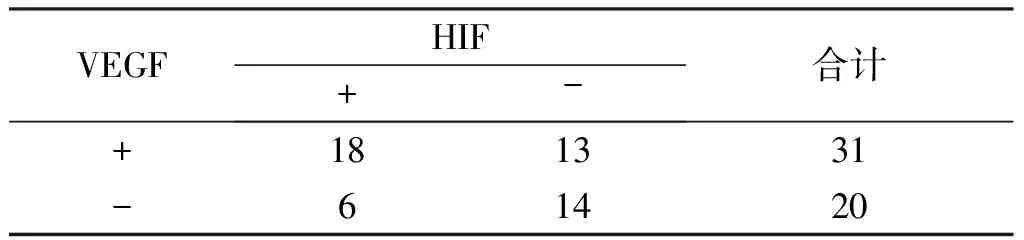
VEGFHIF+-合计+181331-61420
表4 IDH1R132H、HIF-1α蛋白在脑胶质瘤组织中表达的相关性分析(n=51)
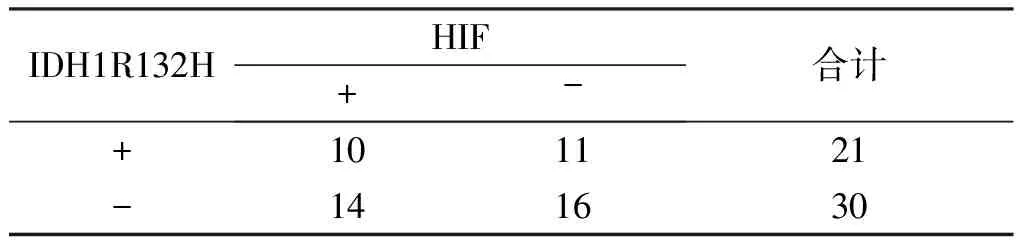
IDH1R132HHIF+-合计+101121-141630
表5 IDH1R132H、VEGF蛋白在脑胶质瘤组织中表达的相关性分析(n=51)

VEGFIDH1R132H+-合计+151631-61420
3 讨论
脑胶质瘤是发生于神经外胚层的肿瘤,目前被认为是颅内原发肿瘤发病率最高的,根据美国肿瘤注册中心(central brain tumor registry of the united states,CBTRUS)统计,胶质瘤占所有中枢神经系统肿瘤的27%,占恶性肿瘤的80%[3],因其较高的致死率及致残率,目前对其研究越来越多。
生物体内的IDH1(NADP-依赖型IDH)可催化异柠檬酸的氧化脱羧生成α-酮戊二酸(α-ketoglutaric acid,α-KG),当该基因发生突变时,会产生大量的2-羟基戊二酸(2-hydroxyglutaric,2-HG)堆积, 2-HG的堆积大量消耗2-羟基戊二酸脱氢酶。2-HG大量堆积可以影响大脑内白质的结构及功能,导致脑内白质病变,同时2-HG抑制脑胶质瘤干细胞分化,上调血管内皮生长因子(vascular endothelial growth factor,VEGF)促进肿瘤微环境的形成,产生高水平的HIF-1α,促进胶质瘤侵袭,最终这些改变将导致脑胶质瘤的发生发展[13-14]。HIF-1α对维持肿瘤细胞的能量代谢、血管生成、促进肿瘤细胞增殖及转移起重要作用[15]。胶质瘤的特征是快速失控的生长导致缺氧区域和坏死[16]。这也为HIF-1α稳定表达提供条件,进一步导致肿瘤细胞不断增生。
李金磊等[17]通过实验证实HIF-1α在高级别胶质瘤中表达高于低级别胶质瘤,即HIF-1α的表达与胶质瘤的恶性程度成正相关,可以作为判断脑胶质瘤预后的指标。而谢燕等[18]对135例胶质瘤组织切片进行实验并得出HIF-1α的表达与预后呈正相关,同时与性别、部位无相关性。而本实验发现,HIF-1α的表达与年龄有关,老年人的表达明显最高,青年表达最低(P<0.05),且高级别胶质瘤的表达高于低级别胶质瘤,提示年纪越大,HIF-1α表达越高,恶性程度越高,预后越差。同时我们实验发现HIF-1α与VEGF呈正关联。可能的机制为HIF-1α表达增加,可促进VEGF mRNA的表达,增加VEGF的表达。
郭克勤等[19]通过实验发现, VEGF与胶质瘤的新生血管生成密切相关,主要以旁分泌方式作用于细胞上的两种受体诱导血管形成,同时发现VEGF在高级别胶质瘤中表达高于低级别胶质瘤。魏秀丽等[20]通过实验证实VEGF在胶质瘤中的表达与分级有关,与性别、年龄及部位无关。而本实验发现VEGF的表达与部位有关(P<0.05),高级别胶质瘤表达高于低级别胶质瘤,但与分级无统计学差异(P>0.05)之所以如此,可能跟本实验样本量较少,结果为人工判读存在一定误差有关。
研究表明[10]:在胶质母细胞瘤中,IDH1突变的组织中,HIF-1α及血清中的VEGF的水平显著增加。而本实验发现IDH1R132H、HIF-1α及VEGF在正常对照组中不表达,胶质瘤中明显高表达(P<0.05),3个指标均阳性表达有9例,与胶质瘤患者的性别、年龄、分级及部位无关(P>0.05),3个指标均阳性在II、III级中表达,但与胶质瘤的分级无统计学意义,考虑可能与实验样本量不足及结果判读有关。
综上所述, HIF-1α表达与年龄有关,VEGF的表达与胶质瘤部位有关,HIF-1α与VEGF在胶质瘤的发展中起协同作用。

