慢性充血性心力衰竭兔左心室三层心肌间Cx43表达的差异及其意义
吴美霞,刘亚军,陆士娟,孙定军,吴淼,张伟,黄康,钟江华
慢性充血性心力衰竭(congestive heart failure,CHF)主要为老年发病,病情复杂且凶险,容易引发恶性室性心律失常(MVA),随之出现心源性猝死(SCD)[1]。目前有调查显示,约75%的老年CHF患者猝死与MVA有关[2]。但迄今为止,CHF易发MVA的生理机制仍未明确,因而缺乏有效的预防及控制措施。近年来有研究发现MVA的发生可能与跨室壁复极离散(TDR)有关[3]。成人心脏在解剖上由心内膜下心肌(Endo)、中层心肌(Mid)及心外膜下心肌(Epi)组成,其中Mid的复极化持续时间比另外两层心肌明显延长,从而造成TDR。在某些病理条件下,这种心肌横断面上的复极差异还会进一步扩大[4],容易诱发MVA,但其发生的蛋白分子机制并不清楚。
缝隙连接蛋白43(connexin 43,Cx43)广泛参与左心室心肌细胞和传导系统的各种工作,通过相邻细胞间电、化学信号通路参与MVA的发生发展[3]。Chang等[5]在大鼠心肌梗死(MI)模型中发现Cx43表达明显降低,且梗死边缘区心肌细胞电传导功能受损,说明MVA与Cx43的异质性有关。本研究通过缩窄腹主动脉建立CHF兔模型,观察其左心室三层心肌间Cx43表达的差异,旨在探讨CHF发生MVA的机制。
1 材料与方法
1.1 动物分组及模型制作 24只雄性健康新西兰大白兔,体重(2.5±0.5)kg,由杭州余杭科联兔业提供[合格证号:SCXK(浙)2013-0055]。将24只兔随机分为CHF组(n=12)和假手术组(Sham组,n=12)。CHF组兔称重后经耳缘静脉用氨基甲酸乙酯(1.0g/kg)麻醉,腹部常规消毒,正中线切开,沿左肾动脉上方游离出腹主动脉并钝性分离,用5F或6F导管平行于腹主动脉,4号线结扎,取出导管,使腹主动脉横截面积狭窄约为70%[6]。Sham组开腹后不结扎腹主动脉,其余步骤同CHF组。两组兔均在缝合切口后青霉素连续肌内注射3d以预防感染,术后连续喂养8周后进行实验。本实验经中南大学湘雅医学院附属海口医院生物医学伦理委员会批准。
1.2 溶液制备 ①10%过硫酸铵(AP):超纯水1.0ml和过硫酸胺0.1g溶解后,于4℃保存1周;②电泳缓冲液:Tris[重均分子量(MW)121.14]3.04g、甘氨酸(MW 75.07)14.42g、十二烷基硫酸钠(SDS)0.5g加蒸馏水至1000ml;③转移缓冲液:甘氨酸(MW 75.07)14.42g、Tris(MW 121.14)3.04g、甲醇200ml加蒸馏水至1000ml;④TBST缓冲液:Tris(MW 121.14)1.22g、NaCl 2.92g、Tween 20 0.5ml加蒸馏水至1000ml;⑤封闭液:脱脂奶粉5g加TBST缓冲液100ml。
1.3 实验方法
1.3.1 在体心脏超声检查 兔喂养8周后称重,并通过耳静脉用1.0g/kg氨基甲酸乙酯静脉麻醉,取仰卧位,固定兔的四肢,采用超声扫描仪(ATLHDI-5000型)在胸骨旁左室长轴扫描,通过心脏彩超检查兔的左心室舒张末期内径(LVEDD),左心室收缩末期内径(LVESD)、室间隔厚度(IVS)、左心室后壁厚度(LVPW)和左室射血分数(LVEF)。
1.3.2 在体血流动力学检测 分离并切开右颈总动脉,然后插入含有1%肝素的直径约1mm心导管,缓慢推进的同时接BL-420S生物机能分析系统(成都泰盟软件有限公司),稳定5min后,测量其外周动脉收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)、左心室最大上升速度和最大下降速度(±dp/dtmax)等参数。
1.3.3 左心室三层心肌的提取 兔称重后处死,剪取心脏,用滤纸吸干生理盐水洗净的心脏,分别称量整个心脏重量(HW)和左心室重量(LVW),计算心脏重量比(HW/BW)和左心室重量比(LVW/BW)。按照相关文献报道[7]剪取兔左心室游离壁,并用刀片分离三层心肌组织,其中Epi为心外膜面至其下2mm,Mid为心外膜面下2~7mm,Endo为心内膜面至其下2mm。将上述提取出的组织分别用Eppendorf管冻存于-80℃冰箱中备用。
1.3.4 左心室心肌HE染色及免疫组化染色 取左心室心肌组织,用4%聚合甲醛溶液冲洗,在石蜡包埋之前进行固定、脱水然后切片,厚度约为4μm,常规行HE染色。石蜡包埋的左心室不同心肌层切片用于Cx43表达的免疫组化染色检测,脱蜡、水合和抗原修复后,在室温下用1%BSA封闭组织45min,切片加入一抗孵育过夜,并用生物素化标记二抗1h,然后用ABC过氧化物酶和DAB(二氨基联苯胺)孵育,苏木素复染,并在光镜下观察,Cx43阳性为深棕黄色,阴性不显色[8]。对染色结果进行半定量分析,采用Image-Pro Plus 6.0图像分析系统,每张切片随机选取5个高倍视野(×200)测定免疫组化图像中的平均光密度值。
1.3.5 Western blotting检测左心室心肌Cx43蛋白表达 将两组兔心肌组织溶解在裂解缓冲液内,提取蛋白后用BCA试剂盒检测蛋白质浓度。在SDS丙烯酰胺凝胶上负载30μg蛋白,转移至PVDF膜。使用发光体化学发光法针对Cx43、GAPDH和二次抗体(辣根过氧化物酶)的特异性抗体进行检测。将目标蛋白/参考蛋白的半定量值作为Cx43蛋白的表达水平,用Cx43-pro代表左心室三层心肌的Cx43蛋白的含量;左心室壁心肌间最大Cx43-pro与最小Cx43-pro的差值用ΔCx43-pro表示,反映跨室壁Cx43蛋白表达的差异。
1.3.6 RT-qPCR检测左心室Cx43 mRNA的表达用Trizol试剂提取心肌总RNA,并将其反转录为cDNA,随后将100ng cDNA作为模板,加入1μl正反引物,行RT-qPCR反应,每个样品最终体积为20μl。RT-qPCR反应条件为:95℃变性1min;60℃扩增30s,95℃变性10s,随后循环40次。熔解曲线从70℃增加到95℃,每5s增加0.5℃。qPCR扩增过程中收集荧光,反应结束后,分析、计算qPCR过程各检测样本荧光信号能被检测到的循环阈值(Ct值),并计算样本的Cx43 mRNA表达差异倍数(Cq值)用于反映Cx43 mRNA的相对表达水平[9]。左心室壁心肌最大Cx43-Cq与最小Cx43-Cq的差值用ΔCx43-Cq表示,反映跨室壁Cx43 mRNA表达的差异。
1.4 统计学处理 采用SPSS 22.0软件进行统计分析。所有数据以表示,多组间比较采用单因素方差分析(ANOVA),进一步两两比较方差齐时采用SNK-q检验,方差不齐时采用Tamhane'sT2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 实验结束时CHF组兔存活9只,死亡3只,Sham组全部存活。在体血流动力学参数显示,与Sham组比较,CHF组SBP、DBP、MAP及±dp/dtmax均明显降低,差异有统计学意义(P<0.01,表1)。与Sham组比较,CHF组HW/BW及LVW/HW明显增加,差异有统计学意义(P<0.05,表1)。心脏病理切片检查结果显示,CHF组心肌细胞体积增大、直径增宽,细胞排列不规则、染色不均匀,间质纤维化明显,而Sham组心肌细胞体积、直径正常,细胞排列规则,间质无明显纤维化,组织学表现正常(图1)。
表1 两组兔一般资料比较(±s)Tab.1 Basic data of the two groups of rabbits (±s)

表1 两组兔一般资料比较(±s)Tab.1 Basic data of the two groups of rabbits (±s)
(1)P<0.05, (2)P<0.01 compared with sham group
Item Sham group (n=12) CHF group (n=9)HW/BW 0.20±0.01 0.25±0.03(1)LVW/HW 0.15±0.01 0.18±0.02(1)SBP (mmHg) 151.14±21.75 134.16±5.78(2)DBP (mmHg) 110.24±18.56 93.40±3.64(2)MAP (mmHg) 74.32±7.06 58.89±2.40(2)+dp/dtmax (mmHg/ms) 3.56±0.40 3.40±0.71(1)–dp/dtmax (mmHg/ms) –2.91±0.07 –2.88±0.47(1)
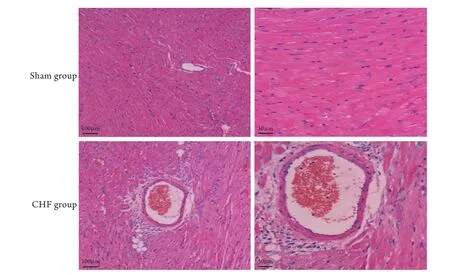
图1 两组兔左心室心肌病理切片观察(HE染色)Fig.1 Pathological observation of left ventricular myocardium in the two groups of rabbits (HE staining)
2.2 超声心动图检测结果 与Sham组比较,CHF组LVEF降低,LVEDD、LVESD明显升高,差异有统计学意义(P<0.05);而IVS、LVPW比较差异无统计学意义(P>0.05,表2)。
表2 两组兔超声心动图检测结果(±s)Tab.2 Results of echocardiography in the two groups of rabbits (±s)
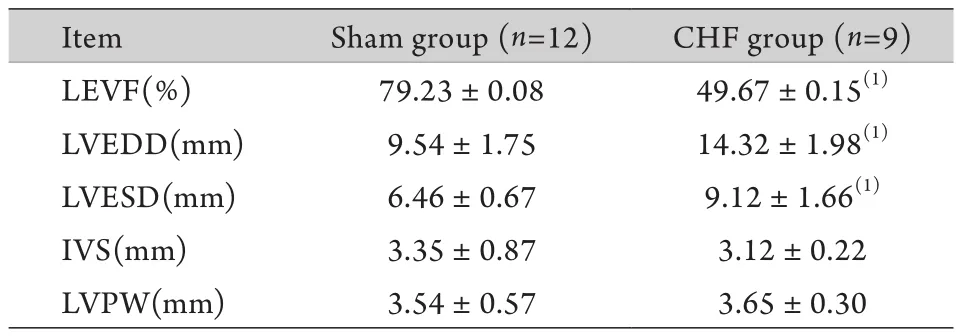
表2 两组兔超声心动图检测结果(±s)Tab.2 Results of echocardiography in the two groups of rabbits (±s)
(1)P<0.05 compared with sham group
Item Sham group (n=12) CHF group (n=9)LEVF(%) 79.23±0.08 49.67±0.15(1)LVEDD(mm) 9.54±1.75 14.32±1.98(1)LVESD(mm) 6.46±0.67 9.12±1.66(1)IVS(mm) 3.35±0.87 3.12±0.22 LVPW(mm) 3.54±0.57 3.65±0.30
2.3 左心室三层心肌Cx43蛋白的表达的Western blotting检测结果 CHF组Epi、Mid及Endo的Cx43蛋白表达水平(分别为43.76±2.43、32.49±2.27及44.28±4.75)均明显低于Sham组(分别为56.23±2.45、50.43±4.56、58.65±3.21),差异有统计学意义(P<0.05)。两组组内比较,Endo的Cx43蛋白表达水平明显高于Mid、Epi,而Epi的Cx43蛋白表达水平明显高于Mid,差异均有统计学意义(P<0.05)。CHF组的ΔCx43-pro(15.37±2.08)明显高于Sham组(11.19±1.48,P<0.05,图2)。
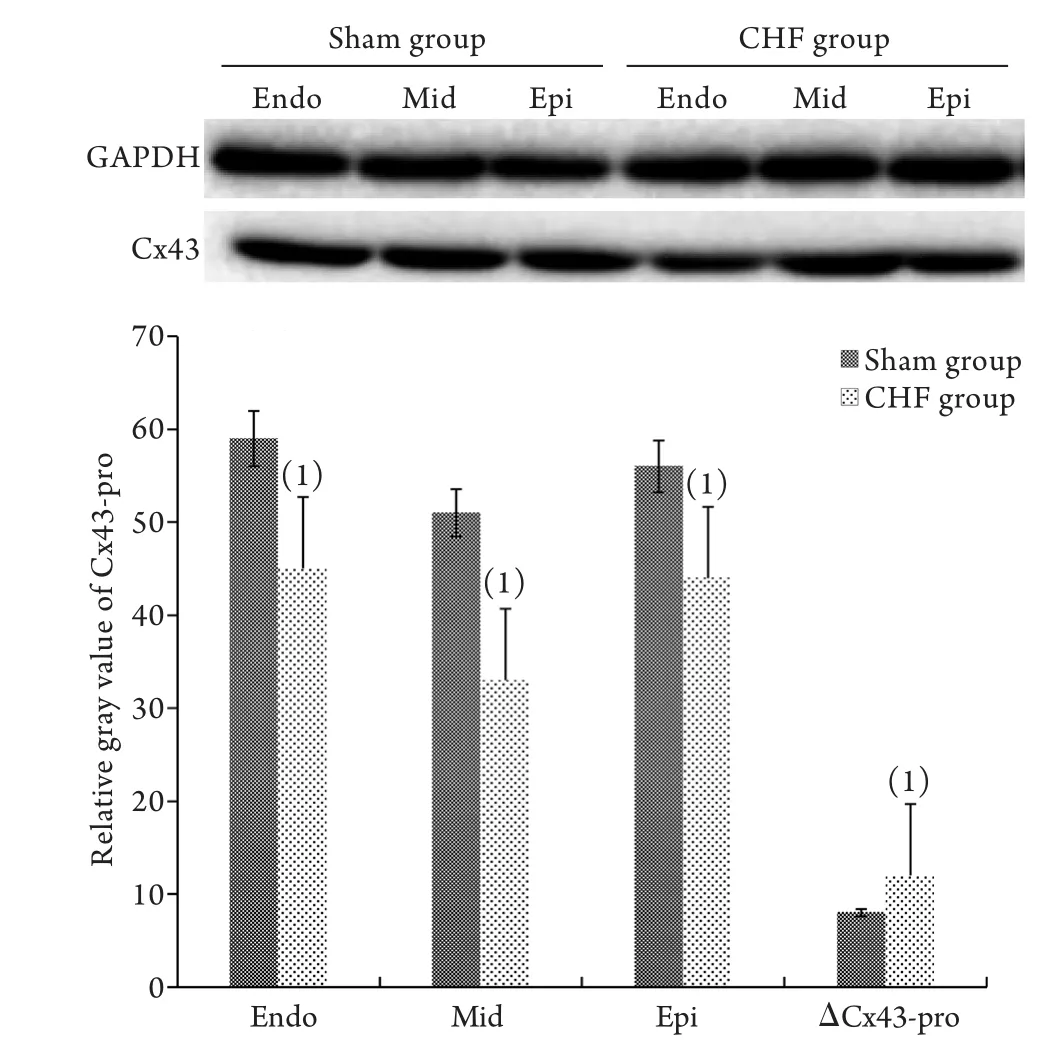
图2 两组兔左心室三层心肌Cx43蛋白的表达(Western blotting)Fig.2 Expression of Cx43 protein in three layers of left ventricular myocardium in the two groups of rabbits (Western blotting)
2.4 左心室三层心肌间Cx43蛋白表达的免疫组化检测结果 CHF组Endo、Mid及Epi的Cx43蛋白表达水平(分别为2.69±0.31、2.03±0.29、2.54±0.33)明显低于Sham组(分别为3.72±0.12、3.59±0.13、3.69±0.17),差异有统计学意义(P<0.05)。CHF组各层心肌深棕黄色颗粒较Sham组明显减少,且三层心肌中以Mid减少最为显著(图3)。

图3 两组兔左心室三层心肌Cx43蛋白的表达(免疫组化染色)Fig.3 Expressions of Cx43 protein in three layers of left ventricular myocardium in the two groups of rabbits (Immunohistochemical staining)
2.5 RT-PCR检测左心室三层心肌间Cx43 mRNA的表达 CHF组Epi、Mid及Endo的Cx43 mRNA表达(Cq值分别为21.07±1.02、17.54±1.08及20.62±1.21)明显低于Sham组(Cq值分别为23.45±0.98、22.48±1.08、24.87±1.45),差异有统计学意义(P<0.05)。两组组内比较,Endo的Cx43 mRNA明显高于Mid、Epi,Epi的Cx43 mRNA明显高于Mid,差异均有统计学意义(P<0.05)。CHF组的ΔCx43-Cq(4.26±0.27)较Sham组(2.22±0.48)明显升高,差异有统计学意义(P<0.05,图4)。

图4 RT-PCR检测两组兔左心室三层心肌Cx43 mRNA表达Fig.4 Expressions of Cx43 mRNA in three layers of left ventricular myocardium in the two groups of rabbits (RT-PCR)
3 讨 论
CHF是因心脏结构改变、功能和代谢紊乱引起心脏扩大、心室充盈受损及心脏射血能力下降的临床综合征[10-11],是各种类型心脏疾病发展的最后阶段。本研究通过腹主动脉缩窄术建立兔CHF模型,CHF组兔死亡3只,模型成活率75%。术后8周CHF组的LEVF<50%,且LVEDD、LVESD增高,提示兔造模8周后心脏收缩功能及舒张功能均明显受损。此外,通过颈动脉插管也证实,CHF组SBP、DBP及左心室±dp/dtmax明显降低,表明CHF兔心脏泵功能明显降低,心脏逐渐丧失代偿能力。病理结果显示,CHF组心肌细胞体积变大,直径加宽,细胞排列混乱、染色不一,间质有明显的纤维化现象,与CHF的病理表现相同,证明本研究成功建立了可靠的CHF动物模型。
MVA是CHF的一种常见并发症,其死亡发生率高达50%~60%,更是CHF患者突发SCD的常见因素[12]。Cx43主要负责心肌细胞间电位的快速传送,在电流传导中具有重要作用[13]。研究表明,Cx43蛋白主要在心肌细胞中丰富表达,作为心室肌电流传导的介质并维持搏动节律,是MVA发生的潜在基础[14]。此外,有研究发现,右心室发育不良导致心律失常的患者存在Cx43蛋白的减少及分布异常,且可发生持续性心动过速[15]。进一步研究发现,在心肌肥厚小鼠中Cx43分布的空间异质性增加,出现了Cx43的去磷酸化,Cx43的去磷酸化可导致耦联受损,引起传导阻滞,从而增加了MVA的易患性,心电图表现为QRS波延长[16]。本研究结果显示,CHF组左心室三层心肌的Cx43蛋白表达均明显低于Sham组,这可能是CHF易发MVA的重要原因之一。
近年来,国内外还有研究认为跨室壁电生理差异性是心室壁固有的心电现象[17]。而Mid具有特殊的电生理特性,这种特殊性在于:在各种离子交换产生的作用下,Mid的动作电位持续时间较Endo及Epi延长,这种差异使得心脏在不同的层面上出现复极异常,也就是TDR。本研究的Western blotting及RT-PCR检测结果均表明,Sham组兔的Cx43在三层心肌横断面上存在表达差异,Mid的Cx43蛋白及mRNA表达均明显少于Epi及Endo,由此可见,左心室三层心肌间的Cx43表达差异可能是心肌不同层面电生理异质性的蛋白基础。
此外,左心室壁各层心肌细胞不仅复极时程不一致,对其他疾病如心肌梗死和CHF产生的复极作用也不尽相同,这些差异性会增加心肌细胞有效不应期的离散,使TDR增大,进而更加容易引起MVA[17],但是各层心肌复极化不一致的蛋白机制尚不明确。既往研究发现,小鼠心肌梗死模型中Cx43含量降低,MVA的发生率明显增加,而增加Cx43表达后,发生MVA的敏感性减弱[18]。Wu等[19]研究发现,与对照组比较,缺血组心肌细胞活性降低,Cx43含量减少且分布出现异常,MVA发生的评分率也增加,而加入增加心肌细胞Cx43表达的药物后,其发生MVA的机会明显减少。以上结果均表明,器质性心脏病的心肌Cx43表达水平降低在心律失常的发生中起到了一定的作用。本研究结果还发现,CHF三层心肌Cx43蛋白表达水平下降的同时,ΔCx43-pro和ΔCx43-Cq明显增大,Cx43在心肌各层面上的表达差异性进一步扩大,这可能使CHF的TDR增大,从而更易发生SCD。导致Cx43在各层心肌表达差异性扩大的潜在因素有很多,可能与CHF心肌细胞之间的Cx43异常表达造成神经体液调节失衡、细胞间的互相制约减弱及心电传导推迟有关[20]。有研究发现,CHF患者血浆中血管紧张素Ⅱ(AngⅡ)含量升高,而接受血管紧张素受体阻滞剂的患者其血浆中拮抗AngⅡ的物质增多[21]。此外AngⅡ可能通过促进心脏成纤维细胞(CFs)增殖和转化而导致心肌纤维化,降低Cx43的渗透性,从而损害心脏细胞之间化学信息的传递,造成了心脏电生理障碍[22-23]。
总之,Cx43异质性的扩大可能会扰乱左心室心电活动的平衡,继而使心脏发生MVA的机会明显增高,而具有减轻左心室各层心肌Cx43表达异常作用的药物,将能够减少Cx43三层心肌间复极的不一致,提高心室颤动阈值,减少MVA的发生。本研究的观察时间跨度相对较小,而心肌重塑进而形成CHF是一个长期的渐进性病理过程,因此,今后的研究可以选择不同的时间长度来观察Cx43表达异质性的变化,并进一步探讨这种异质性所引起的心电离子通道改变的机制。

