辣椒疫霉病生防细菌的筛选鉴定及其防效
赵旖森 张 亮 盛 浩 袁 红 周 清
(湖南农业大学资源环境学院,湖南长沙 410128)
由疫霉(Phytophthora)引发的疫霉病害是一种严重威胁作物产量、品质以及土壤质量的恶劣土传病害(H ü berli,2017)。该类病原菌卵孢子不仅能在土壤中长期存活,而且通常具有广泛的寄主,例如辣椒疫霉病原菌能够侵染并严重危害辣椒、黄瓜、番茄、大豆、南瓜等多种植物(Hausbeck &Lamour,2004)。拮抗菌是一类特殊的有益微生物,不仅是土传病原菌的天然克星,更是提高植物抗逆性与病土生态修复的绿色伙伴(梅新兰 等,2010;Katan,2017)。近年来,利用拮抗菌防控疫霉病害已成为生物防治领域关注的热点,拮抗菌株类型也较为广泛(殷洁和袁玲,2017;杨定祥 等,2018),以细菌型拮抗菌的报导最多,例如Khabbaz等(2015)通过根部泥炭包裹法研究证实芽孢杆菌8B-1以及假单胞菌9A-14、8D-45等生防细菌能够显著降低黄瓜疫霉病的病情指数并具有明显促生效果;蒋继志等(2017)从莴苣土壤中分离获得的深红沙雷氏菌SR13-2对马铃薯晚疫病具有高达91.83%的显著预防效果。然而,拮抗菌株的防病效果与土壤环境条件有关,筛选并获得适宜当地土壤环境的优良拮抗菌株是疫霉等土传病害绿色生物防控的关键环节(Goswami et al.,2016;S á enz-Mata et al.,2016)。 笔 者 从 南方酸性水稻土壤中筛选、鉴定了对辣椒疫霉菌具有显著抑菌效果的拮抗细菌,并对其温室防病能力进行了研究,以期为蔬菜疫霉病害的生物防治提供适合南方酸性土壤环境的新菌株资源,也为后续的生物农药开发提供必要的生防材料与理论依据。
1 材料与方法
1.1 试验材料
试验于2017年4月在湖南农业大学资源环境学院教学基地温室进行。供试土壤为酸性水稻土,采集于湖南农业大学附近水稻田耕作层。供试病原菌为辣椒疫霉菌(Phytophthora capsici)It263,保存于湖南农业科学院植物保护研究所。辣椒品种为湘椒5号,购于长沙新万农种业公司。
细菌培养采用NBY培养基(营养肉汤粉8 g,酵母提取物2 g,磷酸氢二钾2 g,磷酸二氢钾0.5 g,葡萄糖2.5 g,1 mol·L-1七水合硫酸镁 1 mL,去离子水1 L,琼脂18 g);真菌培养采用PDA培养基(马铃薯200 g,葡萄糖20 g,去离子水1 L,琼脂18 g)。液体培养时均不添加琼脂。
细菌基因组DNA提取试剂盒、土壤基因组DNA提取试剂盒、植物基因组DNA提取试剂盒、通用PCR试剂盒、PCR纯化试剂盒均购自江苏康为世纪生物科技有限公司,真菌基因组总DNA试剂盒购于QIAGEN公司;细菌通用特异性引物与辣椒疫霉菌特异性引物由武汉奥科鼎盛生物科技有限公司合成。
1.2 土壤细菌分离、纯化与保存
土壤细菌分离采用连续稀释法,具体步骤为:称取10 g土壤于置有90 mL无菌水的250 mL三角瓶中,振荡摇匀30 min(180 r·min-1),静置5 min,分别吸取1 mL悬液加入置有9 mL无菌水的灭菌试管中,后依次连续稀释至10-5、10-6等不同稀释度,吸取不同稀释度混合液100 μL并涂布于NBY培养皿中,于28 ℃条件下倒置培养于生化培养箱中。
菌株纯化:每隔12 h观察上述培养皿生长情况,待菌落生长至适合形态时,用接种棒挑取单菌落划线至NBY培养皿,28 ℃条件下倒置培养于生化培养箱中,备用。
菌株保存:挑取纯化后的单菌落接种于2 mL液体NBY培养基中,各2管,4 ℃保存。
1.3 疫霉拮抗细菌筛选与抑菌持久性复检
筛选:采用平板对峙法测定(刘邮洲 等,2012),即挑取纯化后的细菌菌株接入10 mL液体NBY培养基中,28 ℃、150 r·min-1振荡培养28 h。疫霉病原菌接种于PDA平板,于26 ℃培养7 d后,沿菌丝边缘使用打孔器打取直径为0.5 cm的菌饼并分别放置于距PDA平板边缘3 cm一侧,另一侧相同距离处则用蘸有待测细菌菌液的接种棒划出长约4 cm的菌线并于28 ℃恒温培养,以无菌水处理作为对照,待对照平板菌落长满时测量各初筛平板的病原菌菌落半径,并计算抑菌率。

抑菌持久性复检:以筛选出的有拮抗效果的细菌开展重复性抑菌试验,并于接种后7、14、21、28 d统计抑菌率,具体方法同上。
1.4 菌株种属的16S rRNA分子鉴定
25 μL PCR反应体系:2.5 μL细菌基因组DNA,1.5 μL 10 mmol·L-1引 物(Galkiewicz &Kellogg,2008)(8F:5′-AGAGTTTGATCCTGGCTC AG-3′/1492R:5′-GGTTACCTTGTTACGACTT-3′),2 μL 5 μmol·L-1dNTPs,1.3 μL 50 mmol·L-1MgCl2,2.5 μL 10×PCR buffer,0.25 μL DNA 聚合酶,其余体积用ddH2O补足。PCR扩增条件:94℃ 5 min;94 ℃ 1 min,55 ℃ 45 s,72 ℃ 120 s,40个循环;72 ℃ 5 min。反应结果经1%琼脂糖凝胶电泳进行检测,纯化后样品送测序公司测序。所获序列在NCBI数据库中进行BLAST同源性比对并提交GenBank获取授权登记号,选取5株相似度100%的相关模式菌株利用MEGA 7.0软件进行多序列比对并构建系统发育树。
1.5 疫霉病害防控效果
生防泥炭的制备(Khabbaz & Abbasi,2014):盆栽前1 d,将培养48 h的生防菌液离心后用生理盐水重新悬浮(1×109CFU·mL-1),与灭菌泥炭粉按1∶10(V∶m)的比例制备成生防泥炭(1×108CFU·mL-1)。
温室盆栽试验:疫霉菌P. capsiciIt263经PDA平板培养7 d后,于菌落边缘打孔直径为0.5 cm的菌饼并挑取16块菌饼于灭菌的培养皿中,加水淹过表面,每隔30 min换水1次,第4次换水后将10 mL洗液注于灭菌的PDB液体培养基并于26 ℃、180 r·min-1黑暗条件下振荡培养120 h,双层灭菌纱布过滤,显微镜下利用血球计数板对游动孢子计数,并用无菌水稀释成浓度为1×106个·mL-1孢子悬浮液,与过20目筛的健康水稻土按1∶10(V∶m)比例混合制备成感病盆栽土。盆栽时,每盆(直径15 cm)加入600 g感病土,播种8粒辣椒种子,每粒种子均涂裹上述制备好的生防泥炭,以无菌泥炭(不含生防菌和病原菌)处理作为阴性对照,以单接种病原菌处理为阳性对照,以0.6 g·L-1苯菌灵为农药处理,每个处理8次重复,每盆为1个重复。正常管理至第15天时,调查疫霉病害发生情况,统计病情指数,称量植株鲜质量,同时采集不同处理植株根系与根际土壤样品,混匀后存放于-80 ℃冰箱,备用。
疫霉病发病情况采用4级分类统计(Khabbaz et al.,2015):1级,植株健康无症状;2级,根部或茎部褐色;3级,植株死亡;4级,种子未萌发。


1.6 根围疫霉菌侵染数量的Realtime-PCR检测
采用试剂盒法提取根围土壤基因组总DNA与辣椒根组织的基因组总DNA,以辣椒疫霉菌特异性引物 Pc1(Pc1F:5′-GTATAGCAGAGGTTTAGT GAA-3′/Pc1R:5′-ACTGAAGTTCTGCGTGCGTT-3′)进行 Realtime-PCR 扩增(Lan et al.,2013)。20 μL PCR扩增反应体系为:3 μL(1/10稀释)cDNA,1 μL 0.5 μmol·L-1引 物(F/R),10 μL SYBR green master mix,其余体积用ddH2O补足。扩增反应条件为:94 ℃ 5 min;94 ℃ 30 s,66 ℃ 60 s,72℃ 30 s,40个循环。阴性对照以无菌超纯水替代,以添加3 ng·μL-1疫霉菌DNA模板为阳性对照。每次运行均设标准曲线,并重复3次。标准曲线制备:疫霉菌经PDB在26 ℃、150 r·min-1条件下培养5 d后,采用试剂盒法提取疫霉菌总DNA,经核酸浓度仪测定后依次稀释为 30、3、0.3、0.03、0.003、0.000 3 ng·μL-1共计6个浓度的标准曲线模板,用于标准曲线绘制和样品病原菌浓度计算(Abbasi et al.,2009)。
1.7 数据处理与分析
数据经Excel 2010软件统计分析,并采用SAS 9.1软件进行方差分析,显著性水平采用 Duncan’s新复极差法分析。
2 结果与分析
2.1 菌株分离
通过平板稀释法对水稻土壤样品中的可培养细菌进行分离和纯化,共获得167株细菌菌株。
2.2 疫霉菌拮抗菌株筛选
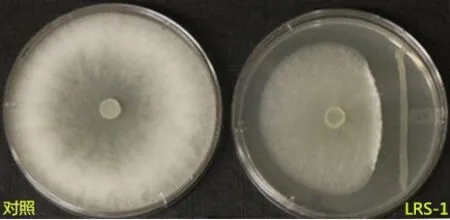
图1 拮抗菌LRS-1对辣椒疫霉菌的抑制效果(7 d)
通过平板对峙法对上述分离得到的细菌菌株进行疫霉菌拮抗测试,结果发现有1株菌株对辣椒疫霉菌具有拮抗效果(图1),占总分离细菌数量的0.60%。该菌接种后7 d抑菌率为68.16%,28 d抑菌率为67.86%,总体抑菌效果良好且持久性较强,命名为LRS-1。
2.3 拮抗菌LRS-1的种属鉴定
将测序得到的拮抗菌LRS-1的16S rRNA基因序列提交至GenBank并获得登录号MG696219。测序结果经BLAST同源性比对发现,菌株LRS-1与多粘类芽孢杆菌Paenibacillus polymyxaAMHSOQ302等的同源性达到99%。将菌株序列与上述高度同源性的菌株序列进行多重比对并构建系统发育树,LRS-1与对应模式菌株聚集在相同分支上,其种属遗传关系也一致(图 2)。
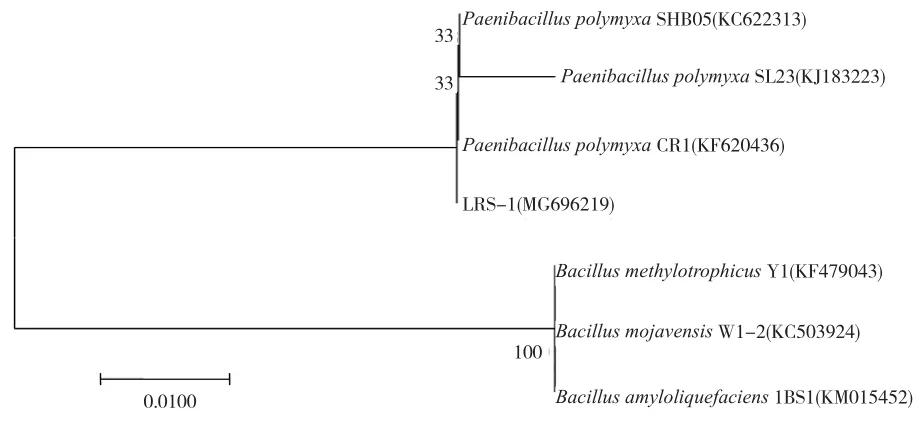
图2 基于16S rRNA 区域的生防菌株系统进化树
2.4 拮抗菌LRS-1对辣椒疫霉病的温室防控效果
盆栽15 d后,疫霉菌阳性对照的病情指数高达84.38,而接种拮抗菌LRS-1处理对辣椒疫霉病的防控效果达63.4%,病情指数显著降低,其总体防控效果与农药苯菌灵处理无显著差异。此外,与无菌泥炭对照相比,接种拮抗菌LRS-1处理的植株鲜质量显著增加了15.59%(表1)。
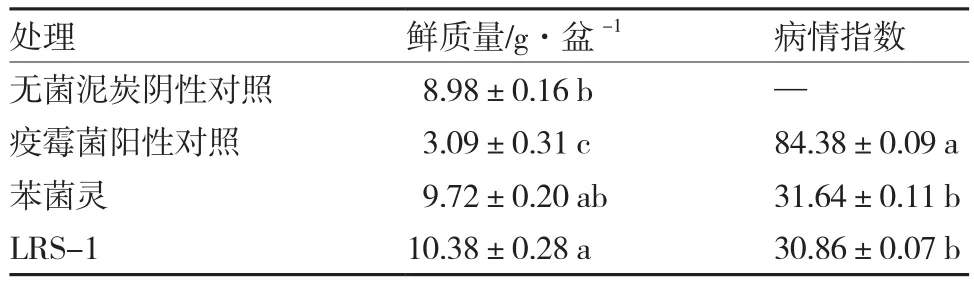
表1 拮抗菌LRS-1对辣椒疫霉病的温室防控效果
2.5 拮抗菌LRS-1对辣椒根围疫霉菌侵染数量的影响
Realtime-PCR结果表明,接种拮抗菌LRS-1处理15 d后,辣椒根围土壤与辣椒根系所受疫霉菌胁迫强度均显著降低。与疫霉菌阳性对照相比,接种LRS-1与农药苯菌灵处理的根围土壤中疫霉菌浓度分别降低了81.70%和78.78%,植株根系中疫霉菌浓度则分别降低了85.93%和81.16%,且2个处理所受胁迫的病菌浓度无显著差异(表 2)。
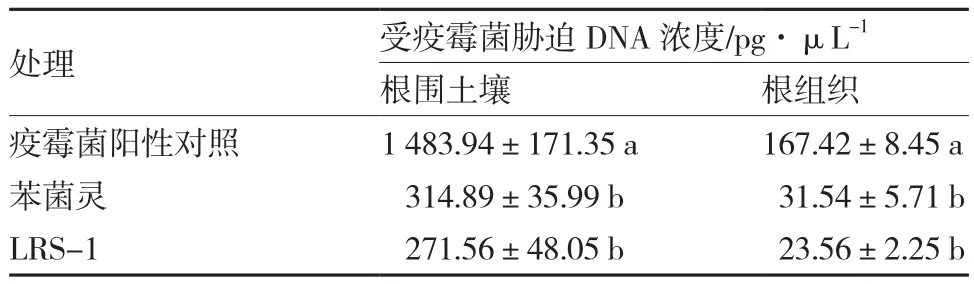
表2 接种拮抗菌LRS-1对辣椒根围土壤与根系的影响
3 结论与讨论
利用拮抗微生物来抑制土传病害的传播、发生已成为生物防治与土壤生态修复领域的研究热点,然而如何获取兼具优良抗病效果和环境适应能力的生防菌株却是人们无法忽视的难点(Babalola,2010;Dutta & Podile,2010;Berendsen et al.,2012;Prashar et al.,2014)。本试验以为辣椒疫霉病生物防治工作筛选合适生防菌种为出发点,从水稻土壤中分离出167株细菌菌株,并成功筛选获得了1株对辣椒疫霉菌具有良好且持久拮抗能力的细菌菌种LRS-1,其室内抑菌率始终维持在68%左右。研究发现,采用混有拮抗菌的泥炭粉包裹黄瓜种子可以有效降低黄瓜疫霉病的发病程度,并提高健康黄瓜幼苗的存活数量(Khabbaz et al.,2015)。基于此方法,温室盆栽试验结果显示,与疫霉菌阳性对照相比,采取种子包裹法接种拮抗菌LRS-1发酵液,能够大幅降低辣椒疫霉病病情指数,防控效果与化学农药苯菌灵相当;此外,试验结果还显示了拮抗菌LRS-1的促生能力,与无菌阴性对照相比,接种LRS-1处理的植株鲜质量显著增加了15.59%。经16S rRNA鉴定,拮抗菌LRS-1属于多粘类芽孢杆菌。多粘类芽孢杆菌已被证实为一类重要的生防微生物,对烟草黑胫病、辣椒疫霉病、荔枝霜疫霉病等多种土传病害具有良好的防控效果(陈海英 等,2010;梅新兰 等,2010;曹明慧 等,2011),本试验所筛选获得的多粘类芽孢杆菌LRS-1可为后续更广阔的生防试验与防治应用提供优良的生防菌株材料。
应用拮抗菌对土传病害进行生物防治对发展“绿色农业”与保护生态环境具有十分重要的现实意义。大量研究结果证实,生防菌对土传病害的防控机制是多样的、协同的、综合的,可能涉及抑菌、定殖、诱导等多方面的作用机理(刘丹丹 等,2016;张亮 等,2017;张楠 等,2017)。本试验发现在“植物-病原-拮抗菌-土壤”体系互作过程中,多粘类芽孢杆菌LRS-1对辣椒根围土壤和根系组织中疫霉病原菌的侵染具有显著的抑制效果,暗示了该菌株在土壤生存适应、生防菌内生化以及拮抗能力发挥等方面可能存在相关的机理亟待研究。此外,生防菌在野外田间的实际应用效果是评价其对土传病害现实生物防控能力的必然要求(Weller et al.,2002;黄新琦和蔡祖聪,2017),今后亦将对拮抗菌LRS-1在田间自然条件土壤环境中的防病效果开展进一步的相关试验,以求为该生防菌株在田间复杂土壤生态环境中能够发挥其应有的防病促生作用提供必要的理论依据。

