CuCl2催化氧化合成环己酮
陈秀丽,孟洋洋,李荣香,张 敏,刘晶菊
(郑州师范学院 化学化工学院,河南 郑州 450044)
环己酮是重要的有机化工原料,是制造己二酸、尼龙-66、己内酰胺等材料的中间体,同时也是重要的有机溶剂[1-2]。例如,用作指甲油等化妆品的高沸点溶剂,通常与低沸点溶剂和中沸点溶剂配制成混淆溶剂,以得到合适的挥发速率和黏度[3-4]。目前工业上制备环己酮的方式按起始材料主要可以分为苯法和苯酚法,国外将近四分之三的环己酮生产用苯作原料,此外四分之一常以苯酚作原料。苯法还可以进一步分为环己烷法及环己烯法[5]。(1)苯酚法。工业化制备环己酮最早使用的是苯酚法,即采取镍作催化剂,苯酚为起始材料,通过催化加氢得到环己醇。苯酚法制得的环己酮质量好、纯度高,但该方法由于原料苯酚缺乏且价格昂贵而受到限制。如今仅美国少数公司自产苯酚生产己内酰胺。因此,苯酚法制备环己酮从经济性角度考虑并不适用[6]。(2)环己烷法。环己烷法包括苯加氢、环己烷氧化、分解、醇酮精制、烷塔、精制等部分。苯加氢法又分为气相、液相加氢两种。工业上普遍采取气相加氢的方式,即在一定压力下,气相的苯与氢气进行加氢反应生成环己烷,然后在空气中氧化生成环己醇和环己酮,此法有废碱液产生。分离醇酮后可获得环己酮,得到的环己醇也可以在一定条件下脱氢生成环己酮[7]。(3)环己烯法。上世纪,日本公司旭化成领先研究出可使原料苯的使用率达99.5%左右的苯部分加氢环己烯法。在钌系催化剂作用下,苯首先进行部分加氢,生成主产物环己烯及少量环己烷,再进行分离,得到的环己烷可用于销售,环己烯则可在硅系催化剂作用下发生水合反应,生成环己醇。在铜-硅催化剂作用下,环己醇脱氢即获得环己酮[8]。铬酸氧化法[9-10]是实验室常用制备环己酮的方法。上述环己酮制备方法在生产实验过程中均具有能耗高,收率低,污染较大等缺陷,不符合绿色化学的思想理念,因此环己酮的生产受到一定限制。本文以C6H2O为配料,采用氧化剂H2O2,分别以MnCl2,SnCl4,CuCl2催化氧化环己醇制备环己酮,该方法污染较小,遵守4R规则[11],是一条合成环己酮的有效途径,体现了绿色化学的思想理念,且该研究鲜见文献报道。
1 实验部分
1.1 主要试剂及仪器
环己醇:分析纯,天津市光复精细化工研究所;双氧水:分析纯,质量分数为30.0 %,郑州派尼化学试剂厂;氯化铜:分析纯,国药集团化学试剂有限公司;氯化锰:分析纯,国药集团化学试剂有限公司;氯化锡:分析纯,上海孚一生物科技有限公司;氯化钠:分析纯,天津市富宇精细化工有限公司;无水碳酸钠:分析纯,天津市博迪化工有限公司;无水乙醇:分析纯,天津市东丽区天大化学试剂厂;丙酮:分析纯,天津市化学试剂一厂;乙醚:分析纯,天津市富宇精细化工有限公司;3A型分子筛:25~67目,天津市科密欧化学试剂开发中心。
FTIR-650傅里叶变换红外光谱仪:天津港东科技发展股份有限公司;WAY-2S数字阿贝折射仪:上海仪电物理光学仪器有限公司。
1.2 环己酮的合成
按一定体积比量取环己醇(20.00mL)和30%H2O2,加入带有温度计、滴液漏斗及回流冷凝管的三颈烧瓶中,并用电子天平称取一定量催化剂加入混合液里,使用空气浴控制合适的反应温度,控制滴液漏斗缓慢滴加H2O2,在适宜的温度范围内保持一定的滴速。待双氧水滴加完全后保持控制温度并不断搅拌,继续反应一定时间使环己醇和双氧水完全反应,此时三颈烧瓶内的液体出现明显的分层,上层颜色较浅。停止回流改为蒸馏,在三颈烧瓶中添加60mL蒸馏水并加入几粒分子筛进行蒸馏,此时蒸出的是水和环己酮,直至馏出液清亮后再多蒸5min。将得到的馏分用一定量的NaCl饱和,完全饱和后转移到分液漏斗内,静置5min,分出上层有机层,用15mL乙醚萃取水层一次后,将萃取液和有机层归并,加入一定量的无水碳酸钠静置干燥,直至溶液中没有气泡。将干燥后的液体二次蒸馏,实验开始蒸出的是乙醚,当温度接近155℃时,用已称量过的锥形瓶收集馏分,此时得到的即是纯的环己酮。其制备流程如下:
环己醇﹢30% H2O2﹢催化剂→回流→回流液→蒸馏→环己酮﹢水→饱和、分层、萃取、干燥→再次蒸馏→纯环己酮。
实验的反应方程式为:

2 结果与讨论
2.1 CuCl2的催化性能
通过变换不同种类催化剂、催化剂用量、过氧化氢与环己醇体积比、反应时间及反应温度,探讨它们对环己酮产率的影响,实验步骤按1.2进行。以下实验数据为三次平行实验的平均值。
2.1.1 不同催化剂对环己酮产率的影响

表1 加入不同催化剂对环己酮产率的影响
由表1可知,与空白试验数据相比,反应中加入催化剂时,产物环己酮的产率明显增加,催化效果从高到低的顺序为:CuCl2>SnCl4>MnCl2。CuCl2催化效果达到67.78%,因此选用CuCl2作催化剂。
2.1.2 CuCl2用量对环己酮产率的影响
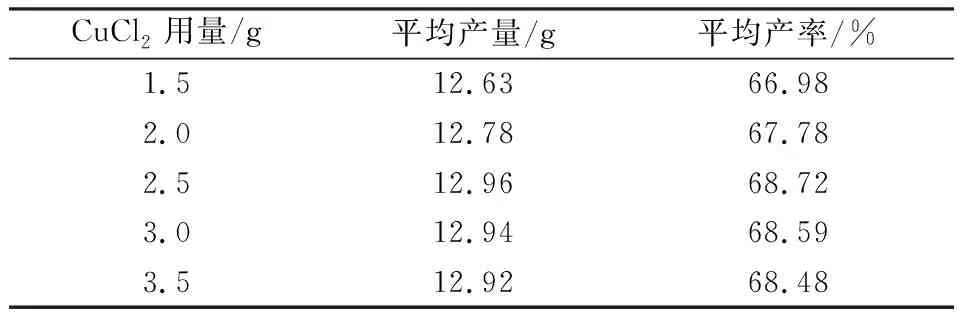
表2 CuCl2用量对环己酮产率的影响
表2明显可以看出,增加CuCl2的用量可以提高环己酮的产率,当CuCl2用量为2.5g时,环己酮平均产率最高,产率达到为68.72%,继续增加CuCl2质量,环己酮产率变化不大。因此,CuCl2的最佳实验用量为2.5g。
2.1.3 过氧化氢与环己醇的体积比对环己酮产率的影响
由化学平衡原理可知,增加反应物的比值可以提高实验产率。在添加2.5g CuCl2,保持反应温度为70~80℃,反应时间为55min的前提下,通过变换过氧化氢与环己醇(20.00mL)的体积比来探讨其对环己酮产率的影响,实验数据如表3所示。

表3 过氧化氢与环己醇的体积比对环己酮产率的影响
由表3中数据可以看出,H2O2用量对环己酮产率有明显的影响,当增添过氧化氢与环己醇的体积比大于11时,环己酮产率逐渐下降。这主要是因为过量的过氧化氢会把环己醇深度氧化,生成过氧化产物羧酸。因此在其他实验条件不变,过氧化氢与环己醇体积比为11时,环己酮平均产率达到最高(68.72%)。
2.1.4 反应时间对环己酮产率的影响
在加入2.5g CuCl2,过氧化氢与环己醇体积比为11,并保持反应温度为70~80℃条件下,选取不同的反应时间,探讨反应时间对环己酮产率的影响,所得数据如表4所示。

表4 反应时间对环己酮产率的影响
由表4可以看出,实验的反应时间对环己酮的产率有一定的影响。增长反应时间,环己酮产率不断提高,反应时间为55min时,产率达到最高,此后环己酮产率变化不大。由此可知,当实验反应时间为55min时,获得的环己酮平均产率最高。
2.1.5 反应温度对环己酮产率的影响
以加入2.5g CuCl2,过氧化氢与环己醇体积比为11且持续反应55min为前提条件,反应温度分别为60~70℃,70~80℃,80~90℃,进行一系列相应的反应温度单项实验,来确定最优反应温度及其对环己酮产率影响的大小,所得数据如表5所示。

表5 反应温度对环己酮产率的影响
由从表5可知,反应温度的高低对环己酮的产率有明显影响。主要因为反应物的活泼性会随着反应温度的增加而变大,实验产率也随之提高。但温度过高会发生过氧化反应,生成过氧化产物羧酸,还可能导致过氧化氢无效分解,产率就会下降。从表5中数据来看,当反应温度保持在70~80℃时,实验制得的环己酮平均产率最高。
2.2 环己酮的表征
用WAY-2S数字阿贝折射仪测得环己酮的折光率为1.4502,用微量法测得环己酮的沸点为155.0℃,与文献值[12]环己酮的沸点155.6℃,折光率1.4500~1.4510相一致。用FTIR-650傅里叶变换红外光谱仪测定所制备的环己酮液体红外吸收光谱,测得的红外光谱如图1所示。
从图1可以看出,环己酮的红外光谱吸收在3300~3000cm-1区间没有—OH吸收峰,在2960~2800cm-1有强的—C—H吸收峰,在1700cm-1左右有十分明显的—C=O强吸收峰,在1470~1400cm-1有—CH2—吸收峰。

图1 环己酮的IR谱图
3 结论
综上所述,以C6H12O为原料,H2O2作氧化剂,分别用MnCl2,SnCl4,CuCl2作催化剂,催化氧化制备环己酮,确定CuCl2的催化效果优于MnCl2和SnCl4。在本实验环境下,氯化铜催化氧化环己醇制备环己酮的最优实验条件为:CuCl2用量2.5g,环己醇20.00mL,30 %双氧水20.00mL,在70~80℃范围内反应55min,此条件下实验制备的环己酮产率最高达68.72 %。本文使用绿色的氧化剂H2O2、高效催化剂CuCl2,反应条件十分温和,操作简单方便,所用时间短,产率高,适合高等学校的有机化学实验教学。

