醇醚硫酸盐AES降解菌的筛选鉴定及生物降解特性研究
曾典 唐启玲 庞志宇 杜全能 兰时乐


摘要 为了获得阴离子表面活性剂醇醚硫酸盐(AES)降解菌并应用于AES的降解,从湖南丽臣实业股份有限公司污水处理池污泥中分离筛选到1株能以AES为唯一碳源生长且能高效降解AES的细菌,命名为Z-8。通过形态学观察、生理生化试验和16S rDNA序列分析及系统发育树的构建对菌株进行鉴定,探讨了AES初始浓度、温度、初始pH值和发酵时间对AES降解率的影响。结果表明,菌株Z-8被鉴定为Pseudomonas knackmussii Z-8,对AES的耐受力可达1 400 mg/L。适宜的降解条件为AES初始浓度400 mg/L、培养温度32 ℃、初始pH值9.0和发酵时间9~12 h,在此条件下,AES降解率达99.59%。试验结果显示了克氏假单胞菌Z-8在处理含AES废水中具有良好的应用前景。
关键词 醇醚硫酸盐(AES);菌株鉴定;生物降解;16S rDNA序列分析
中图分类号 X172 文献标识码 A
文章编号 1007-5739(2019)24-0138-04 开放科学(资源服务)标识码(OSID)
Abstract In order to obtain anionic surfactant alcohol ether sulfate(AES)degrading bacteria and apply to AES degradation.A strain named Z-8 was isolated from sludge of sewage treatment pond of Hunan Lichen Industrial Co.,Ltd.,which could grow with AES as the sole carbon source and degrade AES efficiently. The strain Z-8 was identified by morphological observation,physiological and biochemical tests,16S rDNA sequence analysis and phylogenetic tree construction. The effects of AES initial concentration,cultural temperature,initial pH value and fermentation time on AES degradation rate were discussed. The results showed that strain Z-8 was identified as Pseudomonas knackmussii Z-8,and its resistance to AES was up to 1 400 mg/L.The optimum degradation conditions were AES initial concentration 400 mg/L,incubation temperature 32 ℃,initial pH value 9.0 and fermentation time 9-12 h. Under these conditions,the degradation rate of AES reached 99.59%. The experimental results showed that Pseudomonas knackmussii Z-8 had a good application prospect in the treatment of wastewater containing AES.
Key words alcohol ether sulfate(AES);strain identification;biodegradation;16S rDNA sequence analysis
脂肪醇聚氧乙烯醚硫酸鈉(AES)是一种性能优良的阴离子型表面活性剂,因其具有优良的去污能力、乳化发泡性能、抗硬水性能以及生物降解性[1]而被广泛用于香波、浴液、餐具洗涤剂、复合皂等洗涤化妆用品中,其用量仅次于直链烷基苯磺酸盐(LAS)。尽管AES浓度低时危害并不明显,但浓度过高,会使皮肤干燥并破坏保护皮肤表面的自然油脂、蛋白质,以及通过皮肤被身体吸收进入肝脏,还可能造成男性精子成活率下降,提高女性患子宫癌和乳腺癌的机率[2]。AES进入土壤和水体后,能在水体中产生大量的持久性泡沫[3],阻断水体与空气的交换,减少水体中的溶解氧,影响水体中鱼类和水生无脊椎动物的生长,同时有研究表明长期接触和使用AES可降低小鼠血清中超氧化物歧化酶的含量,使得小鼠体内抗氧化能力的降低,从而影响其正常生理功能[4]。
目前已经报道污水中阴离子表面活性剂降解方法主要有振荡培养法、活性污泥模拟法、开放(密闭)法等[5]。对于从自然界分离纯化微生物并应用于非离子表面活性剂的降解主要集中于十二烷基苯磺酸钠(LAS)的降解研究。国内研究工作者分离出了能有效降解LAS的芽孢杆菌(Bacillus sp.)[6]、黄单胞菌(Xanthomonas sp.)[7]、可动苯基杆菌(Phenylobacter-ium mobile)[8]等,但对阴离子表面活性剂中的AES生物降解方面的研究较少,仅有董庆斌等[9]用活性污泥对AES进行了生物降解性的研究,而从自然界分离微生物并对微生物进行鉴定和研究AES微生物降解特性的研究,国内外未见文献报道。
目前,国内外对AES的研究主要侧重于其生产工艺[10]、贮存条件[10-13]、应用性能[3,14-15],但未发现研究AES的微生物降解菌种的筛选、生物降解工艺和生物降解特性。笔者从湖南丽臣实业股份有限公司污水处理池污泥中分离到1株能高效降解脂肪醇聚氧乙烯醚硫酸钠(AES)的细菌菌株Z-8,初步研究了AES浓度、发酵温度、培养基初始pH值和发酵时间等对AES降解的影响,以期为菌株Z-8对AES污染进行生物修复和拓宽其应用范围提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌株分离样品。取自湖南丽臣实业股份有限公司污水处理池中的污泥,置于无菌广口玻璃瓶中,立即带回实验室进行AES降解菌的富集和分离。
1.1.2 培养基。①富集培养基:AES 0.4 g,NH4Cl 3 g,MgSO4·7H2O 0.25 g,KCl 0.25 g,K2HPO4 1 g,FeSO4 0.001 g,H2O 1 000 mL,pH值7.2~7.4。②筛选培养基:培养基成分与富集培养基相同,另加2%的琼脂。③斜面培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,瓊脂20.0 g,H2O 1 000 mL,pH值7.0~7.2。④液体种子培养基:培养基成分与斜面培养基成分相同,但不加琼脂粉。⑤发酵培养基:AES 0.04%,NH4Cl 0.3%,MgSO4·7H2O 0.02%,KCl 0.02%,K2HPO4 0.1%,pH值7.0。
以上培养基均在121 ℃条件下灭菌25 min。
1.1.3 主要仪器与药品。主要仪器设备:电子天平(TMP-510,湘仪天平仪器设备有限公司);分析天平(AL204,梅特勒—托利多仪器有限公司);恒温培养箱(MJ-160C,上海博讯实业有限公司医疗设备厂);高温高压灭菌锅(SS-325,TOMY.KOGYO.CO.,LTD);单人单面超净工作台(SW-CJ-1B(U),苏州设备净化有限公司);DNA电泳槽(DYCP-31DN,北京六一仪器厂);稳压电泳仪(DYY-5,北京六一仪器厂);凝胶成像仪(FR980,上海复日科技仪器有限公司);PCR仪(2720 thermal cycler,Applied Biosystems);冷冻高速离心机(HC-2518R,BBI)。
主要药品:AES(70%,山东优索化工科技有限公司);NH4Cl、KCl、FeSO4、MgSO4·7H2O、K2HPO4(AR,国药集团化学试剂有限公司);琼脂(BP,合肥博美生物科技有限责任公司);牛肉膏、蛋白胨(BP,上海盛思生化科技有限公司)。
1.2 试验方法
1.2.1 培养。斜面培养:将保存于4 ℃冰箱中的菌种接种于斜面培养基表面,37 ℃恒温培养24~36 h,备用。液体种子培养:将活化后的斜面菌种接种于液体培养基中,37 ℃,170 r/min条件下恒温培养24 h。发酵培养:按2%(V/V)的接种量将培养好的液体种子接种于装有发酵培养基100 mL/300 mL三角瓶中,37 ℃,170 r/min条件下恒温培养48 h,测定培养液中AES含量,并计算AES降解率。3次重复。
1.2.2 菌种的筛选与鉴定。
(1)菌种初筛与复筛。称取5.00 g污泥样品接入100 mL富集培养基中,于37 ℃、170 r/min恒温振荡培养箱中富集培养3 d后,按照10倍稀释法[16]将富集液进行稀释,取最后3个不同稀释度的稀释液0.1 mL涂布于筛选培养基平板上,涂布均匀,于37 ℃细菌培养箱培养至长出单菌落。挑取单菌落于选择培养基平板表面划线纯化,直至显微镜镜检时菌体形态一致为止,保存并编号。将保存于斜面的菌株分别接入液体种子培养基中,37 ℃,170 r/min条件下振荡培养24 h后,按2%(V/V)的接种量接入含400 mg/L AES的发酵培养基中,同样条件下恒温振荡培养48 h,分别测定培养液中AES的含量,并计算AES的降解率。
(2)形态学及生理生化特征。将分离得到的AES降解菌涂布于牛肉膏蛋白胨固体培养基表面,置于37 ℃恒温培养箱中培养24 h,观察菌落形状、大小、颜色、表面特征及革兰氏染色。菌株的生理生化试验参照文献[17]中方法进行。
(3)16S rDNA基因序列及系统发育分析。用牛肉膏蛋白胨液体培养基培养菌株Z-8 24 h后,采用上海生工生物工程Ezup柱式细菌基因组DNA抽提试剂盒进行DNA提取。以提取的基因组DNA为模板,扩增16S rDNA基因片段。正向引物序列:27F:5′-AGTTTGATCMTGGCTCAG-3′,反向引物序列:1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR扩增反应体系为25 μL,包括Template(基因组DNA 20~50 ng/μL)0.5 μL,10×Buffer(含Mg2+)2.5 μL、dNTP(2.5 mmol/L)1 μL、Taq酶0.2 μL、正向引物(10 μmol/L)0.5 μL、反向引物(10 μmol/L)0.5 μL,加双蒸水定容至25 μL。PCR 反应条件:94 ℃预变性4 min,94 ℃变性45 s;55 ℃退火45 s;72 ℃延伸1 min;30个循环;72 ℃修复延伸10 min;4 ℃保存。测序由上海生工生物工程有限公司完成。通过BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)将16S rDNA序列与GenBank数据库中的序列进行比对,并提交给GenBank。采用NJ法,用MEGA7.0.26构建系统发育树。
1.2.3 菌株Z-8降解AES特性研究。
(1)AES浓度对菌株Z-8降解AES的影响。在培养基中分别添加400、600、800、1 000、1 200、1 400 mg/L的AES,于37 ℃、170 r/min条件下培养48 h,其他条件不变,测定培养液中AES含量,并计算AES的降解率。
(2)培养温度对菌株Z-8降解AES的影响。在上述试验结果的基础上,将三角瓶分别置于28、30、32、35、37 ℃条件下,170 r/min恒温振荡培养培养48 h,其他条件不变,测定培养液中AES含量,并计算AES的降解率。
(3)培养基初始pH值对菌株Z-8降解AES的影响。在上述试验结果的基础上,用稀酸或稀碱调节培养基初始pH值分别为3、5、7、9和11,其他条件不变,测定培养液中AES含量,并计算AES的降解率。
(4)培养时间对菌株Z-8降解AES的影响。在上述试验结果的基础上,将三角瓶在适宜的条件下培养,每隔3 h取样测定发酵液中AES含量,并计算AES的降解率,直至培养48 h为止。
1.2.4 AES含量测定。
(1)发酵液预处理。将培养好的发酵液于4 ℃,10 000 r/min条件下离心15 min,取上清液,测定AES的含量。以不接种为对照。
(2)AES含量测定。参照文献[18]提供的亚甲蓝比色法(美蓝法)进行测定。AES降解率计算公式如下:
D(%)=(m0-mn)/m0×100
式中:D为第n小时后AES的降解率(%);m0为初始表面活性剂质量(mg);mn为第n小时后表面活性剂质量(mg)。
2 结果与分析
2.1 AES降解菌的筛选与鉴定
2.1.1 AES降解菌的初筛与复筛。通过富集、筛选培养后,共得到8株能以AES为唯一碳源生长的细菌菌株,分别命名为Z-1、Z-2、Z-3、Z-4、Z-5、Z-6、Z-7、Z-8。将8株菌株分别接入含400 mg/L AES的发酵培养基中,37 ℃、170 r/min条件下恒温振荡培养48 h后,分别测定培养液中AES的含量,并计算AES的降解率。结果见图1。可以看出,不同菌株在上述条件下对AES的降解率不同。所分离的菌株中,菌株Z-8对AES的降解率最强,达到99.67%。其他7个菌株对AES的降解率均<60%。因而选择菌株Z-8为试验菌株进行后续试验。
2.1.2 菌株Z-8形态学观察。菌株Z-8在以AES为唯一碳源的筛选培养基上菌落灰白色、圆形、表面潮湿、边缘整齐、不透明。在光学显微镜下菌体为短杆状、无芽孢、革兰氏染色为阴性。
2.1.3 生理生化试验结果。菌株Z-8生理生化指标见表1。
2.1.4 系统发育树构建。菌株Z-8的16S rDNA测序结果在GenBank中进行Blast比对分析,其序列全长为1 404 bp,与假单胞菌属的16S rDNA基因序列相似度最高。選择Pseud-omonas aeruginosa(GQ926936.1)作为外类群,采用NJ法,用MEGA7.0.26构建与假单胞菌属部分模式种16S rDNA基因系统发育树。结果见图2。
由图2可知,菌株Z-8与Pseudomonas knackmussii(HG322950.1)的亲缘关系最近,同处一个进化分支。综合菌落形态特征、生理生化特征和16S rDNA基因序列分析以及系统发育树构建结果,将菌株Z-8初步鉴定为Pseudomonas knackmussii Z-8。
2.2 菌株Z-8降解AES特性研究
2.2.1 初始浓度对菌株Z-8降解AES能力的影响。从图3可以看出,菌株Z-8在AES初始浓度400~1 400 mg/L均具有降解AES的能力。当AES浓度在400~800 mg/L范围内,其降解率均>90%,而在培养基中AES初始浓度为400 mg/L时,AES降解率最大,达到了99.38%。但随着培养基中AES浓度的增加,AES降解率下降。当培养基中AES初始浓度达到1 400 mg/L时,AES的降解率仅为2.87%,表明高浓度的AES对菌株Z-8具有显著的生长抑制作用,从而影响其降解效率。因此,选择培养基中AES初始浓度为400 mg/L进行后续研究。
2.2.2 培养温度对AES降解率的影响。培养温度主要影响细胞内代谢酶的活性、细胞膜的流动性和通透性以及影响物质的溶解度,从而影响微生物的生长和代谢。培养温度低,代谢酶活性低;培养温度高,代谢酶容易变性失活,均会造成细胞内酶促反应的下降,影响细胞内生物物质的合成。温度对AES降解率的影响结果见图4。可以看出,当培养温度为32 ℃时,AES的降解率最高,达99.54%;随着培养温度的升高,AES的降解率缓慢下降。在30~37 ℃培养温度范围内,AES降解率均>99%,但彼此之间差异不显著。因此,选择培养温度为32 ℃进行后续试验。
2.2.3 pH值对AES降解率的影响。由图5可知,培养基pH值对菌株Z-8降解AES的影响较大,在一定的pH值范围内,随着培养基pH值的升高,AES的降解率也随之提高。当培养基初始pH值为9.0时,AES降解率达到99.47%,但当培养基初始pH值>9.0,AES降解率显著下降。主要原因为环境的酸碱度能引起细胞膜电荷的变化和细胞内电解质的平衡以及细胞结构的改变,影响细胞对营养物质的吸收和代谢酶系的活性,从而降低细胞对AES的利用率。
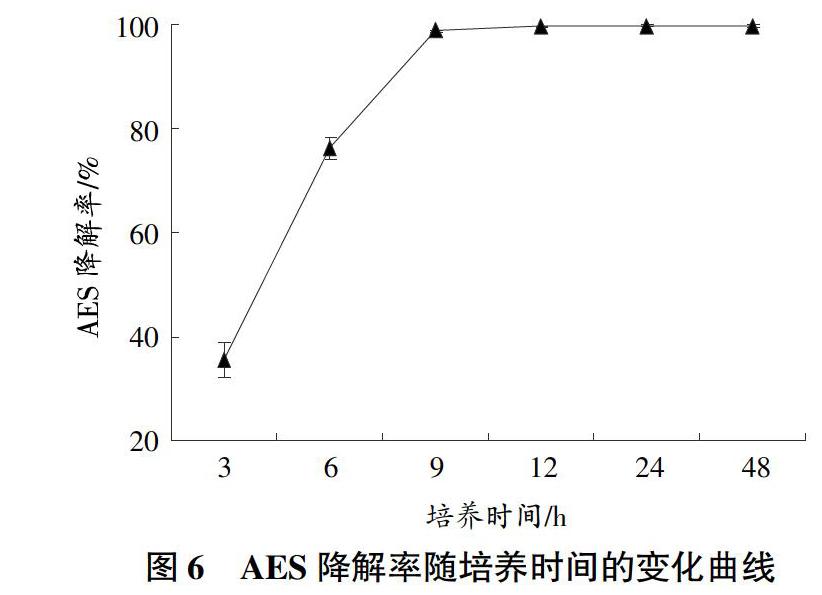
2.2.4 培养时间对AES降解率的影响。由图6可知,AES降解率随着培养时间的延长而提高。当培养时间为9 h时,AES降解率达到98.78%,继续延长培养时间,虽然在12~48 h内,AES降解率均>99%,但各处理之间差异并不显著。因此,选择培养时间为9~12 h。
3 结论
从湖南丽臣实业股份有限公司污水处理池污泥中筛选到1株能以AES为唯一碳源的AES高效降解菌株Z-8,根据16S rDNA基因序列分析比对及形态学观察和生理生化特征,将其鉴定为Pseudomonas knackmussii Z-8。AES生物降解特性试验表明,菌株Z-8能适应高浓度醇醚硫酸盐,其浓度可达1 400 mg/L。AES浓度、培养温度、培养基初始pH值和培养时间对AES降解率影响结果表明,在AES初始浓度为400 mg/L,培养温度32 ℃,培养基初始pH值9.0和培养时间9~12 h条件下,AES降解率可达99.59%,表明该菌在处理含较高浓度AES废水中具有极好的应用前景。
4 参考文献
[1] CARACCIOLO A B,CARDONI M,PESCATORE T,et al.Characteristics and environmental fate of the anionic surfactant sodium lauryl ether sulphate(SLES)used as the main component in foaming agents for mechanized tunneling[J].Environmental Pollution,2017,226(1):94-103.
[2] 俞凌云,孙冬梅.阴离子表面活性剂测定方法的研究[J].皮革科学与工程,2009,19(2):72-76.
[3] DENG Q H,LI H P,SUN H Y,et al. Hyperbranched exopolysaccharide-enhanced foam properties of sodium fatty alcohol polyoxyethylene ether sulfate[J].Colloids and Surfaces B:Biointerfaces,2016,141:206-212.
[4] 全立群,鮑柱仁,王秀敏.脂肪醇聚氧乙烯醚硫酸盐(AES)残留对小鼠超氧化物歧化酶SOD的影响[J].中国继续医学教育,2015,7(14):53-54.
[5] 冯瑜,张广良,宋鹏,等.表面活性剂生物降解性及其法规[J].日用化学品科学,2014,37(6):33-39.
[6] 刘秀荣,吕晓猛,纪树兰.微生物降解直链十二烷基苯磺酸钠的研究[J].北京工业大学学报,1995,21(4):103-108.
[7] 张蔚文,张灼.降解直链烷基苯磺酸钠(LAS)菌株的筛选及降解质粒的研究[J].环境科学与技术,1991(3):2-6.
[8] 纪树兰,邓丽萍,郑大威,等.可动苯基杆菌对LAS生物降解机理的初步探讨[J].北京工业大学学报,2003,29(2):207-209.
[9] BATTERSBY N S,WILSON V.Survey of the anaerobic biodegradation potential of organic chemicals in digesting sludge[J].Applied and Environmental Microbiology,1989,55(2):433-439.
[10] 张东义.乙氧基化烷基硫酸钠硫酸化生产工艺技术分析[J].日用化学品科学,2016,39(10):34-37.
[11] 邓全花.无机盐调节l-卡拉胶与脂肪醇聚氧乙烯醚硫酸钠的相互作用提高泡沫稳定性[C]//中国化学会.中国化学会第十五届胶体与界面化学会议论文集(第六分会).武汉:中国化学会,2015.
[12] 张明慧,孙永强,刘伟,等.窄分布脂肪醇聚氧乙烯醚硫酸钠的性能研究[J].日用化学工业,2016,46(7):397-399.
[13] 宋春丽.长链脂肪醇聚氧乙烯醚衍生物的合成与性能[D].无锡:江南大学,2013.
[14] WANG Q,WANG D,WANG H,et al.Influence of alkyl polyglucoside and fatty alcohol ether sulfate on the foaming and wetting properties of sodium dodecyl benzene sulfonate for mine dust control[J].Powder Technology,2019,345:91-98.
[15] XU L,XU G,GONG H,et al.Foam properties and stabilizing mechanism of sodium fatty alcohol polyoxyethylene ether sulfate-welan gum composite systems[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2014,456:176-183.
[16] 杜连祥.工业微生物学实验技术[M].天津:天津科学技术出版社,1992.
[17] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[18] 董庆斌,赵永红,张广良,等.醇醚硫酸盐(AES)生物降解性的研究[J].印染助剂,2017,34(9):32-35.

