肠黏膜屏障与慢性肾脏病关系的研究进展
余 超 综述, 王 贞 审校
(同济大学附属第十人民医院肾脏风湿科,上海 200072)
慢性肾脏病(chronic kidney disease,CKD)患病率高达10.2%~16.2%。多数终末期肾病(end stage renal disease, ESRD)患者处于慢性持续性炎症状态,这种状态易诱发心血管疾病,增加动脉粥样硬化、精神抑郁、血管钙化等风险,引起恶病质、贫血、消化不良等并发症,加速CKD的恶化[2-3]。CKD是炎症放大和持续性激活的培养基。ESRD患者血浆中炎症细胞播散性活化,促炎症因子、趋化因子持续性升高,循环白细胞激活,并且释放大量活性氧自由基。氧化应激可激活肿瘤坏死因子(tumor necrosis factor,TNF)、核转录因子-κB(nuclear factor kappa B, NF-κB),刺激形成氧化脂蛋白和糖氧化产物,诱发大量炎症细胞活化进而导致全身炎症反应。反之,炎症也可激活免疫细胞引发的反应氧、氮和卤素类反应,在CKD的病程中形成恶性循环,加速疾病恶化,增加住院率和死亡率。
肠道是应激反应的中心器官,是多器官功能障碍综合征的发动机。因此,预防和避免CKD引起的肠道损伤,特别是维护肠黏膜屏障的完整性,对延缓CKD的发展及恶化具有重要意义。本文将对国内外有关CKD时肠黏膜屏障结构和功能改变的机制以及相关的治疗措施进行综述。
1 肠黏膜屏障的结构和功能
肠黏膜屏障主要由机械屏障、化学屏障、免疫屏障、生物屏障等组成的一种复杂防御体系。在机体中能有效地减少肠腔内抗原、细菌、微生物及代谢产物等有毒有害物质通过门静脉和淋巴系统进入体循环,将肠腔内物质和机体内环境相隔离,维持机体内环境的相对稳定。肠道机械屏障是肠黏膜上皮屏障,由肠黏上皮细胞、细胞间紧密连接与菌膜组成,是构成机体内外环境中最重要的屏障。肠黏膜上皮细胞之间形成紧密的质膜融合,可封闭细胞间顶部间隙,使质膜之间缝隙消失,抵御有毒有害物质入侵机体,维持肠上皮屏障功能。生理情况下,肠腔内物质可通过穿细胞途径和细胞旁途径进入黏膜组织。上皮细胞顶部间隙通过扩散和主动运输的方式调节细胞间溶质、水和电解质的交换保证机体内环境的相对稳定。这种细胞间的紧密连接由多种功能各异的蛋白质组成,主要包括闭合蛋白(claudins)、连接黏附分子(junction adhesion moleucule, JAMs)和咬合蛋白(occludin)3种完整的膜蛋白和闭锁小带蛋白-1(zonulaoccludens, ZO-1)等外周胞浆蛋白,对维持细胞间基本结构和功能以及肠道通透性起到重要作用。肠黏膜上皮细胞的紧密连接复合体在充满着细菌、微生物、毒素、抗原、消化酶、食物残渣的肠腔、肠周围组织和血循环之间构建了坚实的物理性屏障。
2 尿毒症对肠黏膜屏障结构的影响
肠黏膜上皮紧密连接结构是肠上皮屏障结构和功能的重要组成部分。尿毒症时肠道通透性增加,其潜在的原因可能是尿毒症损伤了肠黏膜上皮的紧密连接复合体。Vaziri等采用部分肾切除术和腺嘌呤灌胃两种方法制作了尿毒症大鼠模型,并检测尿毒症大鼠结肠组织黏膜上皮紧密连接复合体中重要蛋白的含量及分布。通过免疫组化和Western印迹法检测发现,尿毒症组大鼠结肠组织claudin-1、occludin和ZO-1的蛋白含量较对照组都有显著减少。在反转录-聚合酶链反应实验中发现升结肠组织occludin、ZO-1蛋白的信使RNA表达量增加。组织学病理显示,尿毒症组大鼠的肠黏膜固有层存在大量单核白细胞浸润,且结肠肠壁增厚,证实尿毒症会损伤肠黏膜上皮屏障,特别是破坏肠黏膜上皮紧密连接复合体。随后,Vaziri等对尿毒症大鼠的胃、空肠、回肠进行蛋白定性定量检测,发现尿毒症组的肠黏膜上皮紧密连接复合体较正常组显著减少。CKD可损伤肠黏膜屏障的结构,这可能是机体在无明确外源性感染的情况下出现内毒素血症的潜在机制。
3 尿毒症对肠黏膜屏障功能的影响
肠黏膜屏障功能障碍是指由各种原因引起肠黏膜完整性遭到破坏,肠绒毛发生萎缩、缺血、坏死、脱落,肠道通透性增加以及肠道菌群失调等。肠黏膜屏障功能发生障碍后,又易引起细菌和(或)内毒素发生易位,诱发和(或)加重全身炎性反应甚至最后发展成多器官功能障碍综合征[8-10]。肠黏膜屏障功能障碍对危重疾病的发生发展和转归都有重要影响。目前,大量研究证实在CKD进程中都出现了肠黏膜屏障功能障碍: (1) 在没有临床感染的尿毒症患者体内出现内毒素血症[11],该内毒素极可能来源于胃肠道。(2) CKD时肠道对高分子聚乙烯乙二醇等大分子的通透性增高[12]。(3) 研究[13]发现,尿毒症组大鼠肠壁和肠系膜淋巴结上都检测到了肠道细菌及其DNA片段,而在正常组则没有。同时,在经血液透析和未经血液透析治疗的ESRD患者血液中也检测到了肠源性微生物的DNA[13-14]。这些都表明在尿毒症时肠道内的ESRD微生物易转移进入人体血循环。(4) 组织学证据表明,包括食管炎、胃炎、十二指肠炎、小肠炎和结肠炎等消化道炎症性疾病在接受持续性血液透析治疗的ESRD患者中普遍存在[15]。CKD损伤肠黏膜屏障潜在发病机制可能与系统性炎症相关。
4 尿毒症诱导破坏肠黏膜屏障的机制
尿毒症引起的饮食、代谢、血液动力学变化等均可影响肠道微生态并引发病理改变。肠道内细菌的黏附攻击及其产生毒素的间接刺激,可引起肠黏膜上皮细胞结构改变和功能障碍,细胞的皱缩又会使细胞之间的紧密连接结构被破坏,严重者可引起肠黏膜机械屏障的破坏。Vaziri等[16]在体外实验中发现,尿毒症血液中存在着可破坏肠黏膜上皮细胞之间紧密连接蛋白的物质,这种物质可引起紧密连接结构成分的严重丢失。通过对尿毒症患者血液透析的治疗,可成功地清除部分破坏肠黏膜上皮紧密连接蛋白的有毒有害物质,对肠黏膜屏障起保护作用[17]。此外,Vaziri等[18]通过对人结肠上皮细胞培养基中加入尿素及尿素酶,发现尿素经过尿素酶催化生成氨后可进一步形成氢氧化铵,而氢氧化铵可溶解蛋白。实验证实,加尿素酶组跨膜电阻值下降,几乎全部结肠上皮细胞间的紧密连接蛋白都被消耗,单层细胞逐步分离,表明尿毒症毒素等大量在肠腔蓄积可加速肠黏膜屏障的破坏。
肾脏病可导致机体抗氧化能力下降、氧自由基产生异常增多。反之,过量的氧自由基又会引肾脏及其他组织器官损伤。氧化应激随着肾功能的减退而逐渐加重,活性氧家族在体内蓄积,通过促进紧密连接蛋白酪氨酸磷酸化或诱导肌动蛋白解聚合作用破坏肠黏膜屏障。前期动物实验表明,尿毒症大鼠血清及肠组织中超氧化物歧化酶、丙二醛、过氧化氢酶、谷胱甘肽过氧化物酶水平均显著增高,并出现肠黏膜绒毛脱落、变性水肿明显、腺体排列紊乱、肌层变薄、线粒体嵴稀疏紊乱。前期研究也发现TNF-α、IL-6和IL-10均参与了CKD诱导的肠黏膜屏障损伤[19]。Lau等[20]采用转录因子NF-E2相关因子2[transcription factor nuclear factor-erythroid 2(NF-E2)-related factor 2,Nrf2]激活剂修复Nrf2活性,发现可减轻CKD局部或系统性炎症,修复肠黏膜屏障。因此,多因素参与了尿毒症诱导破坏肠黏膜屏障,如图1。
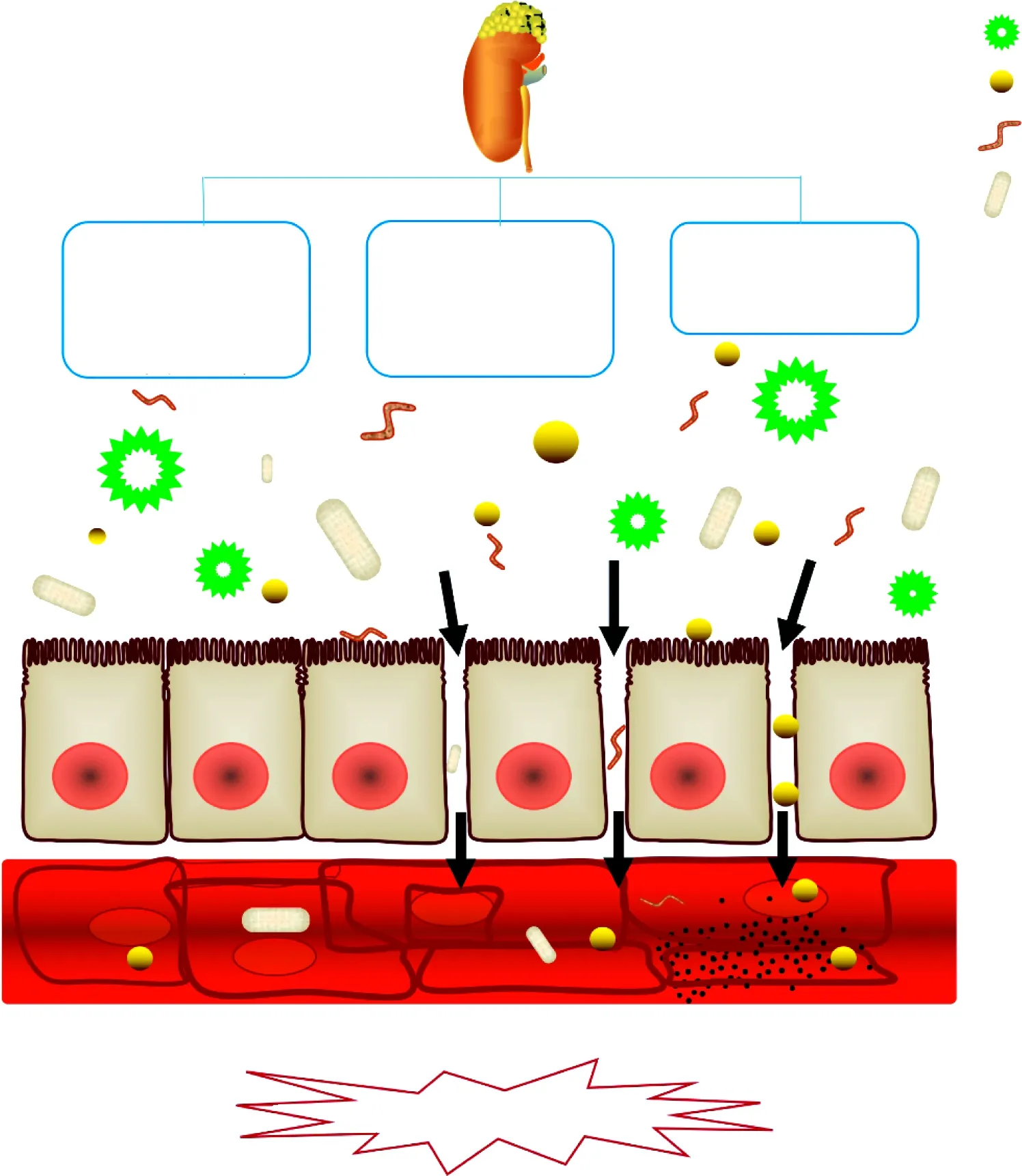
图1 尿毒症诱导破坏肠黏膜屏障的机制[8-19Fig.1 The mechanism of the intestinal mucosa barrier damage induced by uremia[8-19]
5 CKD肠黏膜屏障功能受损的其他影响因素
失代偿性充血性心力衰竭、肝硬化和门脉高压可导致机体存在肠壁水肿、局部缺血等缺血缺氧症状。肠黏膜上皮细胞有氧代谢障碍,ATP生成减少,细胞膜上的Na+-K+泵功能降低,引起肠壁细胞水肿、坏死和细胞连接断裂,坏死上皮脱落肠黏膜糜烂溃疡,导致肠黏膜上皮屏障损伤,严重者可引起内毒素血症和全身系统性炎症[17]。充血性心力衰竭、体内容量超负荷和广泛性水肿都是CKD长期伴有的并发症。临床上CKD患者常大剂量使用利尿剂,血液透析时超滤过多,这些都可引起机体间歇性低血压发作,血液重新分配,肠壁缺血水肿。此外,尿毒症持续性血液透析易引起血小板功能紊乱,激活胃肠道毛细血管抗凝系统[21]。Shi等[22]发现血液透析患者体内的血浆毒素浓度较未血透者更高,提出血液透析后的血浆是机体血浆毒素升高的起源,其机制与引起短暂性肠缺血相同。
6 CKD肠黏膜屏障功能受损的相关治疗措施
6.1 高纤维饮食
慢性肾脏病患者严格限制含钾丰富的水果和蔬菜,以防止高钾血症的发生。水果和蔬菜都是难消化复合碳水化合物的主要来源,是肠道共生微生物的主要底物。肠道微生物细菌可将膳食纤维转化为短链脂肪酸,作为肠上皮细胞和调节T淋巴细胞的必须营养素。Vaziri等[23]通过体内实验研究证实,高纤维饮食可减少机体氧化应激和炎症反应,改善结肠上皮细胞紧密连接结构的破坏,延缓肾功能不全的进展和肾脏病理损害。维持性血液透析患者长期服用膳食纤维后,其血清中尿毒症毒素、硫酸吲哚酚和对甲酚硫酸盐水平显著降低[24]。
6.2 口服吸附剂
吸附剂AST-120(Kremezin)活性炭具有吸附和修复的双重作用,可将肌酐、尿素氮及免疫复合物等这些有害物质,吸入自己的空隙结构排出体外,具有保护残肾功能、净化血液的功效[25]。研究[26]表明,口服AST-120可降低慢性肾脏病机体炎症和氧化应激反应,保护残肾功能,延缓慢性肾脏病的进程。Vaziri等[27]通过动物实验研究证实,口服AST-120可减弱由ESRD导致的肠黏膜屏障功能受损和结构破坏的严重程度。
6.3 口服小檗碱
小檗碱又名黄连素,是从毛莨科黄连属植物的根、茎部提取的异喹啉类生物碱,具有广谱抗菌作用。临床上不仅用于治疗细菌性痢疾、胃肠道炎症等感染性疾病,还用于降低血糖、血脂,抗肿瘤,改善心血管疾病等[28-29]。研究[30]提示,小檗碱能有效保护放疗引起的肠黏膜屏障损伤。近期研究显示,小檗碱可有效保护腹部手术时腹腔暴露造成的肠黏膜屏障损伤,减少细菌易位,并降低全身和局部的炎症反应。前期动物实验证实,口服小檗碱可减轻尿毒症大鼠氧化应激和炎症水平,改善尿毒症的肠黏膜屏障损伤。
7 展 望
ESRD患者体内各种代谢物排除减少,导致多种有毒有害物质滞留在机体,引起肠黏膜屏障受损,肠腔内的细菌及微生物代谢物等发生易位,最终引起全身系统性炎症反应,严重者甚至可发生多器官功能障碍。降低尿素水平,减少容量负荷,口服吸附剂,摄入高纤维食物[24-26],限水限钠等措施均可减少CKD对肠道屏障的损伤。此外,改善CKD患者的饮食和生活习惯[23,26],有助于预防和改善CKD对人体造成的进一步损伤,减轻由肾脏病带来的沉重经济负担。

