苦瓜中α-葡萄糖苷酶抑制剂的超滤质谱筛选研究
郭力菲,侯万超,赵婉伊,赵红磊,牛俊博,宋吉玲,孙鸣悦,何文丽,刘春明*
(长春师范大学中心实验室,吉林长春 130032)
α-葡萄糖苷酶抑制剂是一种临床常用的口服降糖药物,它能够抑制小肠内α-葡萄糖苷酶的活性,延缓或抑制葡萄糖在肠道内的吸收,从而达到降低餐后高血糖的作用[1-2]。目前,从天然药物或者植物中筛选α-葡萄糖苷酶抑制剂的研究已成为热点。苦瓜(Momordica charantia)为葫芦科苦瓜属植物,其根、茎叶及果实皆可入药,具有清热解毒的作用[3]。苦瓜果实也是一种经常食用的蔬菜,很多文献报道其化学成分具有很好的降血糖功效[4-6]。董义研究了6种保健食品原料的降糖效果,认为苦瓜的降糖效果最好[7]。彭晓赟等[8]研究了苦瓜根总皂苷提取物对α-葡萄糖苷酶活性的作用,并得到α-葡萄糖苷酶抑制活性最好的皂苷提取工艺。刘慧娟等[9]研究了7种苦瓜皂苷单体化合物对α-葡萄糖苷酶的抑制作用,证明皂苷是苦瓜抑制α-葡萄糖苷酶活性的主要物质基础。从苦瓜提取物中筛选出有效的活性成分,不仅能了解其降糖机制,还能为寻找新的治疗糖尿病药物提供实验基础。
超滤质谱技术是将超滤技术与质谱技术结合的一种药物筛选方法[10-11],主要是利用亲和原理将含有潜在活性的小分子物质与受体混合,形成复合物,通过超滤膜滤去未结合的小分子物质,以有机溶剂处理释放小分子配体,并采用液相-质谱联用技术进行鉴别。该方法具有分析速度快、无需预处理过程等优点,在药物筛选过程中具有广阔的应用前景。
本研究选择α-葡萄糖苷酶作为药物靶点,利用离心超滤和液相色谱-质谱联用的方法,从苦瓜提取物中筛选α-葡萄糖苷酶抑制剂,并利用LC-MS技术对筛选出的活性成分进行结构鉴定。
1 实验部分
1.1 仪器、试剂与样品
Agillent 1260 Infinity型高效液相色谱仪,配备UV检测器(Agillent,美国);Q Extractive 质谱仪()hermo Scientific,美国);3-30K高速冷冻离心机(Sigma,德国);G3旋转蒸发仪(Heidolph,德国);THZ-D恒温振荡器(大仓市实验设备厂);Integrel 3超纯水仪(Millipore,美国)。
苦瓜片,购自中东万家医药超市(长春);α-葡萄糖苷酶(α-Glucosidase, 100U),购自美国sigma公司;YM-10型Microcon超滤管,购自美国Millipore公司;醋酸铵(分析纯),购自天津科密欧试剂有限公司;乙腈(HPLC),购自美国Fisher公司;甲醇(分析纯),购自北京化工厂;实验用水为Millipore超纯水。
1.2 样品处理
取自然风干的苦瓜片,用粉碎机粉碎过60目筛。准确称取10.0g苦瓜干粉,按料液比1∶10加甲醇回流提取1h,过滤后,滤渣进行同样条件的二次提取,将两次提取的滤液合并浓缩至样品浓度为0.5 g/mL,过0.45μm滤膜,待用。
1.3 离心超滤筛选方法
分别移取50 μL 0.5 g/mL苦瓜提取物溶液和25 μL 1.0 U α-葡萄糖苷酶溶液,加入925 μL pH=6.8的10 mmol/L 的醋酸溶液中,置于37 ℃恒温振荡器中反应40 min,移取800 μL至截留分子量为10000的YM-10型超滤管中,于14000 r/min下超速离心30 min,向滤膜中加入100 μL 10 mmol/L的醋酸溶液(pH=6.8),离心清洗3次,洗去未结合成分。再向滤膜中加入100 μL甲醇(pH=3.3),在14000r/min下离心30min释放结合配体,重复2次,收集洗脱液,用于LC-MS分析。不加α-葡萄糖苷酶的空白实验处理方法同上。
1.4 LC-MS分析条件
色谱柱:5μm, 250mm×4.6mm;流动相:乙腈-水梯度洗脱(0min,40%乙腈;2min,60%乙腈;40min,100%乙腈;50min,100%乙腈)。流速:0.8mL/min。
质谱条件:离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;喷雾电压:3.3kV;鞘气流速:40psi(1 psi≈6.9 kPa);辅助气流速:10 psi;毛细管温度320℃;辅助气温度320 ℃;S-Lens分辨率:50;扫描范围:m/z150~2000Da;质量分辨率:70000。
2 结果与讨论
2.1 苦瓜化学成分与α-葡萄糖苷酶生物亲和作用研究
苦瓜提取物与α-葡萄糖苷酶作用和与不加α-葡萄糖苷酶的空白实验的高效液相色谱图如图1所示。当苦瓜提取物中的化学成分与α-葡萄糖苷酶发生特异结合后,α-葡萄糖苷酶捕获的配体所对应的峰面积均大于其空白对照。图1表明,苦瓜提取物中有5个化学成分与α-葡萄糖苷酶结合。
通过分别对比5个化合物在两种不同实验条件下的液相色谱图1a和图1b,考察化合物与α-葡萄糖苷酶的结合能力,结果如图1所示。由图1可知,在控制变量保证其它实验条件相同的情况下,该5个化合物与α-葡萄糖苷酶作用和与不加α-葡萄糖苷酶的空白实验的液相色谱比值明显较大。因此由图1a和图1b可推测该5个化合物与α-葡萄糖苷酶具有结合作用,可以抑制α-葡萄糖苷酶生物活性,具有潜在的2型糖尿病活性。
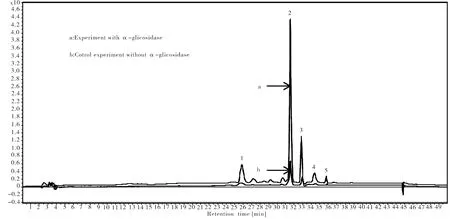
图1 苦瓜提取物的离心超滤HPLC图(a-与α-葡萄糖苷酶作用、b-空白试验)
2.2 液相色谱-质谱联用分析和结构鉴定
根据超滤亲和筛选出的5种化合物的保留时间和特征离子峰(表1),结合参考文献进行解析,结果见图2。
化合物1(tR25.86 min)的ESI-MS图谱显示,m/z 687.38[M+K]+,m/z 671.32[M+Na]+,由此判断该化合物的相对分子量为648。苦瓜皂苷K的分子式为C37H60O9,计算其相对分子质量为648,与此质谱信息吻合。图谱中还显示m/z 666.46[M+H2O]+,m/z 437[M+H-162-H2O-CO2],其中162代表失去一个葡萄糖基,进一步确定了该化合物的结构[9]。
化合物2(tR31.56min)的ESI-MS图谱显示,m/z 511.32[M+K]+, m/z 495.34[M+Na]+,由此判断该化合物的相对分子量为472。苦瓜素I的分子式为C30H48O4,计算其相对分子质量为472,与此质谱信息吻合。图谱中还显示m/z 437.34[M+H-2H20]+,m/z 419.33[M+H-3H2O]+进一步确定了该化合物的结构[12]。
化合物3(tR32.98min)ESI-MS图谱显示,m/z 671.39[M+K]+, m/z 655.34[M+Na]+, 633.44[M+H]+,计算其相对分子质量为632。苦瓜皂苷G的分子式为C37H60O8,计算其相对分子质量为632,与此质谱信息吻合。图谱中还显示m/z 471.38[M+H-162]+,m/z 439.36[M+H-162-CO2]+,进一步确定了该化合物的结构[6]。
化合物4(tR34.50min)ESI-MS图谱显示,m/z 701.40[M+K]+,m/z 685.43[M+Na]+,计算其相对分子质量为632。未能找到与之对应的化合物。
化合物5(tR35.88min)ESI-MS图谱显示,m/z 525.33[M+K]+,m/z 509.36[M+Na]+,m/z 633.44[M+H]+,计算其相对分子质量为486。查阅文献发现,(19R)-5β,19-epoxy-19-methoxycucurbita-6,24-dien-3β, 23-diol和 (19S)-5β,19-epoxy-19-methoxycucurbita-6,24-dien-3β,23-diol的分子式为C31H50O4,理论分子质量为486,与此质谱信息吻合[13]。

表1 苦瓜提取物中的活性成分鉴定
3 结论
通过超滤-质谱方法从苦瓜提取物中筛选出5种具有潜在α-葡萄糖苷酶抑制活性的化学成分,其中4种经初步鉴定为苦瓜皂苷K、苦瓜素I、苦瓜皂苷G、(19R)-5β,19-epoxy-19-methoxycucurbita-6,24-dien-3β,23-diol或 (19S)-5β,19-epoxy-19-methoxycucurbita-6,24-dien-3β,23-diol),1种暂未确定其结构。本研究为进一步开发基于苦瓜的降糖产品提供了依据。
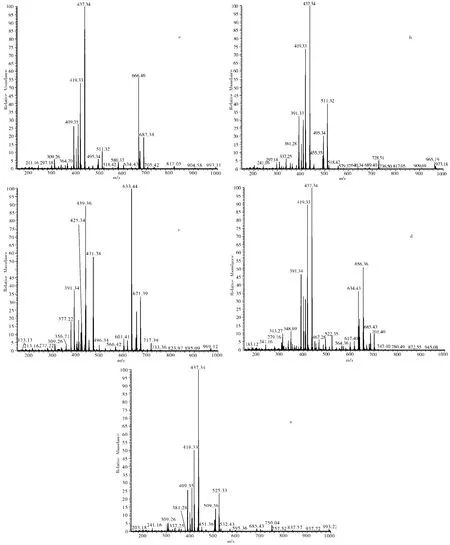
图2 化合物1~5的质谱数据
(a、b、c、d、e依次为苦瓜皂苷K、苦瓜素I、苦瓜皂苷G、未知、(19R)-5β,19-epoxy-19-methoxycucurbita-6,24-dien-3β, 23-diol或 (19S)-5β,19-epoxy-19-methoxycucurbita-6,24-dien-3β,23-diol)

