山核桃林地土壤真菌群落结构研究
李 皓,董建华,袁紫倩,胡俊靖,赵伟明
山核桃林地土壤真菌群落结构研究
李 皓,董建华,袁紫倩,胡俊靖,赵伟明
(杭州市林业科学研究院,浙江 杭州 310022)
采用16S rDNA高通量测序技术分析杭州临安区正常生长和不良生长状况2种山核桃林地土壤真菌群落结构。结果表明,生长不良山核桃林地与正常林地真菌优势类群相同,不同样地中子囊菌门Ascomycota、接合菌门Zygomycota、担子菌门Basidiomycota均为优势类群,但相对丰度不同,正常林地土壤中担子菌门和接合菌门的相对丰度高于生长不良林地。在属的分类水平上,正常林地土壤中小画线壳属、镰刀霉属和土赤壳属的相对丰度明显低于生长不良林地。生长不良林地土壤真菌多样性高于正常林地,Shannon-Wiener指数,ACE指数,Chao1指数与土壤pH之间呈显著负相关(<0.05),与有机质、碱解氮和交换性酸显著正相关(<0.05)。
山核桃;土壤真菌;群落结构;16S rDNA测序
山核桃为我国特有的干果和木本油料树种,主要分布于浙皖交界的天目山系[1]。浙江省杭州市临安区是山核桃主产区,种植面积和产量都居全国首位。由于长期采用高强度的经营方式,过量施用化肥和化学除草剂,许多林地土壤环境急剧恶化[2-3]。土壤环境的改变,导致山核桃生长不良,根系枝条死亡,产量大幅下降。要解决这一问题,亟需研究土壤环境发生了怎样的变化,以便提出山核桃林地土壤科学管理措施。
土壤微生物是土壤环境的组成部分,其种群结构对植物健康状况有影响。土壤微生物中,真菌除了在氨化、硝化、氮转化、纤维素分解过程中发挥着重要的作用[4-5]之外,还通过与植物相互作用,进而影响植物生长[6]。近些年,许多植物土壤微生物群落研究都采用高通量测序技术[7-8]。该技术基于16S rDNA测序,通过对Reads过滤,OTUs聚类进行物种分类和丰度分析,再采用Alpha多样性分析揭示不同样品群落结构组成和多样性的差异。
本文采用基于16S rDNA的高通量测序技术分析正常生长和不良生长山核桃林地土壤真菌群落结构和丰度,为山核桃林地的土壤管理和高效栽培提供科学理论依据。
1 材料与方法
1.1 研究区概况
研究区位于浙江省杭州市临安区龙岗镇林坑村,地理坐标119°05′35" ~ 119°06′49" E,30°09′27" ~ 30°10′40" N,属亚热带季风气候,四季分明,气候温和,年均降水量1 628.6 mm,年平均气温15.8℃,年平均日照时数为1 939 h,全年无霜期234 d。2016年5月,在研究区内开展山核桃林分生长状况调查。调查发现,研究区内的林分多数为人工纯林,林龄在20 ~ 30 a,株行距5 m×6 m。根据林分生长状况将山核桃林分为2类:(1)正常,山核桃长势良好;(2)生长不良,多数植株树叶稀少,枝条枯死或整株死亡。2016年8月,随机选择3个正常林地(样地4,样地5,样地6)和3个生长不良林地(样地1,样地2,样地3),每个样地面积为666.67 m2,海拔187 ~ 230 m,土层厚度90 ~ 100 cm,正常林地内近3 a未施化肥,生长不良林地之前一直施化肥,出现山核桃生长不良症状后停施,近1 a未施化肥。
1.2 试验材料
2016年8月17日,在每个样地内随机设5个采样点,去除表面杂草和浮土,采集0 ~ 20 cm 土层中的土壤,将每个样地5个样点采样土壤充分混合后,一部分用聚乙烯袋密封,带回实验室置于-80℃冰箱中保存,另一部分样品自然风干,用于测定土壤化学性质。
1.3 试验方法
土壤化学性质测定:土壤化学性质包括pH、有机质、碱解氮、有效磷、速效钾和交换性酸。其中,土壤pH采用pH计(土水比1:2.5)电位法测定;有机质采用重铬酸钾外加热法;碱解氮采用碱解扩散法;有效磷采用Olsen法;有效钾采用乙酸铵浸提-火焰光度法;土壤交换性酸采用氯化钾交换—中和滴定法[9]。
真菌基因组DNA提取和16S rDNA扩增与测序[10]:所有样品真菌基因组DNA提取和16S rDNA扩增与测序工作委托生工生物工程(上海)有限公司完成。实验流程为:对提取到的基因组DNA进行琼脂糖电泳检测,查看基因组DNA的完整性与浓度。利用Qubit 2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应需加入的DNA量。PCR所用的引物已经融合了Miseq测序平台的通用引物。PCR结束后,对PCR产物进行琼脂糖电泳,采用生工琼脂糖回收试剂盒(cat:SK8131)对DNA进行回收。回收产物用Qubit 2.0定量,根据测得的DNA浓度,将所有样品按照1:1的比例进行混合;混合后充分震荡均匀。该混合样品可用于后续的样品建库(加测序标签)与测序。
测序分析流程:采用Flash软件融合双末端序列,而后通过各样品barcode使数据回归样品,并对各样本序列做QC。去除非靶区域序列及嵌合体,采用RDPclassifier将序列进行物种分类,将多条序列根据其序列之间的距离来对它们进行聚类,以序列之间的相似性97%作为域值分成操作分类单元(OTU)。相同的OTU数量越多说明样本间真菌种类越相近。
1.4 数据处理
运用不同分类水平的OTU分析,说明山核桃林地土壤真菌群落结构。采用Alpha多样性分析,计算Shannon-Wiener指数,ACE指数,Chao1指数,Coverage等,衡量每个样本的物种多样性[11]。使用SPSS 19.0对不同样地土壤化学性质与真菌多样性指数进行相关分析。
Shannon-Wiener多样性指数:

ACE指数:

式中,i表示含有条序列的OTU数目,rare表示含有“abund”条序列或者少于“abund”的OTU数目,abund表示多于“abund”条序列的OTU数目,“abund”为“优势”OTU的阈值,默认为10。
Chao1指数:
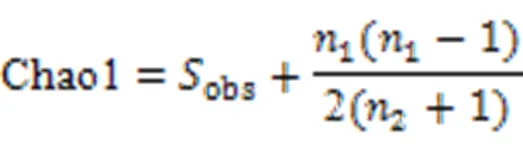
式中,chao1表示估计的OTU数,obs表示实际OTU数,1表示只有1条序列的OTU数目,2表示只有2条序列的OTU数目。
Coverage:
式中,1=只含有1条序列的OTU的数目,=抽样中出现的总的序列数目。
2 结果与分析
2.1 不同样地的基本化学性质分析
各样地土壤基本化学性质见表1。
由表1中可以看出,生长不良的林地(样地1,样地2,样地3)pH均值低于正常林地(样地4,样地5,样地6号),有机质碱解氮和交换性酸的均值高于正常林地。pH低和交换性酸高说明生长不良林地酸化严重,碱解氮含量高可能是由于之前施用化肥,导致林地土壤氮素积累较多。
表1 不同样地土壤基本化学性质
Table 1 Soil chemical properties in 6 sample plots

2.2 不同样地土壤真菌群落结构分析
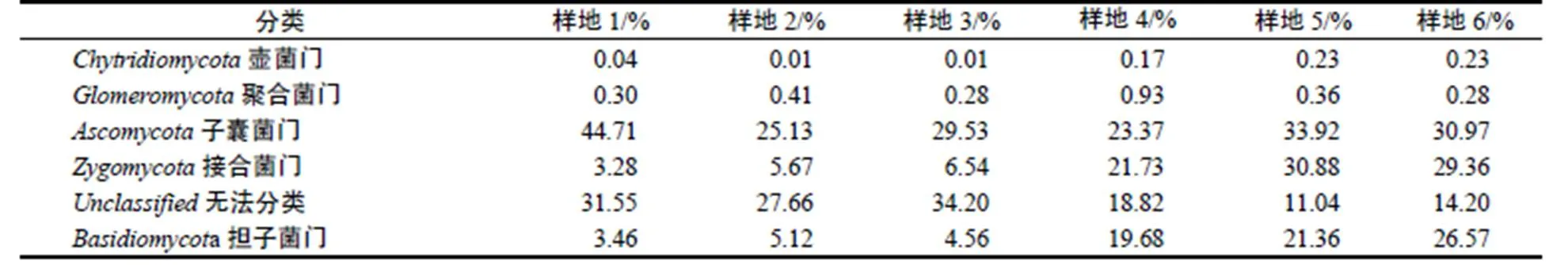
通过OTU分析得出,在相似水平为97%的条件下,6个样地中土壤真菌共有5门19纲74目134科271属。在门的分类水平上,包括壶菌门Chytridiomycota,聚合菌门Glomeromycota,子囊菌门Ascomycota,接合菌门Zygomycota,担子菌门Basidiomycota,其中子囊菌门、接合菌门和担子菌门为主要类群。样地4,样地5,样地6土壤中担子菌门的相对丰度(19.68%,21.36%,26.57%)和接合菌门的相对丰度(21.73%,30.88%,29.36%)高于样地1,样地2,样地3。
表2 不同样地土壤真菌优势门相对丰度
Table 2 Relative abundance of dominant Phylum in 6 sample plots
在属的分类水平上,被孢霉属,小画线壳属,镰刀霉属和土赤壳属是优势属,样地4,样地5,样地6土壤中被孢霉属的相对丰度(12.95%,11.25%,13.44%)高于样地1、样地2、样地3,小画线壳属的相对丰度(1.33%,1.89%,1.97%)、镰刀霉属的相对丰度(1.44%,1.14%,1.22%)和土赤壳属的相对丰度(1.03%,1.64%,1.25%)均低于样地1,样地2,样地3。
表3 不同样地真菌优势属相对丰度
Table 3 Relative abundance of dominat genera in 6 sample plots

2.3 不同林地土壤真菌Alpha多样性分析
由表4样地土壤真菌多样性分析显示,6个样地Shannon-Wiener多样性指数排序为:样地2>样地1>样地3>样地6>样地4>样地5,指数越大,说明群落多样性越高;ACE多样性指数排序为样地1>样地2>样地3>样地5>样地6>样地4;Chao1多样性指数排序为样地1>样地2>样地3>样地5>样地6>样地4;Chao1和ACE指数越大,说明群落丰富度越高。综合3种多样性指数,发现生长不良林地土壤真菌多样性和丰富度均高于正常林地。
表4 不同样地土壤真菌多样性
Table 4 Soil fungi diversity in 6 sample plots

2.4 土壤化学性质与真菌多样性的相关分析
由表5相关分析表明,土壤pH与Shannon-Wiener指数间呈显著负相关(<0.05),与ACE指数和Chao1指数间呈极显著负相关(<0.01)。有机质、碱解氮和交换性酸均与3种多样性指数显著正相关(<0.05)。
表5 山核桃林地土壤化学性质与真菌多样性的相关分析
Table 5 Correlation analysis on soil chemical properties with fungi species diversity

注:*表示在0.05水平上显著相关,**表示在0.01水平上极显著相关。
3 讨论
本研究确定了临安山核桃林地土壤的优势真菌类群,生长不良林地与正常林地土壤真菌优势类群基本一致,但相对丰度有明显差异,可能是这些差异导致林分生长状况不同。在门的分类水平上,正常林地土壤中担子菌门和接合菌门的相对丰度高于生长不良林地。在属的分类水平上,正常林地中小画线壳属、镰刀霉属和土赤壳属的相对丰度明显低于生长不良林地。两类林地的种群和丰度差异可能是影响山核桃健康的主要原因。有研究表明,小画线壳属、镰刀霉属和土赤壳属的真菌与植物根腐病有关[12-13],生长不良林地中植株根大量死亡可能和这三个真菌属的相对丰度较高有关。
本研究中山核桃林地土壤真菌多样性与pH、有机质、碱解氮和交换性酸有关,pH与林地土壤真菌多样性之间呈负相关,有机质、碱解氮和交换性酸与林地土壤真菌多样性呈正相关。pH和交换性酸反映土壤的酸性。生长不良林地比正常林地土壤酸性强,酸性土壤中真菌多样性会更丰富[14]。生长不良林地中的山核桃植株有大量枝条和根死亡,林地中有机质含量会高于正常林地,土壤有机质含量高,也会使土壤真菌数量和物种多样性增加[15]。山核桃林生长不良通常和氮肥施用过多有关[16],生长不良林地之前一直施用化肥,土壤碱解氮普遍高于正常林地,碱解氮含量升高也会影响土壤真菌多样性[17]。土壤化学性质对真菌群落的数量和组成影响较大,因此不能只根据真菌多样性来判断林地土壤环境的优劣。
4 结论
(1)6个样地中土壤真菌共有5门19纲74目134科271属。生长不良林地与正常林地土壤真菌群落结构有明显差异,在门的分类水平上,正常林地土壤中担子菌门和接合菌门的相对丰度高于生长不良林地。在属的分类水平上,正常林地土壤中小画线壳属、镰刀霉属和土赤壳属的相对丰度明显低于生长不良林地。
(2)生长不良林地土壤真菌多样性和丰富度高于正常林地。Shannon-Weiner指数,ACE指数和Chao1指数与土壤pH之间呈显著负相关(<0.05),与有机质、碱解氮和交换性酸之间呈显著正相关(<0.05)。
[1] 陈世权,黄坚钦,黄兴召,等. 不同母岩发育山核桃林地土壤性质及叶片营养元素分析[J]. 浙江林学院学报,2010,27(4):572-578.
[2] 钱孝严,黄坚钦,帅小白,等. 临安市不同乡镇山核桃林地土壤理化性质比较[J]. 浙江林业科技,2013,33(1):7-11.
[3] 张圆圆. 山核桃林地土壤养分现状与山核桃植物营养研究[D]. 杭州:浙江农林大学,2010.
[4] 高云超,朱文珊,陈文新. 秸秆覆盖免耕土壤真菌群落结构与生态特征研究[J]. 生态学报,2001,21(10):1704-1710.
[5] 何玉梅,张仁陟,张丽华,等. 不同耕作措施对土壤真菌群落结构与生态特征的影响[J]. 生态学报,2007,27(1):113-119.
[6] 韦俊,杨焕文,徐照丽,等. 烤烟不同套作模式对土壤理化性质和真菌群落结构的影响[J]. 土壤通报,2017,48(3):631-638.
[7] 郝海婷,王若愚,赵霞,等. 基于高通量测序技术的堆肥对兰州百合根际微生物多样性的影响[J]. 西北农业学报,2017,26(3):437-447.
[8] 赵柏霞,潘凤容,韩晓日. 基于高通量测序技术的樱桃根际细菌群落研究[J]. 土壤通报,2018,49(3):596-601.
[9] 鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,2000.
[10] 赵裕栋,周俊,何靖. 土壤微生物总DNA提取方法的优化[J]. 微生物学报,2012,52(9):1143-1150.
[11] 张彩霞.新一代高通量测序技术研究土壤微生物群落结构对环境条件的响应[D]. 南京:南京农业大学,2012.
[12] 苗翠苹. 三七根际土壤微生物的群落特征[D]. 昆明:云南大学,2012.
[13] 胡国良,俞彩珠. 山核桃病虫害防治彩色图谱[M]. 北京:中国农业出版社,2005.
[14] 高玉峰,贺字典. 影响土壤真菌多样性的土壤因素[J]. 中国农学通报,2010,26(10):178-181.
[15] Upadhyay R,Rai B. Ecological survey of Indian soil fungi with special reference to Aspergillus, Penicillia and Trichoderma. [J]. Rev Ecol Biol Soil,1979,16(1):39-49.
[16] 宋素灵. 山核桃林地土壤退化现状和施肥改良研究[D]. 杭州:浙江农林大学,2014.
[17] 张国青,赵盼,董彦旭,等. 高通量测序分析环保肥料增效剂对马铃薯根际土壤真菌多样性变化影响[J]. 微生物学通报,2017,44(11):2644-2651.
Soil Fungi Community Structure inForest
LI Hao,DONG Jian-hua,YUAN Zi-qian,HU Jun-jing,ZHAO Wei-ming
(Hangzhou Forestry Academy, Hangzhou 310022, China)
Soil samples in 0-20 cm layers were collected in August of 2016 from six plots at normal and unhealthy growthstands in Lin’an, Zhejiang province. Determinations on chemical properties were implemented and fungi community structure was analyzed by 16S rDNA sequencing. The results indicated that dominant phylums and genera were similar in the two different kinds of soil, including Ascomycota, Zygomycota and Basidiomycota, but relative abundance was different. Relative abundance of Basidiomycota and Zygomycota in normal growth plots was higher than that in unhealthy ones. Relative abundance of,andin unhealthy plots was higher than that in normal ones. Correlation analysis demonstrated that Shannon-wiener, ACE and Chao1 index had significant negative correlation with pH and positive one with organic matter, alkaline nitrogen and exchangeable acidity.
; fungi; community structure; 16S rDNA sequencing
S664.9
A
1001-3776(2018)05-0067-06
2018-04-02;
2018-08-11
山核桃退化林地修复技术应用示范与推广(2016TS10号)
李皓,工程师,从事经济林研究;E-mail:38761202@qq.com。
10.3969/j.issn.1001-3776.2018.05.011

