玉米AGPL2蛋白多克隆抗体制备及时空表达分析
吕亚楠,余国武,2,黄玉碧,2
(1.四川农业大学 农学院,四川 成都 611130;2.四川农业大学 农学院 作物科学实验教学中心,四川 成都 611130)
淀粉(Amylum)作为植物中重要的贮藏多糖,是植物种子的主要成分。淀粉可以为食物提供80%的能量,是食物的重要组成部分[1]。玉米是三大粮食作物之一,随着时代的进步和科技的发展,淀粉已经成为一种重要的商业产品,在能源、医药、化工等领域的应用,已进入稳步健康发展阶段[2]。在玉米籽粒中,淀粉的比例达到70%左右,因此,淀粉的质量对玉米的质量有直接的影响[3]。植物体内淀粉的合成是一个复杂的生理过程,它是由几种酶共同催化下,以蔗糖为起始原料,进行一系列生理生化反应合成的[4]。而其中ADPG焦磷酸化酶(AGPase)是淀粉合成代谢途径中起始关键限速酶[5]。因此,深入研究AGPase,对淀粉的合成起到重要作用,有利于研究淀粉生物合成的分子机制及其调控。
有研究表明,AGPase的活性影响淀粉的合成。在植物的叶和块茎中,通过效应子3-磷酸甘油酸的激活作用和无机磷酸的抑制作用,AGPase的活力与光合作用活性相协调[6-7]。Stark等[8]在马铃薯中转入AGPase,结果发现,增加了35%的淀粉产量。同样, Wang等[9]研究中,构建AGPase与胚乳组织特异启动子的重组载体,并将其转入到玉米中表达,结果发现,种子质量增加了22%~25%。另外,发现了一种大肠杆菌突变体,将其转进水稻进行表达,水稻的产量提高了11%[10]。因此,深入研究AGPase,提高其活性,有利于淀粉产量的增加,对作物的育种研究有重要的意义。
高等植物的AGPase是由2个大亚基(LSU)和2个稍小的小亚基(SSU)组成的一个异源四聚体酶(α2β2)。一般大亚基对AGPase具有调控的功能,而小亚基则具有催化功能[11]。AGPase有多种类型的同工酶,并且有多个基因编码。其中,玉米AGPL2是AGPase同工酶的一种大亚基,主要存在于胚乳中,编码518个氨基酸。它可以与AGPase其他亚基组成一种或几种形式的AGPase。水稻胚乳AGPase是由2个小亚基(AGPS2b)和2个大亚基(AGPL2)组成的异源四聚体,在其催化作用下在细胞质中合成ADP-葡萄糖[12]。而且在水稻胚乳中,ADP-葡萄糖焦磷酸化酶(AGPL2和AGPS2b)的表达水平在空间上与淀粉颗粒的差异性分布是相关的,并且编码ADP-葡萄糖焦磷酸化酶的AGPL2和AGPS2b的转录水平似乎调节颖果发育时期淀粉颗粒的异步发育[13]。有研究表明,改变AGPase 7种亚基的组合方式和结构,能够增强土豆(Solanumtuberosum)块茎[7,14]、玉米(Zeamays)[15]、小麦(Triticumaestivum)[16]和水稻(Oryzasativa)种子[17]中AGPase的活性和淀粉的积累。因此,设计玉米AGPL2特异性引物,构建原核表达载体,使其在E.coli能够高效表达,纯化目的蛋白并制备AGPL2多克隆抗体,为研究玉米AGPL2蛋白的表达分析、AGPase的活性乃至淀粉的合成奠定基础。
1 材料和方法
1.1 材料和试剂
以四川农业大学玉米研究所选育的中国西南地区优良玉米骨干系08-641(R08)为材料,该材料特点为淀粉含量较高。
本研究所用的主要试剂:反转录试剂盒、限制性内切酶EcoRⅠ和SalⅠ以及DNA连接酶和蛋白酶抑制剂等(TaKaRa);蛋白质亲和纯化介质GSH-coupled Agarose Affinity Matris(Genstar)、NC膜(Hybond C Extra);弗氏完全佐剂和不完全佐剂(Sigma)、HRP标记的羊抗兔抗体(Abbkine);Quick StartTMBradford 1x dye reagen(Bio-Rad)、HRP-DAB显色试剂盒(Thermo)、蛋白分子量预染蛋白Marker(Solarbio)、WB-MASTER Protein Standard(GenScript)。其他试剂均为国产分析纯试剂。雌性新西兰大白兔,质量为1.5~2.0 kg,由达硕实验动物中心提供。
1.2 试验方法
1.2.1 PGEX-6T-1-AGPL2原核表达载体的构建 玉米授粉后20 d,分离胚乳,提取总RNA,并反转录成cDNA后置于-20 ℃冰箱保存备用。Primer 5.0软件设计AGPL2带有EcoR Ⅰ和SalⅠ酶切位点的上下游引物。通过PCR从玉米胚乳cDNA中扩增目的片段,连接至pMD-19-simple-T载体扩增后,用EcoRⅠ和SalⅠ双酶切回收AGPL2基因片段,与同样双酶切后的表达质粒PGEX-6T-1定向连接,用CaCl2化学法通过热击转化E.coliDH5α菌株,涂板后倒平板培养过夜,挑取单菌落于1 mL Luria-Bertani(LB)液体培基(含100 μg/mL氨苄青霉素)中,37 ℃振荡培养4~6 h,进行菌液PCR检测,选取能够检测到目的条带的菌液扩大培养并用碱裂解法提取质粒,进行EcoR Ⅰ和SalⅠ双酶切验证,然后将重组质粒送到测序公司进行最后确认。
1.2.2 GST-AGPL2融合蛋白的诱导表达 将经过确认的重组质粒转入E.coli表达感受态细胞BL21,涂板并倒平板过夜培养,挑取单克隆于1 mL LB(含100 μg/mL氨苄青霉素)中,37 ℃培养4~6 h,然后进行菌液PCR检测。将检测正确的菌液接种于LB(含100 μg/mL氨苄青霉素)中,37 ℃振荡培养,使菌液OD600在0.4~0.8,加入0.5 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)于28 ℃诱导表达6 h。分别在诱导0,3,6 h时取1 mL菌液,收集菌体,用100 μL超纯水重悬菌体,加入蛋白上样缓冲(20 mmol/L Tris-HCl,0.4% SDS,5%甘油,1% β-巯基乙醇,0.02%溴酚蓝,pH值6.8),煮沸裂解5~10 min,离心(12 000 r/min,2~5 min),吸取上清进行10% SDS-PAGE(SDS-聚丙烯酰胺凝胶电泳)检测重组蛋白的表达。
1.2.3 GST-AGPL2融合蛋白的纯化 将融合蛋白表达成功的菌液离心(4 ℃,4 000 r/min,5~10 min),去上清收集菌体,重悬于PBS缓冲液,离心去上清,重复2~3次。然后用PBS重悬菌体并加入蛋白酶抑制剂,置于冰上,超声破碎使细胞裂解,离心(4 ℃,10 000 r/min,10 min)收集上清。将上清加入预先平衡的含Glutathione beads的纯化柱中,在4 ℃摇床过夜结合。去除上清,用5~10倍柱体积的PBS缓冲液洗涤beads。再用洗脱液洗脱,收集组分,重复5次。最后将收集的蛋白各取出10 μL进行10% SDS-PAGE(SDS-聚丙烯酰胺凝胶电泳)检测。
1.2.4 多克隆抗体的制备 购买2 kg新西兰大白兔,适应环境3~4 d。取兔耳静脉血约500 μL,分离血清作为阴性对照。血液于37 ℃放置2 h,然后4 ℃放置过夜;离心(4 ℃,4 000 r/min,10 min),收集上清,重复2~3次;血清中加入15%的甘油和0.2‰的叠氮化钠,混匀后置于-80 ℃保存。第一次免疫新西兰大白兔时,将纯化的蛋白和不完全佐剂按1∶1混合,直至1 000 r/min离心不分层,然后多点注射兔子皮下。再次注射时,纯化的蛋白和完全佐剂按1∶1混合。每隔14 d免疫一次,连续免疫4次。最后一次注射7 d后,在兔子的颈动脉处取所有血液,分离血清并Western Blot检测评价抗血清。
1.2.5 GST-AGPL2蛋白rTEV Protease酶切反应 取7.5 μg纯化的GST-AGPL2融合蛋白,总体系为150 μL,pH值7.0,加入rTEV Protease(3 μL 25 U)30 ℃孵育,在0,1.5,3.5,6.5 h分别取出30 μL反应液,然后各取出10 μL约 500 ng蛋白进行Western Blot检测。
1.2.6 玉米不同组织蛋白的提取及蛋白定量 将样品在液氮中研磨至粉末,称质量,以1 g样品加入2 mL蛋白提取液(100 mmol/LTris-HCl,pH值7.0,40 mmol/L β-巯基乙醇,10 mmol/L MgCl2,100 mmol/L KCl,15%甘油)的比例加入适当的提取液,并加入蛋白酶抑制剂,混匀,放置冰上30 min;离心(4 ℃,12 000 r/min,15 min),收集上清,重复2次;在1 mL快速测定蛋白浓度反应液中加入2 μL的上清,测OD595以确定其蛋白浓度。
1.2.7 Western Blot试验 Western Blot采用湿转法,在SDS-PAGE结束后,电压90 V,转膜2 h;用丽春红染液染色5 min,观察实际的转膜效果,TBST(150 mmol/L NaCl,20 mmol/L Tris-HCl,pH值8.0,0.05% Tween 20)洗膜3次,每次5 min;加入封闭液(含有5%脱脂奶粉的TBST),在摇床上缓慢摇动,室温封闭1 h;将AGPL2多克隆兔抗体按照适当比例用TBST稀释,4 ℃缓慢摇动孵育过夜,回收一抗,TBST洗膜4次,每次10 min;将HRP标记的羊抗兔IgG按照1∶10 000稀释,室温孵育1 h,回收二抗,再用TBST缓冲液清洗膜4次,每次10 min;加入1∶1混合均匀的显影液和定影液,进行化学发光显影。
2 结果与分析
2.1 PGEX-6T-1-AGPL2原核表达载体的构建
为了构建原核表达载体PGEX-6T-1-AGPL2,选取PGEX-6T-1作为目标载体,该载体含有一个GST标签,GST与目的基因间还有一个TEV Protease酶切位点,可以在试验需要时去除GST标签(图1-A)。以玉米胚乳cDNA为模板,PCR扩增得到AGPL2基因片段,其大小为1 500 bp左右,与理论分子量相符(图1-B)。经酶切、连接反应成功构建PGEX-6T-1-AGPL2载体。将重组质粒PGEX-6T-1-AGPL2进行EcoR Ⅰ和SalⅠ双酶切验证,获得条带大小约为1 500 bp的片段,与预期结果一致(图1-C)。进一步测序验证,表明PGEX-6T-1-AGPL2表达载体构建成功。

A. 载体构建;B. AGPL2 PCR扩增;C. 重组质粒的酶切鉴定。A.Vector construction; B. PCR amplification of AGPL2; C.Identification of recombinant plasmids by restriction enzyme digestion.
2.2 PGEX-6T-1-AGPL2融合蛋白的诱导纯化及鉴定
由上步获得的PGEX-6T-1-AGPL2质粒转化大肠杆菌BL21(DE3)菌株,获得重组工程菌株。在0.5 mmol/L IPTG诱导下,GST-AGPL2融合蛋白的表达量增加,蛋白分子量约83 ku,与理论分子量相符(图2-A)。并且在28 ℃条件下,用0.5 mmol/L IPTG诱导6 h,目的蛋白表达量随诱导时间的增加而增加,说明目的蛋白在此条件下能够得到高水平表达。为获得足够量的AGPL2蛋白,先后纯化得到6管浓度不一的蛋白,其条带比较单一,蛋白质量较高(图2-B)。用已知的不同浓度BSA作对照,6管蛋白浓度介于10~200 ng/μL;其中第6管蛋白浓度最高,介于50~200 ng/μL。这些结果表明,GST-AGPL2重组蛋白成功被纯化,可用作抗原制备抗体。

A. GST-AGPL2融合蛋白诱导表达的考马斯亮蓝染色;B. GST-AGPL2融合蛋白纯化的考马斯亮蓝检测;1-6.纯化的GST-AGPL2融合蛋白。A. The expression of GST-AGPL2 fusion protein was detected by Coomassie brilliant blue staining; B. The purification of GST-AGPL2 fusion protein was detected by Coomassie brilliant blue staining;1-6.Purified GST-AGPL2 fusion protein.
2.3 兔抗血清制备及特异性检测
将上步获得的高质量纯化蛋白,免疫新西兰大白兔,分离血清,获得兔多克隆抗体。为了验证AGPL2抗体的特异性,将上步纯化得到的GST-AGPL2融合蛋白用rTEV Protease去除GST标签,进行Western Blot检测(图3)。结果表明,rTEV Protease酶切前抗体能够特异地检测到GST-AGPL2蛋白条带,酶切后抗体检测到GST-AGPL2、AGPL2和GST这3条带,且随着酶切时间的增加AGPL2条带的信号逐渐增强,说明AGPL2抗体能够特异地检测纳克级抗原,具有很好的特异性和灵敏性。

抗体稀释比例为1∶5 000。Antibody dilution ratio is 1∶5 000.
2.4 玉米AGPL2蛋白的时空表达分析
在体外,AGPL2抗体能识别其抗原,但是否能识别玉米体内的蛋白还不清楚。因此,为了研究玉米内源AGPL2蛋白是否能被制备的抗体识别及AGPL2表达模式与分布情况,提取玉米08641不同组织及其授粉后不同时期的胚乳蛋白,进行Western Blot检测,结果表明,玉米不同组织中检测到的信号强弱不一,说明AGPL2蛋白在不同组织中的表达具有组织特异性(图4-A)。胚乳中AGPL2蛋白的表达量最高,其次是胚,而在根、茎和叶中表达量很少甚至检测不到,说明AGPL2蛋白功能主要在胚和胚乳中。淀粉主要在胚乳中积累,为了进一步研究在淀粉积累中胚乳AGPL2的表达模式,分离授粉后不同阶段的胚乳,提取总蛋白并进行Western Blot检测,结果表明,在授粉10 d内AGPL2蛋白含量很少,10~15 d AGPL2蛋白的表达量剧增,在15,20 d的信号最强,随后逐渐减弱(图4-B)。这一结果与淀粉的积累模式相符,说明AGPL2在淀粉的积累过程中可能参与了淀粉的合成。也表明AGPL2抗体能够很好地识别玉米胚乳内的抗原。以上结果说明,AGPL2多克隆抗体能特异地识别玉米体内的蛋白。在玉米中,AGPL2的表达主要在胚乳中,尤其在授粉后15,20 d表达水平较高。
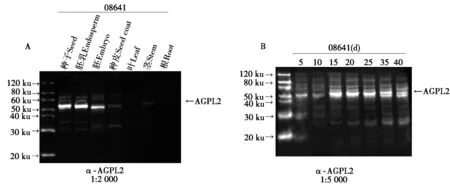
A.玉米AGPL2蛋白在不同组织的分布检测,抗体稀释比为1∶2 000;B.玉米胚乳中的AGPL2蛋白在授粉后不同时期的表达检测,抗体稀释比为1∶5 000。A.Distribution of maize AGPL2 protein in different tissues,antibody dilution ratio is 1∶2 000;B. Expression of AGPL2 protein in maize endosperm at different stages after pollination;antibody dilution ratio is 1∶5 000.
3 结论与讨论
本研究扩增编码AGPase大亚基多个基因之一的AGPL2基因,成功构建了原核表达载体PGEX-6T-1-AGPL2。在大肠杆菌BL21(DE3)中诱导表达GST-AGPL2蛋白,结果发现,在28 ℃、0.5 mmol/L IPTG条件下该蛋白能够得到高水平的表达。用亲和纯化的GST-AGPL2蛋白作为抗原,免疫新西兰大白兔成功制备其多克隆抗体,抗体具有较高的特异性和灵敏性。并利用AGPL2抗体初步研究了玉米AGPL2蛋白的时空表达分布,说明AGPL2蛋白主要存在于胚乳,其表达模式与淀粉积累规律一致,对进一步探索和研究植物中AGPL2蛋白、AGPase及淀粉的合成具有重要的意义。
兔多克隆抗体AGPL2具有较高的特异性和效价。在体外抗体特异性试验中,检测的总抗原蛋白500 ng,rTEV Protease去除GST标签前检测到了GST-AGPL2,而酶切后出现了不带标签的AGPL2及GST蛋白。结果表明,AGPL2多克隆抗体不但能识别AGPL2蛋白,而且也能识别GST。而在玉米体内不存在GST蛋白,因此,AGPL2多克隆抗体具有较高的特异性。在抗体效价方面,试验并未直接用Elisa实验去评估效价[18],直接采用了Western Blot去验证抗体。因在抗原检测中,抗体的稀释比为1∶5 000,在体内玉米AGPL2蛋白检测试验中,也采用了1∶2 000的稀释比例。这些结果表明,AGPL2抗体具有较高的效价。另外,AGPL2抗体检测的总抗原蛋白为500 ng,其中AGPL2的量远低于500 ng,因此证明AGPL2抗体可用于检测纳克级蛋白,具有较高的特异性和灵敏性。总之,以上结果说明,试验获得了具有较高特异性和效价的抗体。
在多种植物中发现,AGPase的大小亚基不止一种基因编码,而是由多个基因编码,并且这些基因存在于不同的组织或器官,具有组织表达特异性[19-24]。本研究对玉米的根、茎、叶、种皮、胚、胚乳中的AGPL2亚基进行免疫杂交时,不同组织AGPL2蛋白的表达量不同,并且AGPL2在胚乳中表达量最高,表明了AGPL2亚基具有组织表达特异性且主要存在于胚乳。在黄斌全[25]的研究中,对胚乳、胚、根和叶中的AGPL2进行荧光定量,结果出现AGPL2在胚中的表达量最高,其次是叶,最低是根。与本研究的结果不一致,可能是因为本研究是基于蛋白水平,而黄斌全[25]是在RNA水平上进行研究的。有研究表明,RNA水平和蛋白水平往往不一致[26]。并对玉米不同授粉时期的胚乳裂解液进行Western Blot检测,检测到的信号强弱不一,且信号由弱到强再变弱,表明了玉米胚乳中AGPL2的表达模式是先增加后降低,这与黄斌全[25]研究的荧光定量结果一致,且与淀粉的积累规律相符。在玉米胚乳组织的表达分布中,AGPL2抗体在35,40 d主要识别了2条条带,推测由于大亚基蛋白同源性较高AGPL2抗体也可能识别AGPase的其他亚基。

