家蚕整合素β2的表达、纯化及其免疫功能
张奎,李重阳,苏晶晶,谈娟,徐曼,崔红娟
家蚕整合素2的表达、纯化及其免疫功能
张奎,李重阳,苏晶晶,谈娟,徐曼,崔红娟
(西南大学家蚕基因组生物学国家重点实验室,重庆 400716)
【目的】分析家蚕()整合素2的序列和结构特征及其在家蚕感染病原菌后血细胞中的表达变化,检测其重组蛋白对不同病原相关模式分子识别和病原菌的凝聚作用,为进一步探究家蚕整合素2的蛋白功能打下基础。【方法】利用生物信息学对整合素2的序列和结构特征进行分析,利用实时荧光定量PCR检测家蚕分别注射大肠杆菌()和金黄色葡萄球菌()后整合素2在血细胞中的表达变化。通过PCR技术扩增获得整合素2完整的胞外域片段,构建至pET22b原核表达载体后转化至Rosetta(DE3)表达菌株。经IPTG诱导获得重组蛋白,利用Ni-NTA亲和层析得到纯化的体外重组蛋白,利用SDS-PAGE和western blot对纯化获得的体外重组蛋白的纯度和质量进行检测。利用ELISA检测重组蛋白与两种不同病原相关分子模式LPS和PGN的结合情况,运用Western blot检测重组蛋白与不同病原微生物的结合情况,通过凝集试验检测重组蛋白对金黄色葡萄球菌的凝集能力,最后在个体水平探索重组蛋白在体内细菌清理中的作用。【结果】家蚕整合素2具有典型的整合素亚基保守结构特征,即由一个较长的胞外域、一个单次跨膜结构域和一个较短的胞内域构成。家蚕整合素2具有金属离子结合位点MIDAS、EGF结构域、半胱氨酸重复基序和NPxY等整合素典型的结构特征。实时荧光定量PCR检测结果表明家蚕在受到细菌感染后,整合素2的表达发生显著变化。通过原核表达和蛋白纯化获得纯度较高的重组蛋白,SDS-PAGE和Western blot检测结果表明纯化的重组蛋白纯度较高,可以用于后续试验。ELISA试验表明重组蛋白对LPS和PGN等病原相关分子模式具有较强的结合能力。细菌结合试验结果显示重组蛋白能够结合多种细菌,但与革兰氏阳性菌的结合能力要高于革兰氏阴性菌。细菌凝聚试验结果显示重组蛋白在Ca2+的存在下对金黄色葡萄球菌具有较强的凝聚作用。细菌清除试验证实重组蛋白可以有效促进机体对外源入侵细菌的清理作用。【结论】整合素2具有典型的整合素亚基的结构特征,可能具有识别病原相关分子模式,如LPS和PGN等的能力,通过与细菌的直接结合而实现对入侵病原微生物的凝聚作用,从而增强有机体的免疫能力,推测在家蚕免疫反应中发挥重要作用。
家蚕;整合素2;细菌感染;原核表达;细菌凝聚
0 引言
【研究意义】整合素是一类以异源二聚体的形式介导细胞与细胞、细胞与细胞外基质相互作用的跨膜糖蛋白,参与细胞内外信号的双向传导作用[1],由和两个亚基组成异源二聚体[2],广泛存在于后生动物中[3],在免疫[4]、黏附与迁移[5-6]、凋亡[7-8]、组织构成与修复[9]以及肿瘤发生[10]等方面发挥重要作用。目前,已从家蚕()中克隆鉴定得到6个和5个亚基[11],笔者课题组前期研究工作显示整合素PS3特异表达于部分颗粒细胞,可能参与吞噬与包囊反应[12],而整合素3可能作为一种模式识别蛋白,特异性识别革兰氏阳性菌的入侵[13]。孙亚兰从家蚕中率先鉴定克隆得到整合素2,推测其可能参与血细胞包囊作用的调控[14],但其功能仍有待解析。对家蚕整合素的功能研究有助于了解昆虫免疫防御机制,同时对制定鳞翅目害虫防治策略具有重要意义。【前人研究进展】整合素在果蝇中的研究较多,目前在果蝇基因组中已经鉴定得到3个和2个亚基,在组织发育[15-17]、附着[18-19]、重塑[20]以及干细胞增殖与维持[21]等方面发挥重要的调控作用。整合素广泛存在于昆虫中,在烟草天蛾()、亚洲玉米螟()、大豆夜蛾()、埃及伊蚊()和家蚕等多种昆虫中均鉴定到整合素。大豆夜蛾存在多个和亚基,它们主要表达于血细胞,参与调控血细胞的黏附作用[22-23]。在冈比亚按蚊()中,一个成员在抵御柏氏疟原虫入侵中发挥特殊作用[24],另一个成员——BINT2,参与对大肠杆菌的吞噬作用[25],而地中海果蝇()的一个亚基也发现具有调控细菌吞噬的功能[26]。亚洲玉米螟1被证实能够调控浆细胞的延展和包囊反应[27-28],而烟草天蛾1也参与调控血细胞对外源入侵物的包囊[29]。【本研究切入点】家蚕是一种重要的经济昆虫和模式昆虫。笔者课题组前期对家蚕整合素家族基因进行了系统性鉴定,对其表达情况进行了分析[11,30-31],这些工作为家蚕整合素的研究打下了基础。通过对家蚕整合素功能进行研究,揭示其在免疫反应中发挥的作用,可为蚕病和鳞翅目病虫害的防治提供理论支撑。【拟解决的关键问题】运用生物信息学方法对家蚕整合素2的结构与序列特征进行分析,探索其在病原菌入侵中发挥的作用。通过原核表达和纯化获得高纯度的重组蛋白,检测重组蛋白与病原菌以及病原分子模式的结合情况,探索整合素2在家蚕病原菌入侵应答中的作用。
1 材料与方法
试验于2016年7月至2018年7月在家蚕基因组生物学国家重点实验室(西南大学)完成。
1.1 试验材料
所用家蚕品系为大造,保存于笔者实验室,于25—27℃条件下用干净的新鲜桑叶饲养。所用感受态细胞和HiFi taq酶购自北京全式金公司,Trizol、PMD19-T和限制性内切酶购自TaKaRa公司,反转录试剂盒和荧光定量试剂盒购自promega公司,胶回收试剂盒购自Axygen公司,质粒提取试剂盒购自Qiagen公司,质粒pET22b、大肠杆菌()、绿脓杆菌()、金黄色葡萄球菌()、枯草芽孢杆菌()保存于笔者实验室。脂多糖(lipopolysaccharide,LPS,来自)购自Sigma公司,肽聚糖(peptidoglycan,PGN,来自)购自InvivoGen公司。
1.2 培养基及试剂
Luria-Bertani(LB)固定培养基:NaCl 2 g,胰蛋白胨2 g,酵母提取物4 g,琼脂粉3 g加双蒸水200 mL,于121℃高压灭菌20 min。待培养基冷却至50—60℃时,加入抗生素,轻柔混合均匀后制备平板;LB液体培养基:NaCl 2 g,胰蛋白胨2 g,酵母提取物4 g加双蒸水200 mL,于121℃高压灭菌20 min,4℃保存备用;TBS缓冲液:Tris-HCl 1.21 g,NaCl 8.77 g加双蒸水充分溶解后调节pH至7.5并定容至1 L。PBS缓冲液和异丙基硫代半乳糖苷Isopropyl-D- Thiogalactoside(IPTG)等试剂购自上海生工公司。
1.3 序列比对分析
家蚕整合素2和3的全长cDNA序列均在笔者实验室前期工作中获得[11],烟草天蛾整合素1(Ms1,AAU11316.1)和草地贪夜蛾()整合素1(Sf1,ABB92837.1)均下载自美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)。蛋白序列比对采用Clustal X和GENEDOC软件。结构域预测使用在线工具SMART(http://smart.embl-heidelberg.de/),跨膜结构预测使用在线工具TMHMM Server v. 2.0(http://www.cbs.dtu. k/services/TMHMM/),信号肽预测使用在线工具SignalP 4.1 Server(http://www.cbs.dtu.dk/services/ SignalP/)。分析获得数据利用Adobe Illustrator CS6软件进行汇总作图。
1.4 家蚕感染与材料收集
将保存的大肠杆菌和金黄色葡萄球菌种子分别接种于LB培养基,在37℃于300 r/min过夜培养,当OD600达到0.6—0.8时,取适量培养液5 000 r/min离心收集菌体,用预冷的1×PBS反复洗涤若干次后重悬于1×PBS中。利用血球计数板进行技术,将菌液稀释至108个/mL。取5龄第2天家蚕幼虫110头,分为3组:第1组10头,每头注射10 μL的高压灭菌1×PBS作为对照;第2组50头,每头注射10 μL的大肠杆菌;第3组50头,每头注射10 μL的金黄色葡萄球菌。于注射3、6、12、24和48 h后分别收集各组血细胞(其中对照组只收集注射后3 h一个时间点),加入1 mL Trizol混合均匀后保存于-80℃备用。
1.5 总RNA的提取及cDNA的合成
将-80℃保存的加入Trizol裂解液的样本取出置于冰上,待样品完全溶解后提取总RNA,利用1%的琼脂糖胶和紫外分光光度计对提取的总RNA的纯度与浓度进行检测。然后参照反转录试剂盒提供的说明书进行反转,获得第一链cDNA。
1.6 实时荧光定量PCR
实时荧光定量PCR所用试剂为promega公司的GoTaq® qPCR Master Mix,检测仪器为Roche公司的LightCycler 96。定量PCR反应体系:2×GoTaq® Probe qPCR Master Mix 10 μL,cDNA模板2 μL,扩增上下游引物各0.4 μL,无核酸酶水7.2 μL。整合素2的定量检测引物为2-qF:GTATTGATTGGCTTGCTGAC TCTC和2-qR:GCTTCTTCCACTTTCCTGTATTCC,家蚕看家基因作为内参,其引物为- qF:CATTCCGCGTCCCTGTTGCTAAT和- qR:GCTGCCTCCTTGACCTTTTGC。定量PCR的反应采用“两步法”,具体条件为95℃预变性10 min,95℃变性15 s,60℃结合与延伸30 s,循环数为45次。
1.7 PCR扩增与载体构建
质粒由重庆威士腾生物构建,具体的构建方式如下:利用Primer 5.0设计PCR扩增引物,对整合素2的胞外域部分进行扩增,引物为2-F(RI):GACTTCCATTTGTGGACAGTTCA和2-R(I):CCGTAGCTTTAGGCGGTATCTG CT。扩增产物进行切胶回收后连接至PMD19-T载体,转化至感受态细胞后挑取单斑,经测序获得无突变的单克隆T-2。扩大培养后提取质粒,利用限制性内切酶RI和I对T-2和pET22b质粒分别进行酶切,利用1%的琼脂糖胶分别回收对应的整合素2和pET22b酶切片段。参照说明书,利用T4 DNA连接酶对酶切回收的pET22b和整合素2进行连接,经转化和阳性克隆筛选获得pET22b-2重组质粒。
1.8 重组蛋白的表达与纯化
将pET22b-2质粒转化进大肠杆菌Rosetta (DE3)感受态,挑取单克隆,经菌液PCR验证后扩大培养。取高压灭菌试管,分别加入10 mL新鲜培养后,各接种1 mL新培养的菌种,然后置于37℃ 300 r/min的条件下进行培养,待OD600达到0.6—0.8时,向各个培养管中分别加入不同终浓度的IPTG,16℃诱导20 h。于10 000 r/min 4℃离心培养液,收集菌体,弃上清后用预冷的1×PBS反复洗涤菌体,最后用1.5 mL 1×PBS悬浮菌体,经高压破碎处理后高速离心,分别收集上清蛋白和包涵体蛋白,包涵体用适量1×PBS重悬。取15 μL蛋白样品,加入5 μL 4×SDS PAGE上样缓冲液混匀后,煮沸变性30 min,进行SDS-PAGE电泳,电泳完成后利用考马斯亮蓝进行染色。通过对结果进行分析,发现0.2 mmol·L-1的IPTG浓度条件下,即可获得含量较高的重组蛋白,所有大规模诱导的条件最终确定为IPTG浓度0.2 mmol·L-1,诱导温度16℃,诱导时间20 h。利用Ni+亲和层析对大规模诱导获得的重组蛋白进行纯化,在纯化过程中收集不同处理阶段的样品,利用SDS-PAGE电泳进行检测。
1.9 Western blot检测
利用Western blot技术对纯化获得的重组蛋白进行检测,Western blot检测由重庆威士腾生物提供,具体方法如下:取5 μg BSA和纯化的重组蛋白进行SDS-PAGE电泳,电泳完成后取出胶,进行转膜,将胶上的蛋白转至PVDF膜上。利用5%的BSA于室温封闭PVDF膜2—3 h后,换为6×His-tag抗体(碧云天,1﹕1 000)或anti-Integrin2抗体(课题组前期制备,1﹕2 000),4℃孵育过夜。1×TBST洗涤3×10 min,加入HRP标记的二抗室温孵育2—3 h后,用1×TBST洗涤3×10 min。利用western blot超敏显色试剂盒对条带进行显色并收集图片。
1.10 ELISA检测
将5 μg的LPS或PGN加入新的96孔板中,置于37℃恒温箱过夜孵育,使得水分完全挥发,然后60℃处理30 min。用TBS缓冲液配制终浓度为600 μg·mL-1的BSA封闭液,按照每孔200 μL的量加至孔中,37℃恒温孵育2 h。用TBS缓冲液多次洗涤后,加入终浓度分别为0、1、2、4、8、12和24 μg·mL-1的重组蛋白。室温孵育3 h后用TBS缓冲液多次洗涤,每孔加入100 μL的6×His-tag(1﹕1 000)稀释液,37℃孵育1 h。经TBS缓冲液多次洗涤后,每孔加入50 μL TMB显色液,室温避光显色20 min后加入2 mol·L-1H2SO4终止反应,于450 nm处测定吸光值。
1.11 细菌结合试验
检测重组蛋白与两种革兰氏阴性菌(大肠杆菌和绿脓杆菌)和两种革兰氏阳性菌(金黄色葡萄球菌和枯草芽孢杆菌)的结合情况。将上述4种菌分别接种至LB培养基,过夜培养后收集菌液,以1 000×离心10 min后用TBS缓冲液反复洗涤,最后用适量TBS重悬。取10 μL菌(107个)和5 μg重组蛋白混匀后置于4℃,轻轻摇晃过夜。菌体用TBS缓冲液洗涤数次后加入5 μL的TBS缓冲液重悬,然后加入5 μL 4×SDS PAGE上样缓冲液混匀并煮沸变性30 min。后续western blot 参照材料与方法1.9部分。
1.12 细菌凝集试验
细菌凝集试验共分为4组,第1组取25 μL重悬于TBS缓冲液的金黄色葡萄球菌(106个),加入等体积的BSA蛋白(100 μg·mL-1);第2组在菌中加入至终浓度为10 mmol·L-1Ca2+;第3组在菌中加入等体积的重组蛋白;第4组在菌中加入等体积的纯化的重组蛋白和终浓度为10 mmol·L-1的Ca2+。室温孵育1 h后,将菌液涂抹至载玻片,待样品完全风干后置于显微镜下观察。
1.13 体内细菌清除
700 μL纯化的重组蛋白(500 μg·mL-1)与等体积的金黄色葡萄球菌(107个),轻柔混匀后室温放置30 min,期间轻轻颠倒混匀数次,以等量的BSA作为阴性对照。取5龄第3天家蚕幼虫54头,随机平分为两组,每组27头。第1组每个个体分别注射50 μL的重组蛋白与菌体混合液;第2组每个个体分别注射50 μL的BSA与菌体混合液。注射2、15和30 min后,刺破幼虫足部,3头为一组收集血淋巴,每个试验组设置3次重复。取50 μL血淋巴加入450 μL预冷PBS(含苯基硫脲),混匀后取100 μL涂布至LB固定平板,37℃培养过夜,次日对菌落进行计数统计。
2 结果
2.1 家蚕整合素β2序列特征
在课题组前期的研究中,克隆得到家蚕整合素2和3的全长cDNA序列,利用实时荧光定量PCR对其表达情况进行研究,发现这两个基因均特异性高表达于血细胞[11]。家蚕整合素2基因全长为6 311 bp,包含8个外显子和7个内含子,其cDNA全长为2 434 bp,5′和3′ UTR分别为118和72 bp。整合素2的蛋白编码区(coding sequence,CDS)长度为2 244 bp,编码747 氨基酸残基(amino acid,AA)的多肽,预测蛋白质分子量84.42 kD,等电点5.349。与其他整合素亚基成员相似,家蚕整合素2蛋白由一段较长的胞外域、单次跨膜结构域(transmembrane,TM)和一段较短的胞内域(cytoplasmic tail,CD)构成,其中信号肽和跨膜结构域分别位于第1—19和678—700位氨基酸残基之间。整合素2与其他昆虫亚基具有一定的保守性,与家蚕整合素3、烟草天蛾整合素1和草地贪夜蛾1的相似度分别为29%、45%和40%。比对结果显示,家蚕整合素2上存在金属离子结合位点MIDAS、EGF结构域、半胱氨酸重复基序和NPxY等整合素非常保守的结构域或基序。利用NetNGlyc 1.0 server在线工具预测相关蛋白的糖基化位点,在家蚕整合素2预测得到5个糖基化位点,分别位于第204、396、408、626和647位氨基酸残基,其中后3个位点具有较高的保守性(图1)。
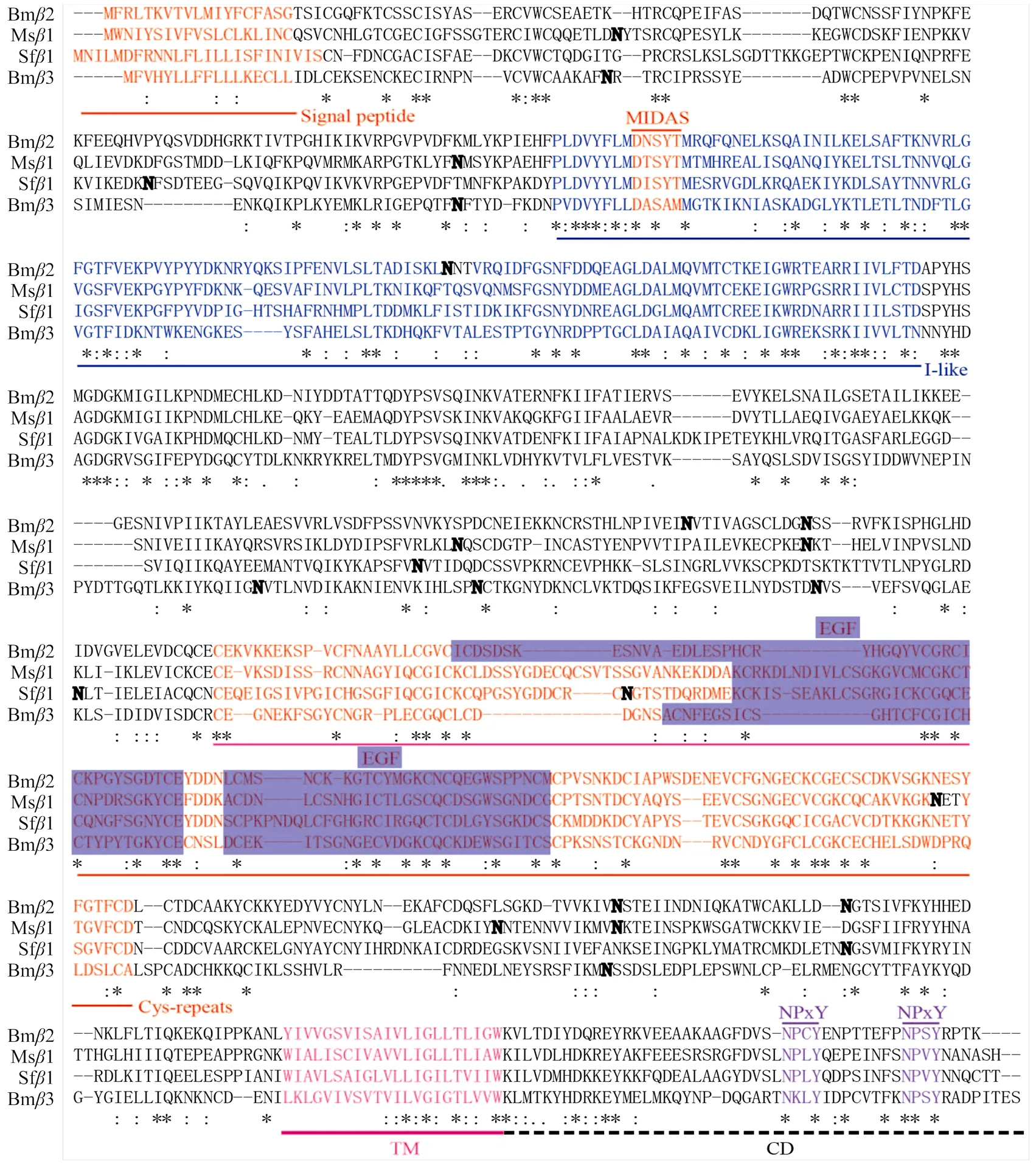
“*”:保守的氨基酸残基 Positions with identical residues;“:”:保守性置换 Positions with conservative substitutions;黑色加粗字体 The black bold fonts:预测的N-糖基化位点The predicted N-glycosylation sites; MIDAS:MIDAS基序MIDAS motif within the I-like domain;I-like:I-like结构域I-like domain;EGF:EGF结构域EGF-like domain;Cys-repeats:半胱氨酸重复基序 The four cysteine-rich pseudo-repeats;TM:跨膜结构域 Transmembrane domain;CD:胞内域Cytoplasmic domain;NPxY:NPxY模式NPxY motif
2.2 家蚕整合素β2在细菌感染后的表达变化
血细胞是一类重要的免疫细胞,在发育变态和免疫防御中发挥重要的作用。为了探究家蚕整合素2可能扮演的角色,分别利用大肠杆菌和金黄色葡萄球菌对5龄第2天幼虫进行病原菌诱导。如图2-A所示,在大肠杆菌诱导3 h后,整合素2开始上调表达,至6 h时,上调趋势达到峰值,随后迅速降低。而用金黄色葡萄球菌诱导后,整合素2也从3 h开始上调表达,至12 h时达到峰值,随后下调(图2-B)。上述结果表明大肠杆菌和金黄色葡萄球菌可以诱导家蚕整合素2的表达。
2.3 家蚕整合素β2重组蛋白的表达与纯化
为了进一步探索家蚕整合素2的功能,尝试利用原核表达获得体外重组蛋白。截取编码第20—676位氨基酸残基的cDNA序列,该序列长度为1 971 bp,编码657 AA的氨基酸,属家蚕整合素2完整的胞外域部分(图3-A)。将该DNA片段插入表达质粒pET22b后,转化进入Rosetta (DE3)感受态细胞,成功获得含有pET22b-β2重组质粒的表达菌株。0.2和0.4 mmol·L-1的IPTG均能诱导重组蛋白的表达(图3-B)。最终选择16℃,IPTG浓度为0.2 mmol·L-1的条件下大规模诱导目的重组蛋白的表达。对收集获得的蛋白,利用镍离子亲和层析的方法进行纯化,随后利用SDS-PAGE对纯化获得的蛋白进行检测,发现40、60和100 mmol·L-1的咪唑洗脱浓度可获得纯度较高的整合素2重组蛋白(图3-C)。纯化蛋白的N和C端均包含一个His标签,根据这一特性,利用His标签抗体对重组蛋白进行western blot检测。纯化获得的重组蛋白样品有一条明显的蛋白条带(图3-D)。为了进一步证实重组蛋白的特异性,利用前期制备的anti-integrin2抗体进行进一步的western blot检测,确认重组蛋白为后续试验所需要的目的靶蛋白(图3-E)。
2.4 整合素β2重组蛋白与病原相关分子模式(pathogen- associated molecular patterns,PAMPs)的结合
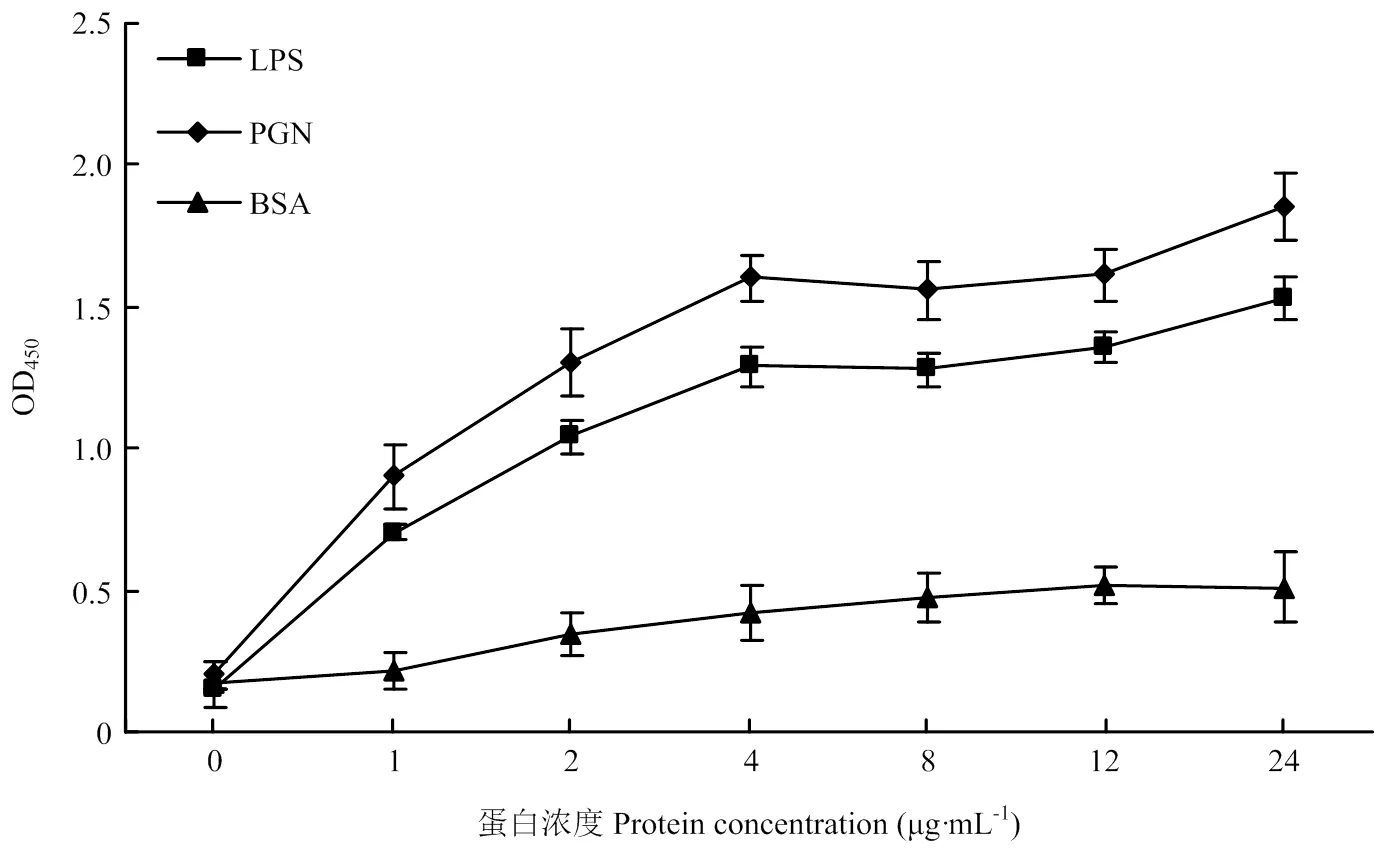
采用ELISA方法探究家蚕整合素2能否与病原相关分子模式结合。LPS是位于革兰氏阴性细菌细胞壁最外层的一层较厚的类脂多糖,而PGN(本文指Lys-type PGN)是革兰氏阳性细菌细胞壁的主要组成成分。如图4所示,家蚕整合素2重组蛋白与对照样品BSA的结合能力很弱,而与PGN和LPS的结合能力很强,且呈现明显的浓度梯度依赖效应。PGN和LPS相比,PGN与重组蛋白的结合能力要强于LPS。
2.5 整合素β2重组蛋白与病原菌的结合
运用Western blot检测重组蛋白与两种革兰氏阳性菌(金黄色葡萄球菌和枯草芽孢杆菌)和两种革兰氏阴性菌(大肠杆菌和绿脓杆菌)的结合能力。如图5所示,4种检测的病原菌均在与整合素2重组蛋白同样大小的位置上出现条带,说明整合素2重组蛋白与金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和绿脓杆菌均发生结合。相比较而言,重组蛋白与两种革兰氏阳性菌的结合能力要显著强于两种革兰氏阴性菌。
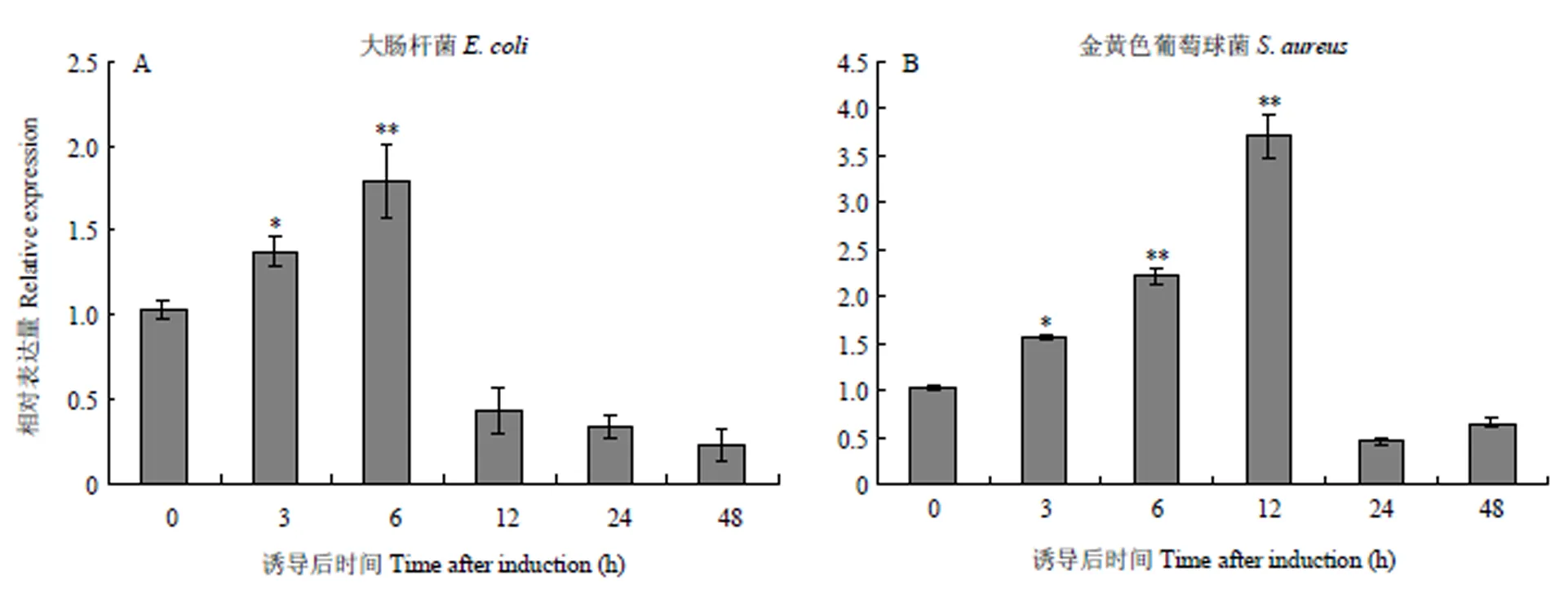
*P<0.05,**P<0.01,统计学分析用t检验 *P<0.05 vs control PBS, **P<0.01 vs control PBS, Student’s t-test (n=3)
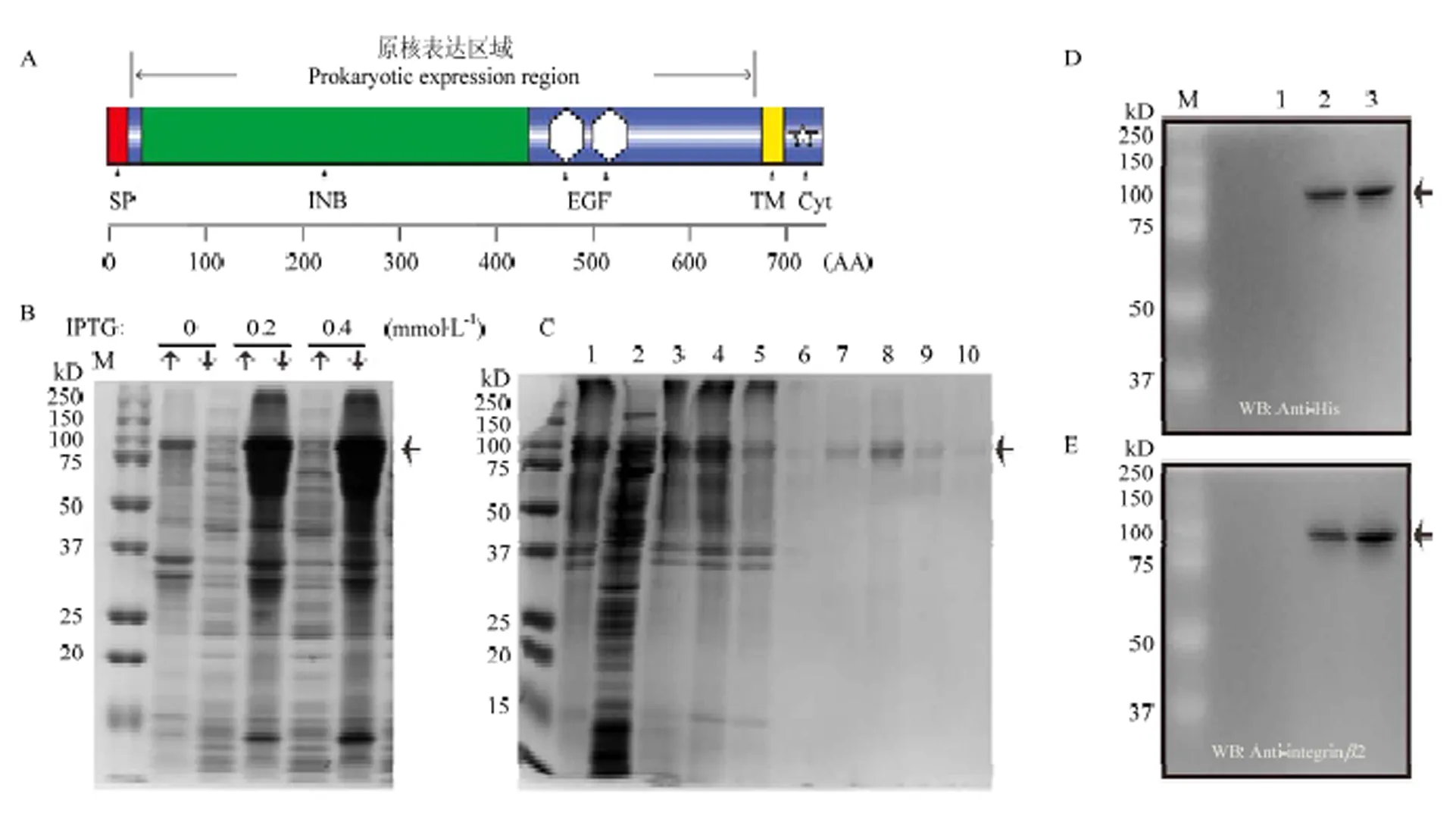
A:整合素β2蛋白结构域分析,重组蛋白包含完整的胞外域部分(信号肽除外)The protein structure domain analysis of integrin β2, the recombinant proteins contain the complete extracellular domain (except for the signal peptide)。B:整合素β2在大肠杆菌中的表达Induction of the integrin β2 protein in E. coli。M:蛋白分子标准Marker;“↑”:重组菌的上清蛋白 The soluble fraction of recombinant E. coli;“↓”:重组菌的包涵体蛋白 The inclusion body of recombinant E. coli。C:整合素β2重组蛋白的纯化Purification of the integrin β2 recombinant protein。M:蛋白分子标准Marker;1:重组菌的包涵体蛋白 The inclusion body of recombinant E. coli;2:重组菌的上清蛋白 The soluble fraction of recombinant E. coli;3、4:上柱前蛋白 The proteins before purified by NTA-Ni affinity chromatography;5:流出液 Outflow;6:20 mmol·L-1咪唑 Imidazole at 20 mmol·L-1;7:40 mmol·L-1咪唑 Imidazole at 40 mmol·L-1;8:60 mmol·L-1咪唑 Imidazole at 60 mmol·L-1;9:100 mmol·L-1咪唑 Imidazole at 100 mmol·L-1;10:200 mmol·L-1咪唑 Imidazole at 200 mmol·L-1。D、E:Western blot检测纯化重组蛋白,检测抗体为His标签或anti-integrin β2抗体 The purified recombinant proteins detected by western blot, and the His-tag antibody or anti-integrin β2 used in this study。1:未诱导的菌体蛋白 Uninduced bacteria protein;2:诱导的菌体蛋白 Induced bacteria protein;3:纯化获得的整合素β2重组蛋白 The purified recombinant integrin β2 protein
BSA作为对照BSA used as the control
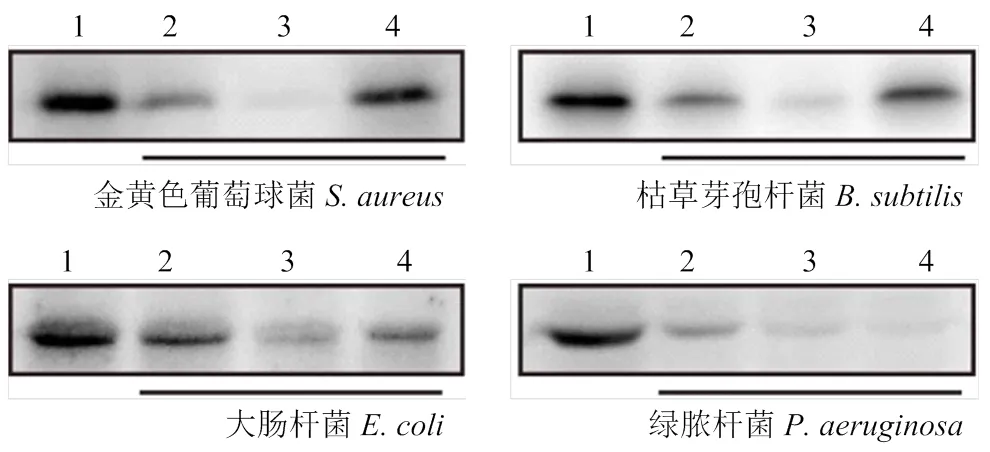
1:未结合蛋白Unbinding protein;2:第一次洗脱First elution;3:第二次洗脱Second elution;4:菌体结合蛋白Bacterial binding protein
2.6 整合素β2重组蛋白促进细菌凝聚反应
为了进一步检测整合素2在免疫反应中的功能,进行了细菌凝集分析。结果显示整合素2重组蛋白对金黄色葡萄球菌具有一定的凝聚作用,而同时添加Ca2+后,重组蛋白对金黄色葡萄球菌具有很强的凝聚作用(图6)。检测重组蛋白对大肠杆菌的凝聚作用,发现在Ca2+的激活下,重组蛋白也可以促进大肠杆菌的凝聚,但其凝聚效果要弱于金黄色葡萄球菌(数据未列出)。
2.7 整合素β2促进体内细菌清除
前期试验数据显示整合素2可能通过与病原相关分子模式(PAMPs)相互结合而实现对细菌的识别,因此推测整合素2可能参与机体对外源入侵细菌的清理。利用细菌清理试验检测BSA或整合素2重组蛋白(rIntegrin2)处理金黄色葡萄球菌后,有机体对细菌的杀伤情况。如图7所示,细菌体内注射15 min后,BSA处理组大约有83%的细菌存活,而重组蛋白处理组只有66%的细菌存活,细菌存活率下降了17%,差异显著(<0.05)。而注射30 min后,相应的细菌生存率分别降至66%和48%,重组蛋白处理组相比BSA处理组下降了18%,差异显著(<0.05)。
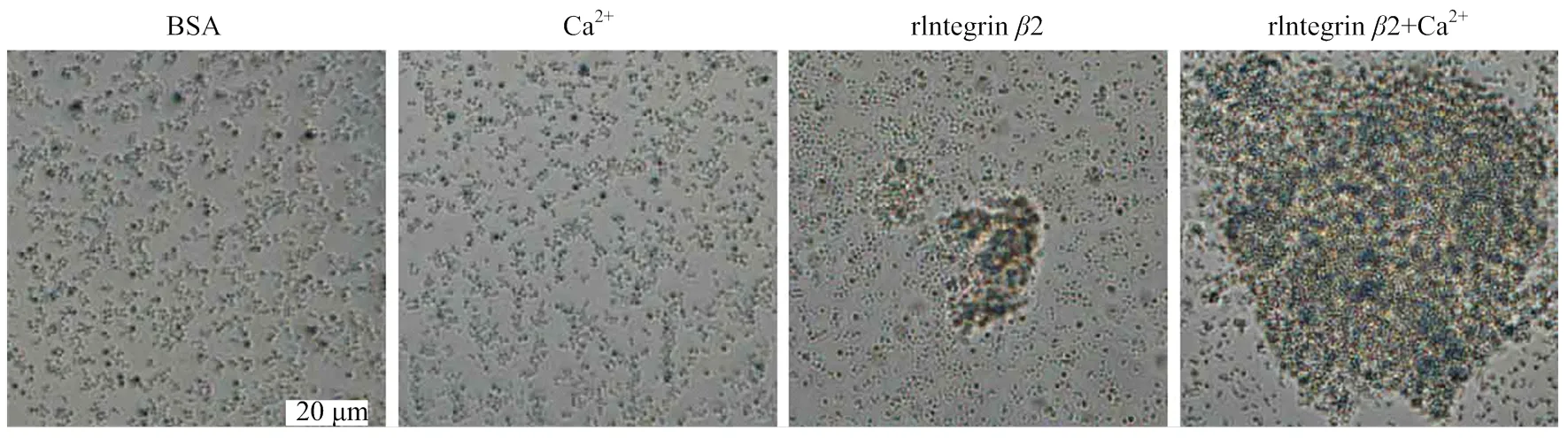
图6 整合素β2重组蛋白对金黄色葡萄球菌的凝聚作用
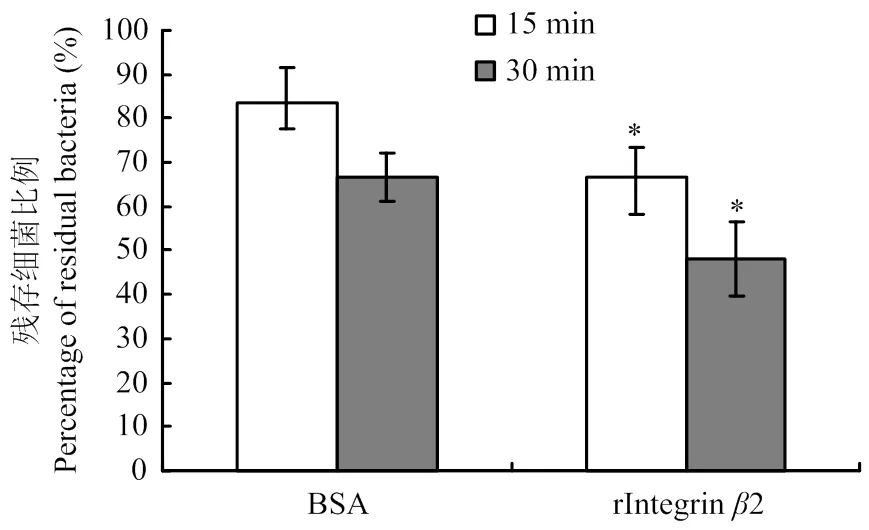
图7 整合素β2重组蛋白体内清除细菌活性检测
3 讨论
整合素是一类跨膜糖蛋白异源二聚体,广泛存在于各物种中,在多种正常生理和病理中发挥着重要的作用。目前在多种昆虫中整合素基因得到鉴定,但除果蝇外,整合素在昆虫中的研究停留在基因克隆和简单的功能研究。本研究在前期研究的基础上,对整合素2的功能进行探索。整合素2是一个在血细胞中高表达的整合素成员之一[11],课题组前期研究结果显示整合素PS3在血细胞中也具有较高的表达特异性,可能参与调控血细胞对外源物的吞噬与包囊[12,30],因此推测整合素2在血细胞参与的免疫反应中也可能发挥着重要的作用。整合素2具有整合素亚基保守的结构特征和功能性基序(图1),暗示整合素具有高度的保守性。
为了探索整合素2在免疫反应中的功能,首先利用实时荧光定量PCR技术检测受到不同病原微生物刺激后血细胞中整合素2表达水平的变化,发现大肠杆菌和金黄色葡萄球菌均能够显著诱导其表达(图2),暗示整合素2可能广泛参与血细胞对各种病原微生物入侵的免疫应答。为了进一步探索整合素2在免疫反应中的角色与功能,截取了完整的胞外域区域进行原核诱导,通过亲和层析方法获得高纯的重组蛋白,该蛋白为探索整合素2的功能提供了便利。在整合素的研究中,体外重组蛋白是一种有用的研究材料。Zhang等[32]利用相似的方法获得南美白对虾()整合素的重组蛋白rLvIntegrin,发现rLvIntegrin具有细菌凝聚和促进NIH3T3细胞增殖的能力。笔者课题组前期利用不同的原核表达载体和诱导条件,尝试诱导可溶性重组蛋白的表达,但均表达于包涵体。Wang等成功利用包涵体形式的体外重组蛋白对刺参()和中华绒螯蟹()中整合素相关免疫功能进行探究[33-34]。
整合素具有结合各种PAMPs的能力,牡蛎()整合素Cg Integrin证实是一种模式识别受体,能够结合与识别LPS[35],一种日本刺参()也具有与LPS结合的能力[33]。而中华绒螯蟹整合素成员EsIntegrin通过直接结合LPS和PGN能够协助机体清除多种病原菌[34]。这些研究结果都提示整合素可以作为一种模式识别受体,通过与各种病原菌和病原分子模式直接结合而参与免疫反应。本研究发现,家蚕整合素2的纯化重组蛋白可以与多种病原菌和病原分子模式结合,其中与革兰氏阳性菌和其相应的病原分子模式的结合能力要强于阴性菌的,提示家蚕整合素2也是一种病原分子模式。本研究只检测了4种病原微生物,下一步还需要检测整合素2与更多类型病原菌的结合情况。
4 结论
整合素2具有典型的整合素亚基结构特征,推测其具有整合素家族保守的功能。病原微生物能够显著诱导整合素2在血细胞的表达,利用原核表达系统成功获得重组蛋白,通过蛋白纯化获得高纯的重组蛋白。重组蛋白能够与LPS、PGN等病原相关分子模式(PAMPs)结合,表明整合素2可能是一种模式识别受体。重组蛋白与革兰氏阳性菌的结合能力要强于阴性菌,对不同的病原入侵微生物具有不同程度的凝聚作用。整合素2具有识别和结合PAMPs能力,通过与细菌的直接结合而实现对入侵病原微生物的凝聚作用,进而在细菌免疫反应中发挥重要作用。
[1] Takada Y, Ye X, Simon S. The integrins., 2007, 8(5): Article 215.
[2] Giancotti F G. A structural view of integrin activation and signaling., 2003, 4(2): 149-151.
[3] Hughes A L. Evolution of the integrinandprotein families., 2001, 52(1): 63-72.
[4] Banno A, Ginsberg M H. The ins and outs of integrin signaling// Laflamme S E, Kowalczyk A P.. Wiley-VCH Verlag GmbH & Co. KGaA, 2008: 1-23.
[5] Hood J D, Cheresh D A. Role of integrins in cell invasion and migration., 2002, 2(2): 91-100.
[6] Huttenlocher A, Horwitz A R. Integrins in cell migration., 2011, 3(9): a005074.
[7] Brooks P C, Montgomery A M, Rosenfeld M, Reisfeld R A, Hu T, Klier G, Cheresh D A. Integrinv3 antagonists promote tumor regression by inducing apoptosis of angiogenic blood vessels., 1994, 79(7): 1157-1164.
[8] Meredith J E, Schwartz M A. Integrins, adhesion and apoptosis., 1997, 7(4): 146-150.
[9] Giancotti F G, Ruoslahti E. Integrin signaling., 1999, 285(5430): 1028-1032.
[10] Desgrosellier J S, Cheresh D A. Integrins in cancer: biological implications and therapeutic opportunities., 2010, 10(1): 9-22.
[11] Zhang K, Xu M, Su J, Yu S, Sun Z, Li Y, Zhang W, Hou J, Shang L, Cui H. Characterization and identification of the integrin family in silkworm,., 2014, 549(1): 149-155.
[12] Zhang K, Tan J, Man X, Su J, Hu R, Chen Y, Fan X, Rui Y, Cui H. A novel granulocyte-specificintegrin is essential for cellular immunity in the silkworm., 2014, 71: 61-67.
[13] Zhang K, Tan J, Su J, Liang H, Shen L, Li C, Pan G, Yang L, Cui H. Integrin3 plays a novel role in innate immunity in silkworm,., 2017, 77: 307-317.
[14] 孙亚兰. 家蚕整合蛋白基因的克隆及其表达分析[D]. 武汉: 华中师范大学, 2009.
SUN Y L. cDNA cloning and gene expression of integrinsubunits from[D]. Wuhan: Central China Normal University, 2009. (in Chinese)
[15] Nagaosa K, Okada R, Nonaka S, Takeuchi K, Fujita Y, Miyasaka T, Manaka J, Ando I, Nakanishi Y. Integrinν-mediated phagocytosis of apoptotic cells inembryos., 2011, 286(29): 25770-25777.
[16] Xie X, Auld V J. Integrins are necessary for the development and maintenance of the glial layers in theperipheral nerve., 2011, 138(17): 3813-3822.
[17] Zusman S, Grinblat Y, Yee G, Kafatos F C, Hynes R O. Analyses of PS integrin functions duringdevelopment., 1993, 118(3): 737-750.
[18] Bunch T A, Graner M W, Fessler L I, Fessler J H, Schneider K D, Kerschen A, Choy L P, Burgess B W, Brower D L. The PS2 integrin ligand tiggrin is required for proper muscle function in., 1998, 125(9): 1679-1689.
[19] Brown N H. Cell-cell adhesion via the ECM: integrin genetics in fly and worm., 2000, 19(3): 191-201.
[20] Schotman H, Karhinen L, Rabouille C. dGRASP- mediated noncanonical integrin secretion is required forepithelial remodeling., 2008, 14(2): 171-182.
[21] Lin G, Zhang X, Ren J, Pang Z, Wang C, Xu N, Xi R. Integrin signaling is required for maintenance and proliferation of intestinal stem cells in., 2013, 377(1): 177-187.
[22] Lavine M D, Strand M R. Haemocytes fromexpress multipleandintegrin subunits., 2003, 12(5): 441-452.
[23] Pech L L, Strand M R. Encapsulation of foreign targets by hemocytes of the moth(Lepidoptera: Noctuidae) involves an RGD-dependent cell adhesion mechanism., 1995, 41(6): 481-488.
[24] Mahairaki V, Lycett G, Sidén-Kiamos I, Sinden R E, Louis C. Close association of invadingandintegrin in themidgut., 2005, 60(1): 13-19.
[25] Moita L F, Vriend G, Mahairaki V, Louis C, Kafatos F C. Integrins ofand a putative role of a new beta integrin, BINT2, in phagocytosis of., 2006, 36(4): 282-290.
[26] Mamali I, Lamprou I, Karagiannis F, Karakantza M, Lampropoulou M, Marmaras V J. Aintegrin subunit regulates bacterial phagocytosis in medfly haemocytes., 2009, 33(7): 858-866.
[27] Hu J, Zhao H, Yu X, Liu J, Wang P, Chen J, Xu Q, Zhang W. Integrin1 subunit fromhemocytes: molecular characterization, expression, and effects on the spreading of plasmatocytes., 2010, 56(12): 1846-1856.
[28] Xu Q, Yu X, Liu J, Zhao H, Wang P, Hu S, Chen J, Zhang W, Hu J.integrin1 may be involved in polymerization of actin to modulate spreading and encapsulation of plasmatocytes., 2012, 37(3/4): 438-445.
[29] Levin D M, Breuer L N, Zhuang S, Anderson S A, Nardi J B, Kanost M R. A hemocyte-specific integrin required for hemocytic encapsulation in the tobacco hornworm,., 2005, 35(5): 369-380.
[30] 谈娟, 张奎, 徐曼, 陈思源, 崔红娟. 家蚕整合素基因的鉴定及亚细胞定位. 中国农业科学, 2013, 46(22): 4808-4815.
TAN J, ZHANG K, XU M, CHEN S Y, CUI H Y. Identification and subcelluar localization offrom silkworm ()., 2013, 46(22): 4808-4815. (in Chinese)
[31] 李重阳, 张奎, 申利, 赵羽卒, 潘光照, 徐曼, 苏晶晶, 崔红娟. 家蚕整合素1基因的克隆及表达. 生物工程学报, 2017, 33(12): 1955-1967.
Li C Y, Zhang K, Shen L, ZHAO Y Z, PAN G Z, XU M, SU J J, CUI H Y. Cloning and expression ofsilkworm., 2017, 33(12): 1955-1967. (in Chinese)
[32] Zhang Y, Wang L, Wang L, Wu N, Zhou Z, Song L. An integrin from shrimpmediated microbial agglutination and cell proliferation., 2012, 7(7): e40615.
[33] Wang Z, Shao Y, Li C, Lv Z, Wang H, Zhang W, Zhao X. A-integrin from sea cucumberexhibits LPS binding activity and negatively regulates coelomocyte apoptosis., 2016, 52: 103-110.
[34] HUANG Y, Zhao L L, Feng J L, Zhu H X, HUANG X, REN Q, Wen W. A novel integrin function in innate immunity from Chinese mitten crab ()., 2015, 52(2): 155-165.
[35] Jia Z, Zhang T, Jiang S, Wang M, Cheng Q, Sun M, Wang L, Song L. An integrin from oystermediates the phagocytosis towardthrough LPS binding activity., 2015, 53(1): 253-264.
Expression, purification and immunologic function of Integrin2 in the silkworm ()
ZHANG Kui, LI Chongyang, SU Jingjing, TAN Juan, XU Man, CUI Hongjuan
(State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716)
【Objective】The objective of this study is to analyze the gene sequence and structural characteristics of integrin2 in silkworm (), and its expression profile in hemocytes following the larval exposure to different bacterial pathogens, investigate the binding and agglutination properties of the recombinant integrin2 protein to various pathogen-associated molecular patterns (PAMPs) and bacteria, which will lay a foundation for further exploring the protein function of integrin2 in. 【Method】Bioinformatics tools were used to determine the sequence and structural characteristics of integrin2, and real-time fluorescent quantitative PCR (RT-qPCR) assay was executed to evaluate expression profile in hemocytes after microbial (and) challenge. The cDNA fragment of integrin2 was amplified using PCR, and the fragment containing the extracellular domain was inserted into a prokaryotic expression vector (pET22b). The insertion was confirmed in the recombinant plasmid and transformed intoRosetta (DE3), and then induced by IPTG to produce recombinant protein. The recombinant protein was purified using Ni-NTA affinity chromatography and analyzed by SDS-PAGE and western blot. ELISA and western blot were executed to determine the binding abilities of the recombinant protein to PAMPs (LPS and PGN) and different bacteria. Moreover, the agglutination ability and bacterial clearance assay were performed to understand the specific biological roles of integrin2 in immunity.【Result】integrin2 contains typical integrinsubunits, which comprises a long extracellular domain, a single transmembrane region and a short cytoplasmic tail. Further, it has several conserved motifs such as the MIDAS, EGF domain, Cys-repeat sequences and NPxY motifs. The RT-qPCR analysis showed that theexpression varied significantly in hemocytes after infection with bacteria. High purity recombinant protein was obtained by prokaryotic expression and protein purification. The results of SDS-PAGE and Western blot showed that the purified recombinant protein was of high purity and could be used in subsequent tests. ELISA assay indicated that the purified recombinant integrin2 protein had a strong binding ability to PAMPs (LPS and PGN). The results of bacterial binding test showed that the recombinant protein could bind many bacteria, but the binding ability with Gram-positive bacteria was higher than that with Gram-negative bacteria. The agglutination assay showed that the recombinant protein had strong agglutination effects onin the presence of ca2+. Further, bacterial clearance assay suggested that the recombinant protein could effectively promote the cleaning of exogenous invading bacteria from. 【Conclusion】The integrin2 has a typical structure of theintegrin family, and it can recognize PAMPs (LPS and PGN) and enhance the aggregation of invading microbial pathogens by directly binding to them. Taken together, integrin2 may play an important biological role in the bacterial immune response of.
; integrin2; microbial challenge; prokaryotic expression; bacterial agglutination
10.3864/j.issn.0578-1752.2019.01.016
2018-08-08;
2018-08-24
国家自然科学基金(31802142)、中国博士后科学基金(2017M620408)、重庆市自然科学基金(cstc2016jcyjA0425)、重庆高校创行团队建设基金(CXTDX201601010)
张奎,Tel:023-68253750;E-mail:Zhangk87@gmail.com,Zhangk87@163.com。通信作者崔红娟,Tel:023-68251713;E-mail:Hongjuan.cui@gmail.com,hcui@swu.edu.cn
(责任编辑 岳梅)

