牛多杀性巴氏杆菌病灭活疫苗的实验室制备及小鼠攻毒试验分析
赫鸣睿
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
牛荚膜A型多杀性巴氏杆菌是引起牛呼吸道疾病的主要病原菌之一[1],患病牛表现出纤维素性肺炎,呼吸困难,个别病例伴有血便等其他消化道症状[2],能引起犊牛很高的死亡率,该病已呈世界性流行和分布[3]。近年来,由该菌感染引起的牛肺炎在世界多个地区规模化牛场中频繁发生,造成犊牛大批死亡严重影响养牛业的发展[4-5],在中国关于牛A型多杀性巴氏杆菌病疫苗的研究很少。灭活疫苗在生产使用方面更加安全稳定,而且制作成本低具有良好的保护效果[6]。如今,在中国兽药市场上,牛A型多杀性巴氏杆菌疫苗的生产仍处于空白状态。因此,有必要开发一种针对牛A型多杀性巴氏杆菌病的疫苗[7]。
1 试验材料
牛A型多杀性巴氏杆菌WC1654株、LD01株分离于五常市和林甸县某牛场肺炎发病犊牛,菌株分离后进行冻干保存。试验动物购自北京威通利华动物有限公司,选用体重在18~22 g昆明系小白鼠且雌雄各半。无菌绵羊血、蜂胶佐剂由本实验室保存,革兰氏染色液(批号:20180426)购自安徽省巢湖市弘慈医疗器械有限公司。脑心浸液(批号:20170603)和营养琼脂(批号:20160802)购自青岛海博生物科技有限公司,生化试管(批号:170509)购自杭州滨河微生物试剂有限公司。
2 试验方法
2.1 菌液制备及镜检多杀性巴氏杆菌WC1654株、LD01株分别接种于含有5%绵羊血的营养琼脂培养基上的,然后置于37℃的培养箱中培养24 h后进行观察。挑取在含有5%羊血的营养琼脂培养基上的单个菌落,均匀涂布于载玻片上酒精灯干燥固定,进行革兰氏染色及显微镜检查。多杀性巴氏杆菌WC1654株、LD01株的单个菌落分别接种到脑心浸液肉汤中放入空气浴摇床中37℃进行增菌培养,培养24 h作细菌种子液。将两株多杀性巴氏杆菌的种子液按照1:100比例接种到脑心浸液肉汤中进行增菌培养24 h作为疫苗制备液。
2.2 细菌生化鉴定 将菌落纯培养物分别接种到肌醇、麦芽糖、甘露糖蔗糖、半乳糖、鼠李糖、果糖、葡萄糖、乳糖、明胶、甘露醇、木糖、糊精、山梨醇、甲基红、Vp试验、靛基质等生化管中37℃培养24 h,观察结果并记录。
2.3 多杀性巴氏杆菌毒力基因PCR鉴定 高温水浴法提取DNA,菌体洗涤:取200 μL菌液于EP管中,再加入等体积磷酸盐缓冲溶液(PBS)混合,将EP管12 000 r/min离心3 min,弃上清,按以上步骤使用PBS对菌液进行洗涤2~3次。菌体高温加热:EP管在水浴锅加热20 min加热温度为100℃。模板DNA提取:加热后在12 000 r/min离心15 min,吸上清于-20℃冰箱保存。
PCR反应体系:上、下游引物(10 μM)0.5 μL、DNA 1 μL、TaqMasterMix(5 U/μL)12.5 μL,补充去离子水至总体积为25 μL。反应程序:95℃预变性5 min;94℃变性30 s,56℃退火45 s,72℃延伸1 min,30个循环;72℃终延伸5 min。反应结束后,PCR产物加到1%琼脂糖凝胶孔内,电泳仪电压设置150 V,接通电泳槽。25 min后取出凝胶,用紫外凝胶成像系统观察并拍照保存。

表1 引物序列Table 1Peimer sequence
2.4 多杀性巴氏杆菌LD 50的测定 将WC1654株和LD01株菌液分别调至不同浓度后腹腔注射小鼠,9组小鼠注射剂量均是0.2 mL/只,活菌数分别为1.0×109、1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101CFU/只,每组10只小鼠,共18组,设10只小鼠作为对照组每只注射0.9%生理盐水0.2 mL,在注射后第1 d至第10 d不同时间段对小鼠进行观察。
2.5 疫苗制备使用工作浓度为1.5%甲醛溶液与菌液1:10混匀,将含有终浓度为0.15%甲醛溶液的菌液放于37℃空气浴摇床中振荡24 h,将灭活后的菌液分别接种在含5%绵羊血营养琼脂培养基和脑心浸液肉汤中,37℃培养48 h检验灭活效果。将灭活的WC1654株和LD01株菌液10倍浓缩再1:1混合,将混合菌液与蜂胶佐剂1:1配制成灭活疫苗,放入4℃冰箱保存,疫苗含菌量为4.38×1010CFU/mL。
2.6 疫苗的安全性检验将制备好的疫苗接种在含5%绵羊血营养琼脂培养基上,37℃培养7 d,观察细菌是否生长。取10只小白鼠,分别皮下多点注射疫苗,1 mL/只;观察10 d,记录食欲、精神状态、注射部位变化及全身反应。
2.7 攻毒保护试验试验组和对照组各取10只分成2个攻毒组,每组40只小鼠,用3倍LD50活菌液WC1654株和3倍LD50活菌液LD01株分别攻毒,攻毒时间为3次免疫结束后第10天,观察7 d内小鼠的发病及死亡情况。
3 结果与分析

表2 小鼠免疫分组Table 2The mice immune group
3.1 疫苗的无菌检验及安全性检验结果血液琼脂培养基无任何微生物生长。小鼠接种10 d后均健活,经过蜂胶佐剂疫苗注射的小鼠其注射部位皮肤上无肿块、无毛发脱落、无化脓现象,小鼠食欲、尿液、粪便均为正常状态。

图1 多杀性巴氏杆菌WC1654镜检结果Fig.1Pasteurella WC1654 microscopic examination results
3.2 细菌镜检结果细菌为两端钝圆的革兰氏阴性短小杆菌,个别菌体可呈近似椭圆形,多单独或成对存在,不形成芽胞,符合多杀性巴氏杆菌形态特异性,镜检结果见图1和图2。
图2 多杀性巴氏杆菌LD01镜检结果Fig.2Pasteurella LD01 microscopic examination results
3.3 生化试验结果这两株菌均符合多杀性巴氏杆菌的生化特性,具体结果见表3。
3.4 PCR检测结果LD01株多杀性巴氏杆菌和WC1654株多杀性巴氏杆菌5种毒力基因扩增片段与预期目的片段大小相符,见图3和图4。
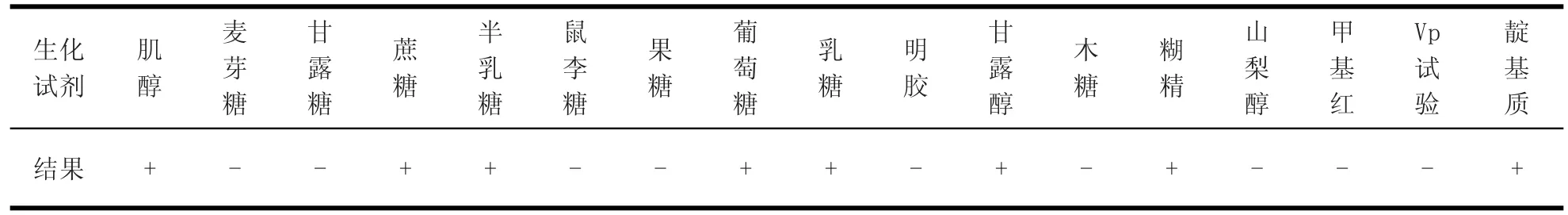
表3 多杀性巴氏杆菌生化试验结果Table 3 Pasteurella biochemical reaction results

图3 LD01毒力基因PCR电泳结果Fig.3 Pasteurella LD01 virulence gene electrophoresis results
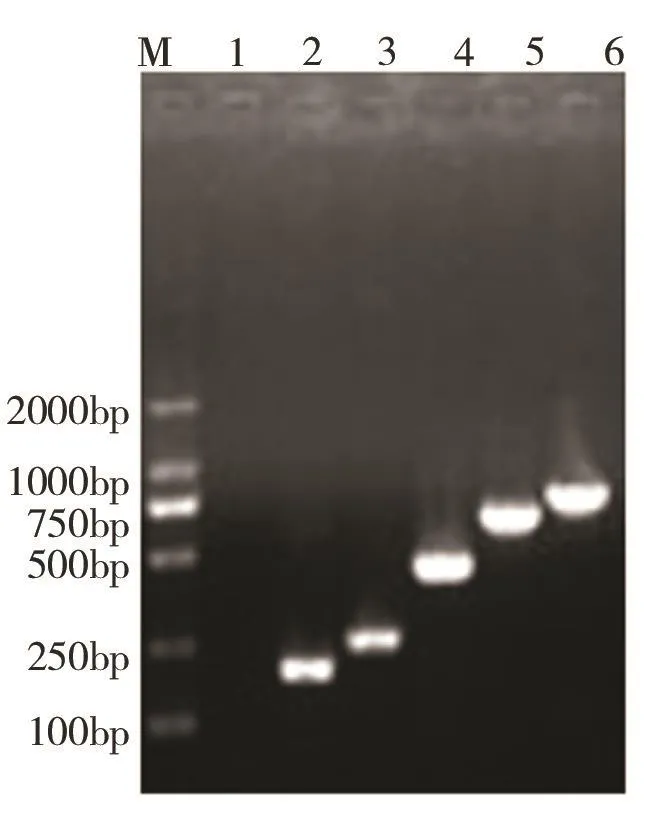
图4 WC1654毒力基因PCR电泳结果Fig.4 Pasteurella WC1654 virulence gene electrophoresis results
3.5 多杀性巴氏杆菌LD 50结果多杀性巴氏杆菌WC1654株的半数致死量(LD50)为3.78×107CFU,多杀性巴氏杆菌LD01株的半数致死量(LD50)为1.31×107CFU。
3.6 攻毒保护试验结果 以WC1654株攻毒后,7 d内对照组全部死亡,Group 1在7 d内死亡8只小鼠Group 2在7 d内死亡6只小鼠Group 3在7 d内死亡4只小鼠,以LD01株攻毒后,7 d内对照组全部死亡,Group 1在7 d内死亡9只小鼠 ,Group 2在7 d内死亡7只小鼠Group 3在7 d内死亡4只小鼠,Group 3中小鼠存活率都很高,且保护率均为60%。
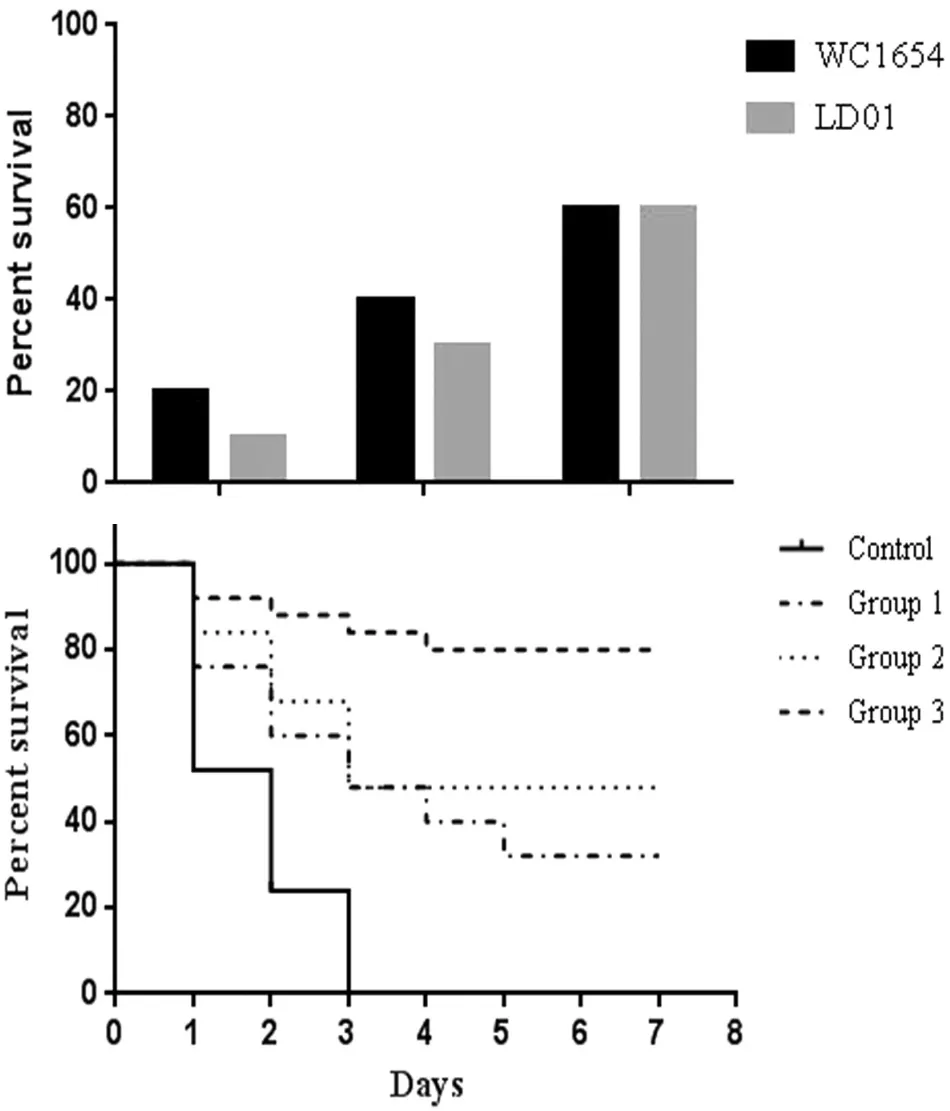
图5 攻毒保护结果Fig.5Challenge results
4 讨论
据不完全统计我国畜牧养殖企业抗生素滥用的现象很多,一些抗生素对动物体免疫功能起到有害影响,还有一些抗生素可产生肾毒性、肝毒性造成机体损伤,抗生素滥用使得耐药菌株大量产生,可供选择治疗药物的空间也变小[8-10]。使细菌性疾病的药物防治工作更加棘手。因此研制有效的疫苗来预防细菌性疾病,越来越受到重视并被广泛的采用。灭活疫苗主要由死亡的菌体组成,因此比较安全、稳定[11-12]。灭活菌体在体内不能扩增,这使抗原免疫量有限,所以需多次接种灭活疫苗,才能产生比较牢固的免疫力。我国是养牛大国,传统不科学的养牛方式在牛场工作者心中根深蒂固,牛舍建造简陋、牛群生存环境差、饲养密度过大、牛排泄物得不到妥善清理及饲料水源不清洁等现象都特别常见,这些情况的出现是影响我国养牛业健康发展的大问题,在国内许多奶牛、肉牛养殖场中,细菌性疾病混合感染的病例特别常见,根据这一情况,高效的灭活细菌疫苗将受到极大关注。而且灭活疫苗具有制造成本低、制作周期短、安全性高等实际优势和生产优势,所以灭活菌苗更利于投放我国的兽药市场。

