Wnt/β-catenin信号通路对毛囊干细胞增殖和分化的调控作用
夏肖雪 综述 吕正梅,张守兵 审校
毛囊干细胞(hair follicle stem cells,HFSCs)是一群位于毛囊隆突部的成体干细胞,具有一般干细胞的基本特性,即自我更新能力和多潜能性[1]。与胚胎干细胞的持续增殖和分化不同,它在大部分时间里处于静息状态,只在毛囊生长期早期被激活。它不仅维持正常皮肤中毛囊的再生,在皮肤损伤时移植毛囊干细胞还能重建毛囊、表皮和皮脂腺[2]。毛囊干细胞的增殖和分化受到严格调控,Wnt/β-catenin信号通路是其中重要的调控通路之一。
1 毛囊干细胞在毛囊发生和毛囊周期中的作用
目前普遍认为,在胚胎期毛囊的发育过程中,表皮成分与真皮成分间一系列复杂的相互作用诱导毛囊的形态学发生:首先,真皮细胞发出信号,诱导表皮基底细胞增厚形成毛基板;之后,毛基板细胞释放趋化因子,诱导间充质成纤维细胞增生、聚集形成真皮聚集体,毛基板细胞增殖,形成毛芽,真皮聚集体最终发育成真皮乳头;真皮乳头细胞释放信号,刺激毛囊干细胞增生,形成毛钉,并分化成毛囊中的各种细胞,形成完整毛囊及毛干[3](图1)。
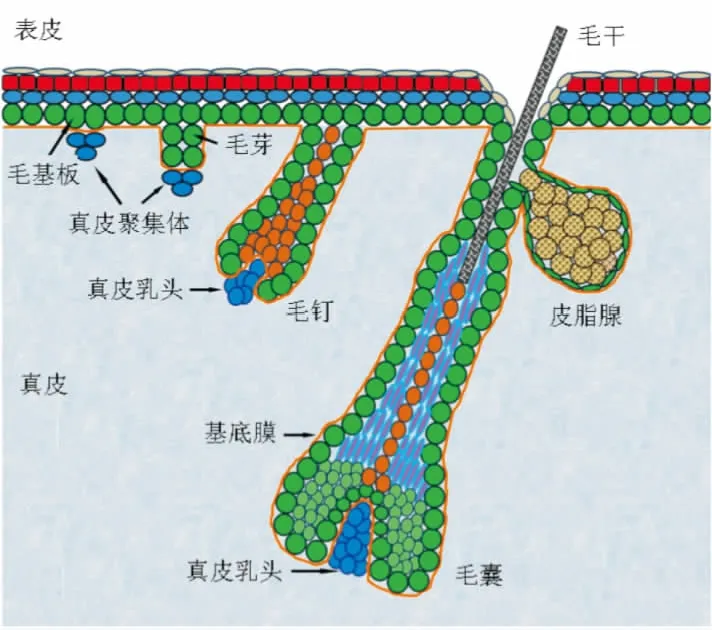
图1 毛囊发生示意图
毛发的生长不是连续的,而是呈现周期性,称为毛囊周期,包括生长期、退行期、静止期。在生长期末期,有丝分裂活动减缓并最终停止,继而凋亡活动加剧,毛囊进入退行期,最终剩余的细胞在隆突部下方形成毛芽,真皮乳头位于毛芽下方;在静止期,毛囊干细胞处于静息状态;之后,毛芽和隆突部中的干细胞在真皮乳头传递的信号刺激下被激活、增殖,毛囊进入下一个生长期,新形成的毛母质细胞包裹真皮乳头,不断增殖和分化,形成新的完整毛囊并产生毛干[4](图2)。
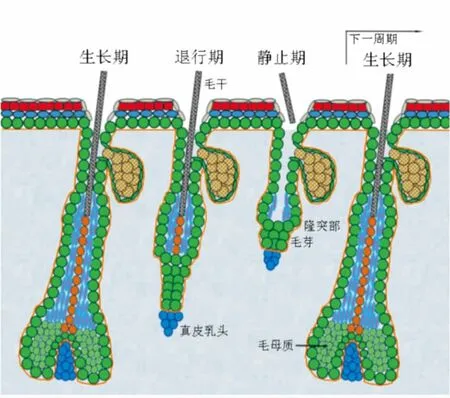
图2 毛囊周期示意图
Wnt/β-catenin信号通路广泛存在于多细胞真核生物中,高度保守。它在诱导毛囊形态发生、维持毛囊生长发育、干细胞聚集、迁移以及分化过程中发挥重要作用。在毛囊的周期性生长中,真皮乳头被认为是调节毛囊形态发生和毛发生长的信号转导中心,可通过Wnt/β-catenin信号通路诱导毛囊干细胞的增殖和分化。若Wnt失调,不仅会出现增殖和分化的失衡,还会导致肿瘤的发生[5]。
2 Wnt/β-catenin信号通路
Wnt蛋白是一类富含半胱氨酸的分泌性糖蛋白,可通过旁分泌或自分泌发挥作用,与细胞膜上的七次跨膜卷曲蛋白(Frizzled)受体家族及低密度脂蛋白受体相关蛋白(LDL receptor related protein,LRP)结合,稳定并积累胞质内的β-catenin[6]。哺乳动物的基因组编码十七种Wnt蛋白,在皮肤中表达的有Wnt3、Wnt4、Wnt5a、Wnt6、Wnt7a、Wnt7b、Wnt10a、Wnt10b、Wnt11和 Wnt16[7]。
β-catenin蛋白是Wnt信号通路的重要分子之一,参与胚胎形成及个体发育等多个生物学过程。在没有Wnt时,细胞中的β-catenin与α-catenin及钙黏素E(E-cadherin)形成复合物,参与细胞间以及细胞与细胞外基质的黏合连接;而胞质中游离的β-catenin被核心蛋白轴蛋白(axis inhibition,Axin)、腺瘤样结肠息肉病蛋白(adenomatous polyposis coli,APC)、酪蛋白激酶-1α(casein kinase 1 alpha,CK1α)和糖原合成激酶-3β(glycogen synthase kinase 3 beta,GSK3β)组成的复合体磷酸化,E3泛素连接酶β-TrCP(β transducinrepeats-containing proteins,β-TrCP)识别磷酸化的β-catenin,通过蛋白酶体途径将其降解,转录因子LEF/TCF(lymphoid enhancer factor/T-cell factor)与转录抑制因子TLE(transducin-like enhancer)结合,使染色体处于非活化状态(图3A)。而当Wnt结合到Frizzled和LRP5/6时,激活胞质蛋白Dvl(Dishevelled),导致LRP5/6被CK1α和GSK3β磷酸化,Axin与LRP5/6结合,胞质中游离的β-catenin不被磷酸化而积累下来。β-catenin入核,取代TLE而与转录因子LEF/TCF结合,招募两种组蛋白修饰因子CREB结合蛋白(CREB-binding protein,CBP)和Brg1以及辅激活因子如Bcl9和Pygo(Pygopus),激活靶基因的表达(图3B)[6, 8]。
3 Wnt/β-catenin信号通路在毛囊发生和毛囊干细胞增殖中的作用
3.1Wnt/β-catenin信号通路的激活诱导毛囊的发生在胚胎期毛囊发育过程中,Wnt/β-catenin信号通路的激活是毛基板形成的一个关键起始步骤[9]。分别在小鼠表皮角质细胞或真皮成纤维细胞中特异性地将Wnt分泌相关基因Evi/Wls(Wntless)敲除后发现,表皮来源的Wnt配体对真皮上部Wnt信号通路的激活是至关重要的,而后者的激活最终导致毛基板的形成[9-10]。这些研究表明,Wnt介导的信号首先出现在表皮内,其后才发生表皮和真皮间的复杂相互作用及形成毛囊。此外,过表达Wnt细胞外抑制剂DKK1 (Dkk-1)的转基因小鼠能阻断Wnt/β-catenin信号通路,从而影响毛囊的发生和发育,甚至最终导致出生后小鼠毛囊的缺失[11]。在胚胎发生期,条件性敲除表皮中的β-catenin基因导致毛基板的形成受阻,从而阻断了毛囊的形态发生[12]。此外,毛基板形成后,在从毛芽到毛钉发育过程中,毛钉上部区域中的Wnt/β-catenin信号减弱,是毛囊干细胞形成的前提条件,因为Wnt/β-catenin信号抑制SOX9,而后者是毛囊干细胞形成所必需的[13]。
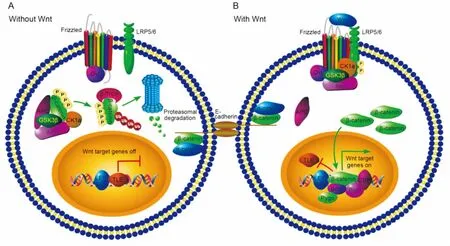
图3 Wnt/β-catenin信号通路
3.2Wnt信号调控毛囊干细胞的增殖毛囊形成后,在哺乳动物的一生中处于生长期、退行期和静止期的周期性循环中(图2)。毛囊周期中,毛囊干细胞的静息和激活受到微环境细胞来源的骨形成蛋白(bone morphogenetic protein,BMP)信号和Wnt信号的严格调控。在静止期,真皮成纤维细胞表达BMP4,皮下脂肪细胞表达BMP2,隆突部内层角蛋白K6+细胞分泌高水平的BMP6和FGF18。上述BMP蛋白和FGF18均抑制毛囊干细胞的增殖而将其维持在静息状态。静止期末期,BMP表达降低,使毛囊干细胞较易于激活[5]。真皮乳头通过分泌BMP抑制因子Noggin将毛囊干细胞中的BMP信号关闭,转换为Wnt/β-catenin信号,从而激活毛囊干细胞增殖,毛囊进入生长期。实际上,从静止期早期到晚期,真皮乳头中毛芽激活因子如FGF-7、FGF-10和 TGF-β2 以及BMP抑制因子Noggin的水平是逐渐升高的[14]。如果去除真皮乳头,静止期毛囊不能进入生长期,说明真皮乳头对于毛囊干细胞的激活来说是必需的[14]。在表达的Wnt蛋白中,Wnt7b可能在激活Wnt/β-catenin通路中起重要作用,该蛋白在出生后第一个生长期启动时(出生后第21天)表达,但在静止期不表达,若出生后敲除Wnt7b,毛囊干细胞的激活被迟滞[15]。然而,虽然关于毛囊从静止期进入生长期调控机制的研究很多,但最早的激活机制是什么,或者说,上述信号通路又是被如何调控的,目前还不得而知。
Wnt、β-catenin和下游的LEF/TCF都在毛囊的再生中发挥重要作用。2013年,Choi et al[16]通过分别在整个表皮中、毛囊干细胞中和在毛囊间表皮中敲除β-catenin并与异位表达DKK1的结果相比较发现,Wnt/β-catenin信号通路对毛囊干细胞的增殖来说是必需的,但毛囊干细胞的维持不需要β-catenin存在于毛囊干细胞中。Lei et al[17]的结果证明,小鼠触须Wnt10b蛋白的过表达可激活经典Wnt信号通路,促进毛母质细胞的增殖,从而诱导毛囊进入生长期;腺病毒介导的Wnt10b蛋白过表达诱导毛囊由静止期进入生长期。相反,siRNA介导的Wnt10b基因敲除可阻止毛囊进入生长期[18]。Wnt10b介导的Wnt通路异常激活会使处于增殖状态CD34+毛囊干细胞的数量增加,导致毛球、毛干和真皮乳头都变大[19]。这些结果都表明,Wnt10b可通过激活Wnt信号通路促进毛囊干细胞增殖。
在成年小鼠的表皮中短暂表达β-catenin,正常的毛囊周期被打断而进入生长期,并从头形成新的毛囊[20],表明依赖β-catenin的Wnt通路足以诱发毛囊干细胞的增殖及后继新毛囊的生长。而在成体毛囊的真皮乳头中敲除β-catenin基因,毛囊不能进入生长期[21],说明真皮乳头中的β-catenin对毛囊干细胞的增殖也具有调控作用。在体外培养条件下,β-catenin敲除的毛囊干细胞能够自我更新和长期传代;但是在体内,毛囊干细胞高表达TCF3/4,在没有β-catenin激活的情况下,长时间处于静息状态而不增殖。进一步研究表明,对毛囊干细胞增殖的激活来说,β-catenin并不是必需的,如果TCF3/4的水平有效降低,不需要β-catenin即可激活增殖[22]。也就是说,TCF3/4的水平下降或是Wnt/β-catenin的水平上升,都会打破毛囊干细胞的静息状态,使毛囊进入生长期。
Garza et al[23]发现,雄激素性秃顶男性的头皮中,K15+α6-整合素+的毛囊干细胞仍然存在,但前体细胞包括CD200+α6-整合素+和CD34+细胞均显著减少,可能是导致毛囊体积变小、毛干短小的原因。这说明在秃顶头皮中,毛囊干细胞的激活存在障碍,但是否是由于Wnt信号通路失调导致的,目前尚未发现相关研究。
关于静止期隆突部毛囊干细胞中的Wnt/β-catenin信号通路,很多结果倾向于认为其处于被抑制的状态,例如Wnt抑制因子SFRP1、Dkk3和WIF1在毛囊干细胞和真皮乳头中高表达,而Wnt蛋白Wnt3和Wnt3a表达下调3倍以上[5]。Dasgupta et al[24]和Lien et al[22]分别发现,Wnt/β-catenin信号通路的报告基因TOPGAL和Axin2-LacZ在静止期毛囊干细胞中处于失活状态,这与静止期隆突部毛囊干细胞核中无β-catenin是一致的。然而,2016年,Lim et al[25]发现,在整个静止期,Wnt/β-catenin信号通路的关键分子之一Axin2在处于静息状态的隆突部外根鞘毛囊干细胞中持续表达,当β-catenin被条件性敲除时,Axin2的表达缺失。因此,静止期毛囊干细胞中Axin2的表达依赖于β-catenin的存在,许多其他Wnt靶基因如Lgr5也是如此,这表明Wnt/β-catenin信号在静止期毛囊干细胞中可能是处于活化状态的。深入研究发现,在整个静止期中,Wnt1、Wnt4和Wnt7b在隆突部都表达,在外根鞘细胞中表达最高,Wnt5a不表达,而Wnt3、Wnt6、Wnt10a和Wnt10b虽然表达,但处于较低水平,这表明静止期隆突部毛囊干细胞本身即为Wnt信号的来源[25]。在从静止期向生长期过渡时,Axin2、Wnt1、Wnt4和Wnt7b在隆突部持续表达,而Wnt6、Wnt7b、Wnt10a和Wnt10b在毛芽和真皮乳头交界处的细胞中表达上调,后者表明某些Wnt蛋白可能参与表皮成分与真皮成分间的相互作用,以激活毛芽中的干细胞,启动生长期[25]。
另外,很多观点认为,毛囊一旦进入生长期后,毛囊干细胞中的Wnt信号即处于被抑制状态,以减少其增殖次数,维持其“干性”。然而Lim et al[25]发现,Wnt4、Wnt7b和Axin2在生长期毛囊的隆突部中持续表达,这表明在生长期,毛囊干细胞中的Wnt信号并没有被抑制,Wnt/β-catenin信号处于活化状态,然而其功能有待深入研究。
Wnt/β-catenin信号也可以通过下游转录因子实现其调控功能。最近,Telerman et al[26]发现,转录抑制因子Blimp1是Wnt/β-catenin信号通路的下游靶蛋白之一,在胚胎第12.5天敲除真皮成纤维细胞中的Blimp1会迟滞毛囊发生,阻止创伤后新毛囊的形成,在表皮中过表达β-catenin能消除因Blimp1敲除而导致的表型。
4 Wnt/β-catenin信号通路在毛囊干细胞分化中的作用
Wnt/β-catenin信号通路促进毛囊干细胞进入细胞周期,并根据不同的细胞信号向相应的细胞谱系方向进行分化。实验结果显示,高表达β-catenin诱导毛囊干细胞向毛囊的构成细胞方向分化;β-catenin低表达或缺乏时,毛囊干细胞不再参与毛发的自我更新,而是向着上皮角质细胞的方向分化[27]。Dasgupta et al[24]在出现上述现象后,再次使β-catenin过表达,上述过程发生翻转,即本来分化成上皮方向的细胞向形成毛囊结构的方向分化,使毛发的生长可以继续进行。另外,有研究[28]显示,提高稳定的β-catenin的含量,可诱导成年表皮新毛囊的形成。Lien et al[22]的研究也发现,在没有Wnt 信号时,TCF3/4和TLE结合到普通染色体区域,该区域含一些被抑制基因,这些基因在发生毛囊干细胞命运决定时必须被经典Wnt 信号抑制。
Wnt/β-catenin信号通路中的其他关键蛋白也在毛囊干细胞分化调控中发挥作用。在Wnt处于激活状态时,LEF-1最初表达于毛芽处的干细胞中,其后在短暂增殖的毛母质细胞进行定向分化并形成毛干时,在该群细胞中处于较高表达水平[22]。LEF-1敲除的小鼠出生后致死,其毛囊短小,发育停滞在胚胎第17天的水平,出生后不能产生触须和体毛,其毛囊中虽然能够分化形成黑色素细胞,但其功能异常,不能产生黑色素。相反,在隆突部和毛囊间表皮中过表达LEF-1,导致在表皮内形成毛芽样结构[29]。Wnt分泌相关基因Evi/Wls也被发现在毛囊干细胞中表达,在胚胎毛囊发育时将其敲除会导致毛发稀少,表皮增厚[25]。
5 展望
关于Wnt/β-catenin信号通路在毛囊干细胞增殖中的调控作用已经有了较多研究;然而,虽然毛囊干细胞子代细胞的定向分化在新毛囊的形成中至关重要,但该方面的研究极其匮乏。另外,β-catenin和DNA结合蛋白LEF/TCF是如何识别和调控其靶基因的,仍知之甚少。LEF/TCF蛋白在不同细胞和组织中对染色体的修饰不同,提示它们的靶基因和辅因子依赖于细胞类型及所处环境。在皮肤受到损伤时,表皮中Wnt/β-catenin信号通路的激活促进创伤修复处新毛囊的产生,然而近期的研究[30]显示,成年小鼠真皮成纤维细胞中β-catenin的上调抑制新毛囊的发生,具体原因有待进一步分析。
用毛囊干细胞构建组织工程皮肤,可用于临床治疗脱发患者的毛发再生、烧伤、烫伤与皮肤缺损患者的创面修复等。但是,早期的研究[2]证明,毛囊干细胞具有强大的增殖能力,在进行临床移植时,其增殖和分化行为必须受到精确调控。深入研究毛囊干细胞增殖和分化的调控机制,可极大促进对毛囊干细胞生物学特性的了解和认识,为其应用于临床提供理论基础。

