肉制品中羊源性成分的定性和定量检测
钱俊平,郭 梁*,海 小,郭元晟,雅 梅
(锡林郭勒职业学院生物工程研究院,锡林郭勒食品检验检测和风险评估中心,内蒙古 锡林浩特 026000)
肉制品是人类膳食结构的重要组成部分,肉制品中富含蛋白质、脂肪、碳水化合物、维生素和矿物质(包括微量元素)等营养物质,这些营养成分不仅是组成宏观人体和微观细胞的基础,也是调控人体生命活动和细胞内生物化学反应的重要基础物质[1]。肉制品除了含有丰富的常规营养成分之外,色、香、味俱佳的感官体验更是赋予其美食的内核。然而,伴随着日益增长的生产量和消费量,肉制品成为在食品生产、加工、流通及餐饮领域中造假掺假的主要目标[2-3]。一些不法企业和商贩用低价肉或非肉成分冒充高价肉,在牛肉、羊肉、鹿肉等高价肉制品中掺杂鸡肉、鸭肉等低价肉。这些造假掺假的欺诈违法行为对人类健康、消费者权益、市场公平交易机制及民族宗教等各方面都产生了巨大威胁[4-5]。动物源性成分检测技术能够应对上述问题,除了能保护消费者合法权益、维持市场公平交易机制、维护及尊重民族传统和宗教信仰,还能预防动物源性疾病(疯牛病、口蹄疫及牛海绵状脑病等)的传播[6-8]。
羊肉是消费者广泛食用的家畜肉之一,羊肉不仅营养丰富、肉质细嫩、容易消化、具有高蛋白、低脂肪、含磷脂多、胆固醇少的特点,同时羊肉的食用也没有宗教和文化的禁忌。目前,动物源性成分检测技术建立在对样品蛋白质、脂肪酸及核酸等分子结构、组成特异性或种属标签序列分析的基础上,通过种属特异分子鉴别肉制品的动物来源[9-11]。动物制品真伪鉴别所涉及的技术手段包括电泳[12-13]、免疫组化[14-15]、质谱[16]、色谱[17]、膜芯片[18]、环介导等温扩增(loop-mediated isothermal amplification,LAMP)[19-20]和聚合酶链式反应(polymerase chain reaction,PCR)[21-23]。由于蛋白质和脂肪酸在肉制品生产、加工、贮藏及运输过程中的不稳定性,使得相应检测技术耗时长、前处理复杂多样及检测成本较高;而脱氧核糖核酸(DNA)作为遗传物质包含全部遗传信息,并且基于其稳定性高的特点,加工过程中很难被破坏,是非常理想的标记物,能够很好地进行物种标记,用于准确鉴定动物制品的物种源性[24]。目前,以DNA为基础的PCR技术是全球肉制品真伪鉴别的主流技术[25-26]。其中,实时荧光PCR(real-time PCR,RT-PCR)技术以低耗时、强特异性、高灵敏度及高通量等优点成为近期研究热点。RT-PCR技术使用荧光染料(SYBR Green或EvaGreen)[27-29]或探针(TaqMan)[30-31],通过对每个循环的扩增产物进行实时监测,实现对目标DNA模板的定性和定量检测。相比以荧光染料为检测手段的RT-PCR技术,探针技术由于引入种属特异的TaqMan探针,提高了RT-PCR的特异性。目前,RT-PCR技术是动物源性成分检测的主流技术手段,相比普通PCR技术,其具有快速和高通量的特点,相比膜芯片和测序技术具有低成本和拥有潜在定量能力的特点,而且通过引物和探针的设计和优化可以实现多通道多源性同步检测。利用RT-PCR技术定性及定量检测动物源性成分已有大量报道。然而,其中还存在一些问题,如混合样品的检测灵敏度和定量曲线的适用性(用于鲜肉和加工肉制品)等。
本研究根据GB/T 25165—2010《明胶中牛、羊、猪源性成分定性检测方法 实时荧光PCR法》[32]设计引物和探针,建立鲜肉及加工肉制品中羊源性成分的TaqMan RT-PCR检测方法,并在标准的基础上利用DNA梯度稀释液为模板,评价方法的检测限,建立定量标准曲线,探讨方法的定量检测能力,并在此基础上对混合样品的检测灵敏度以及定量曲线在加工肉制品中的适用性进行研究,为下一步研发具有定性和定量检测能力的方法和标准提供借鉴。
1 材料与方法
1.1 材料与试剂
鲜肉(羊肉、黄牛肉、牦牛肉、水牛肉、猪肉、马肉、驴肉、鹿肉、狗肉、兔肉、鸭肉和鸡肉)及加工肉制品(蒙羊羊肉干、尚清斋鸡肉烤肠、金锣火腿肠、肉粒多火腿肠、呼纳斯牛肉干、金蒙典牛肉干、马肉干和五香驴肉)购于锡林浩特市德克隆超市及109农贸市场。鲜肉样品采集自肌肉组织,在采集和分装过程中避免交叉污染,-20 ℃保存。
TransStart Probe qPCR SuperMix购于北京全式金生物技术有限公司;引物和探针由北京睿博兴科生物技术有限公司合成。
1.2 仪器与设备
5418R Centrifuge高速台式离心机 德国Eppendorf公司;Nanodrop 2000c核酸蛋白测定仪 美国Thermo Fisher公司;7300 Plus实时荧光PCR扩增仪 美国ABI公司。
1.3 方法
1.3.1 引物和探针
根据GB/T 25165—2010,委托北京睿博兴科生物技术有限公司合成引物和探针。引物与探针序列如表1所示。
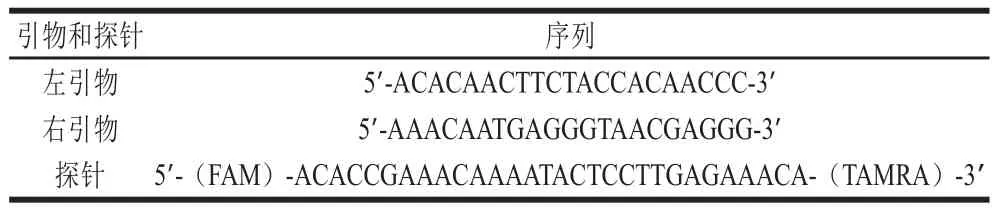
表 1 引物和探针序列Table 1 Primer and probe sequences used in this study
1.3.2 DNA提取
取10~20 mg肉制品样品,用液氮进行研磨,利用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法[33]提取其DNA,通过Nanodrop 2000c核酸蛋白分析仪测定其质量浓度;将母液稀释至100 ng/μL左右,保存于-20 ℃。
1.3.3 反应体系与反应条件
反应体系(20 μL):TransStart Probe qPCR SuperMix 10 μL、左引物和右引物各1 μL、探针1 μL、模板DNA 1 μL,补水至20 μL。
反应条件:94 ℃、1 min,1 个循环;94 ℃、5 s,60 ℃、31 s,45 个循环。
1.3.4 特异性实验
分别提取12 种动物鲜肉组织(羊肉、黄牛肉、牦牛肉、水牛肉、猪肉、马肉、驴肉、鹿肉、狗肉、兔肉、鸭肉和鸡肉)的DNA,对其进行RT-PCR扩增实验。根据PCR反应的循环阈(cycle threshold,Ct)值检验方法对于不同动物鲜肉组织的特异性。
混合样品(羊肉和猪肉)的制备:分别称取相应质量的羊肉和猪肉,利用液氮和研磨器制作羊肉质量分数为0.1%、1.0%、10.0%、30.0%、70.0%、90.0%、99.0%和99.9%的混合样品。分别提取8 种混合样品的DNA,对其进行RT-PCR扩增。
1.3.5 灵敏度实验
用灭菌ddH2O稀释羊肉DNA(质量浓度100 ng/μL),共8 个梯度,质量浓度分别为100、10、1、0.1、0.01、0.001、0.000 1、0.000 01 ng/μL。以不同质量浓度的DNA为模板进行RT-PCR反应,根据Ct值检验方法对于不同质量浓度模板DNA的检测灵敏度。
1.3.6 加工肉制品中羊源性成分的检测
分别提取不同加工肉制品的DNA,对其进行RT-PCR扩增实验。根据PCR反应的Ct值检验方法对于加工肉制品的适用性。用灭菌ddH2O稀释羊肉干DNA(质量浓度100 ng/μL),共8 个梯度,质量浓度分别为100、10、1、0.1、0.01、0.001、0.000 1、0.000 01 ng/μL。以不同质量浓度的羊肉干来源DNA为模板进行RT-PCR反应,根据Ct值检验方法对于不同质量浓度羊肉干模板DNA的检测灵敏度。
1.4 数据处理
利用RT-PCR扩增仪(ABI 7300 Plus)分析软件对扩增结果进行扩增曲线和Ct值的分析。
2 结果与分析
2.1 羊源性成分检测特异性实验

图1 12 种鲜肉样品中羊源性成分的扩增曲线Fig. 1 Amplif i cation curves of sheep-derived ingredients in 12 raw meats
利用羊源性成分检测的引物和探针对羊肉、黄牛肉、牦牛肉、水牛肉、猪肉、马肉、驴肉、鹿肉、狗肉、兔肉、鸭肉和鸡肉的DNA进行TaqMan RT-PCR扩增实验。由图1和表2可知,羊肉鲜肉样品(5 个羊肉样品,每个样品3 个平行)出现特异性扩增曲线,5 个羊肉样品的Ct值分别为(18.59±0.26)、(17.77±0.06)、(16.94±0.04)、(18.38±0.61)和(16.99±0.19),其他11 种动物鲜肉样品DNA均未出现典型扩增曲线。以上结果说明,本研究用于动物源性成分检测的引物和探针具有羊源性特异性,可以用于羊肉的真伪鉴定。

表 2 引物和探针的特异性扩增结果Table 2 Specif i c amplif i cation with the primers and probes
2.2 混合样品中羊源性成分的鉴定

图2 混合样品中羊源性成分的扩增曲线Fig. 2 Amplif i cation curves of sheep-derived ingredients in meat mixtures

表 3 混合样品中羊源性成分的鉴定结果Table 3 Identi fi cation of sheep-derived ingredients in meat mixtures
由图2和表3可知,8 种混合样品均出现典型特异性扩增曲线,羊肉含量为0.1%的混合样品Ct值为(28.88±0.15)。以上结果说明,混合样品并不会对羊源性成分鉴定产生干扰,并且可以检出混合样品中0.1%以上的羊肉成分。
2.3 羊源性成分检测灵敏度实验
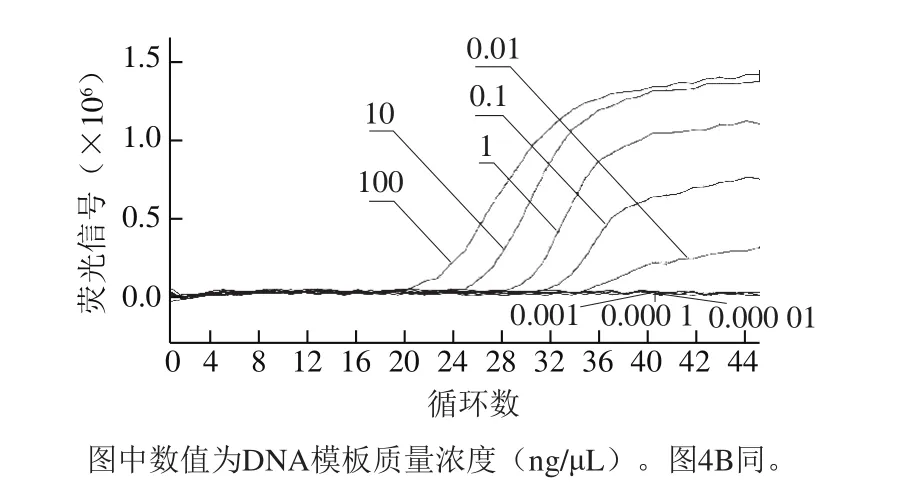
图3 羊肉DNA梯度稀释模板的RT-PCR扩增曲线Fig. 3 RT-PCR amplif i cation curves with diluted ovine DNA as templates

表 4 羊肉DNA梯度稀释模板的RT-PCR扩增结果Table 4 RT-PCR ampli fi cation results with diluted ovine DNA as templates
由图3和表4可知:当羊肉DNA模板质量浓度稀释至0.01 ng/μL(即10 pg羊源DNA/μL)时,RT-PCR出现典型扩增曲线,Ct值为(33.44±0.08),x为DNA质量浓度的对数,y为Ct值。当羊肉DNA模板稀释至0.001 ng/μL时,未出现典型扩增曲线,Ct值为0.00。以上结果说明,羊特异性引物和探针的检测灵敏度达0.01 ng/μL,即RT-PCR反应可以检出10 pg羊源DNA。
2.4 羊源性成分的定量检测
对羊肉来源DNA的8 个梯度稀释模板进行RT-PCR扩增实验。得到羊源性成分定量检测的标准曲线方程为y=-3.939x+48.826(R2=0.990 8),x为DNA质量浓度的对数,y为Ct值。利用标准曲线,通过检测鲜肉中羊源性成分的Ct值计算羊源DNA模板质量浓度。说明检测方法中羊源性成分检测的引物和探针不仅可以对肉制品中的羊源性成分进行定性检测,而且具备定量检测能力。
2.5 加工肉制品中羊源性成分的定量检测
由图4A和表5可知,2 种羊肉干(每种样品3 个平行)出现特异性扩增曲线,Ct值分别为(26.01±0.21)和(24.15±1.26),其余加工肉制品并无扩增曲线,Ct值均为0.00。
利用羊源性成分检测的引物和探针,以羊肉干来源DNA梯度稀释溶液为模板,进行加工肉制品(羊肉干)的TaqMan RT-PCR扩增实验。由图4B可知,当模板DNA质量浓度稀释至0.1 ng/μL时,RT-PCR仍出现典型扩增曲线,Ct值为(34.74±0.21)。以上结果说明,羊特异性引物和探针对于加工肉制品(羊肉干)的检测灵敏度为0.1 ng/μL,即RT-PCR反应可以检出0.1 ng羊肉干来源DNA。

图4 加工肉制品中羊源性成分检测的扩增曲线及灵敏度检测Fig. 4 Amplif i cation curves and sensitivity of detection of sheep-derived ingredients in processed meat products

表 5 11 种加工肉制品中羊源性成分检测的RT-PCR扩增结果Table 5 RT-PCR ampli fi cation results of sheep-derived ingredients in 11 processed meat products
对羊肉干来源DNA的8 个梯度稀释模板进行RT-PCR扩增实验。得到加工肉制品中羊源性成分定量检测的标准曲线方程为y=-4.011x+54.464(R2=0.995 3)。利用标准曲线,通过检测肉制品(羊肉干)中羊源性成分的Ct值(22.84、26.41、29.99)计算出DNA模板的质量浓度为75.9、9.8、1.3 ng/μL,计算结果与原始质量浓度(100、10、1 ng/μL)偏差较小。以上结果说明,此方法具有较高的适用性及特异性,可用于市售加工肉制品中的羊源性成分的定性和定量检测。
3 结 论
根据GB/T 25165—2010合成应用于明胶中羊源性成分定性检测的引物和探针,利用鲜肉和加工肉制品对以此引物和探针为基础的羊源性成分检测方法进行特异性实验。利用混合样品进行羊源性成分的鉴定,结果表明,混合样品并不会对检测结果产生干扰,并且本方法可以检出混合样品中含量为0.1%的羊肉。在特异性的基础上拓展了灵敏度检测,结果表明,此方法可以检出10 pg的羊源DNA。由于此方法使用TaqMan RT-PCR,相比常规PCR表现出特异性更强、检测效率更高的优势。RT-PCR可以利用荧光信号对PCR产物进行实时监控,具有定量模板的能力。鉴于此方法的定量潜力,利用梯度稀释模板得到定量标准曲线方程y=-3.939x+48.826(R2=0.990 8),探讨羊源性成分的定量检测潜力,发现此方法具有羊源性DNA定量检测能力。最后,对加工肉制品(肉干和香肠)进行羊源性成分的定量检测,结果表明,此方法可以对来源于加工肉制品的DNA进行定量检测。
本研究分别对羊肉和羊肉干进行羊源性成分检测的灵敏度实验和DNA定量检测曲线的构建,结果表明,羊肉干的检测灵敏度较低。推测加工肉制品(羊肉干)中的DNA存在降解情况,导致有效DNA模板较少,使得灵敏度相比鲜肉较低。在定量检测曲线的构建中发现,羊肉和羊肉干的DNA定量曲线并不相同。以上结果说明,动物源性成分检测的灵敏度和定量曲线由于样品类型的不同而有较大差异。本研究团队前期将多物种线粒体基因序列比对设计应用于羊源性成分检测的引物和探针,可以检测出1 pg的羊源DNA,并且构建了定量检测标准曲线(R2=0.976)[34]。李亮等[35]研发出的牛源性成分检测技术的灵敏度达10 pg/μL,而付理文等[36]研发的应用于羊源性成分检测的引物和探针可以检出85 pg的羊源DNA。虽然本研究方法检测羊源性成分的灵敏度并没有达到1 pg,但是对于动物源性检测已经足够,更为重要的是此方法具有羊源性DNA的定量检测能力。

