农田土壤氮素转化特征对冻融作用的响应
隽英华 刘艳 宫亮 孙文涛
摘要:为了解非生长季农田土壤氮素转化特征,采用室内冻融模拟培养方法研究冻融频数对3种农田土壤(棕壤、褐土、草甸土)微生物量氮及可溶性氮组分含量的影响。结果表明,随着冻融频数增加,除微生物量氮含量呈现先增加后降低外,3种农田土壤可溶性无机氮、可溶性有机氮和可溶性全氮含量均显著增加,这与净氮矿化速率的变化趋势正好相反。不同类型农田土壤氮素转化过程对冻融频数的响应能力不同,其大小顺序为褐土>棕壤、草甸土。说明高肥力土壤对冻融频数响应的缓冲性较强。可见,冻融频数能够促进农田土壤氮素转化,有利于土壤有效氮的累积,为春季作物生长提供足够的氮素,但同时也增加了土壤氮素流失风险。
关键词:农田土壤;冻融频数;氮素转化;微生物量氮;可溶性氮组分
中图分类号: S153.6+1文献标志码: A
文章编号:1002-1302(2019)21-0282-03
收稿日期:2018-08-16
基金项目:公益性行业(农业)科研专项(编号:201503118-08);国家重点研发计划(编号:2017YFD0300702、2018YFD0300303)。
作者简介:隽英华(1979—),男,山东莒南人,博士,研究员,主要从事作物施肥与土壤氮素转化的生物化学调控研究。Tel:(024)31023018;E-mail:juanyong_001@sohu.com。
通信作者:孙文涛,博士,研究员,主要从事植物营养与高效施肥研究。Tel:(024)31029915;E-mail:wentaosw@163.com。
冻融作用是中高纬度和高海拔地区非生长季常见的自然现象[1],其通过改变土壤水热状况而直接影响土壤的物理性状和微生物活性[2],进而影响土壤氮素转化过程[3],其作用机制包括增加细胞透性[4]、促进微生物群落转化和微生物死亡分解[5]等多种方式。已有研究表明,冻融作用能够提高土壤可溶性无机氮含量,促进土壤氮素转化[6-7]。但也有研究表明,频繁的冻融循环会对微生物群落和活性造成伤害并明显降低土壤氮矿化速率,甚至还通过破坏土壤团聚体结构影响土壤可溶性氮组分含量的变化[8]。因此,了解不同冻融作用下土壤可溶性氮组分及微生物量氮含量的动态变化,对于正确理解冻融作用对土壤氮素转化过程的影响很有意义。
目前,关于冻融作用对土壤氮素转化过程的影响研究多集中在高山森林土壤[9]、湿地土壤[10]、极地苔原、高寒草地[11]等生态系统,而对农田生态系统土壤的影响研究鲜有报道。辽宁省位于全球变化研究中国东北样带内,是气候变化、土壤冻融作用显著和氮素循环研究的重要区域,同时也是重要的国家商品粮生产基地,非生长季的冻融作用显著影响农田土壤氮素转化过程和氮素养分供应能力[12]。因此,通过室内冻融模拟培养试验,研究不同冻融频数对3种典型农田土壤(棕壤、褐土、草甸土)微生物量氮含量、可溶性氮组分及净氮矿化速率的影响行为,以期为区域农田土壤氮素肥力保持和氮素循环研究提供数据支持。
1材料与方法
1.1供试土壤
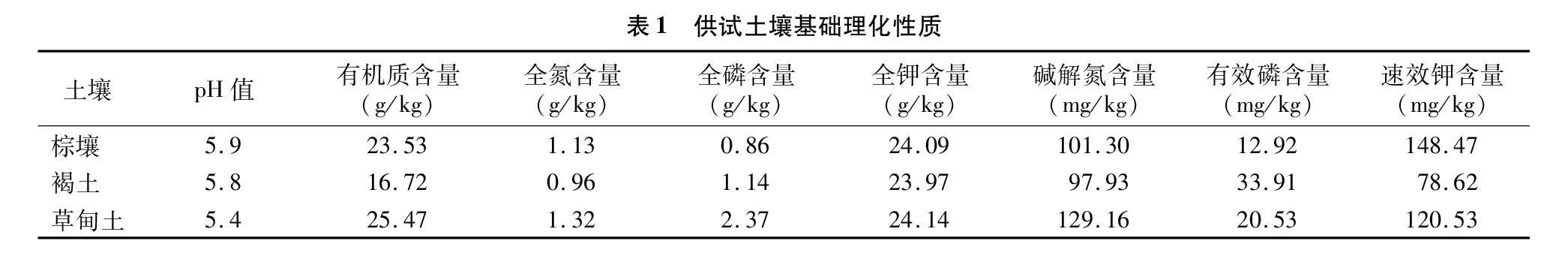
供试土壤为棕壤、褐土、草甸土,分别采自于沈阳农业大学长期试验站(123°57′E、41°82′N)、辽宁省阜新蒙古族自治县旧庙乡(121°37′E、42°23′N)和辽宁省农业科学院试验基地(123°32′E、41°49′N),采样时间为2012年4月。采样时,先除去表层杂物,多点混合法采集0~15 cm表层土壤,将新鲜样品装入塑料袋后迅速带回实验室,挑取肉眼可见的细根和石块等杂物后分成2份,一份过2 mm筛后4 ℃保存备用,另一份风干后测定基础理化性质[13](表1)。
1.2试验设计
取定量过筛后土壤,调节含水量至15%,放入10 ℃(模拟东北初春土壤冻融发生时的平均气温)的恒温培养箱中恒温培养10 d,使其恢复生物学活性。预培养期间每天透气并补充损失的水分。
称取相当于100 g风干土的预培养土壤于100 mL培养瓶中平铺于瓶底,用带孔的保鲜膜封口,冻融循环次数设定为1、5、10次。其中,在-2 ℃冻结6 d、在2 ℃融化1 d设定为1个冻融频数。每个处理设3次重复,并设置未冻融的预培养土壤为对照。培养期间每天补充水分并保持水分含量不变。
1.3测定方法[13]
微生物量氮(microbial biomass nitrogen,MBN)含量采用氯仿熏蒸-K2SO4浸提法测定;可溶性无机氮(dissolved inorganic nitrogen,DIN;铵态氮+硝态氮)采用2 mol/L KCl溶液浸提,连续流动分析仪(AA3,德国布朗卢比公司)测定其含量;可溶性全氮(dissolved total nitrogen,DTN)含量采用过硫酸钾氧化-紫外分光光度法测定;可溶性有机氮(dissolved organic nitrogen,DON)含量=DTN-DIN;净氮矿化速率(net nitrogen mineralization rate,NNMR)=(培養后DIN-培养前DIN)/培养时间。
1.4数据处理
所有数据采用Excel 2007和SPSS 19.0进行统计分析;试验数值采用Duncans法进行多重比较;数值采用平均值的形式表示。
2结果与分析
2.1冻融频数对土壤微生物量氮含量的影响
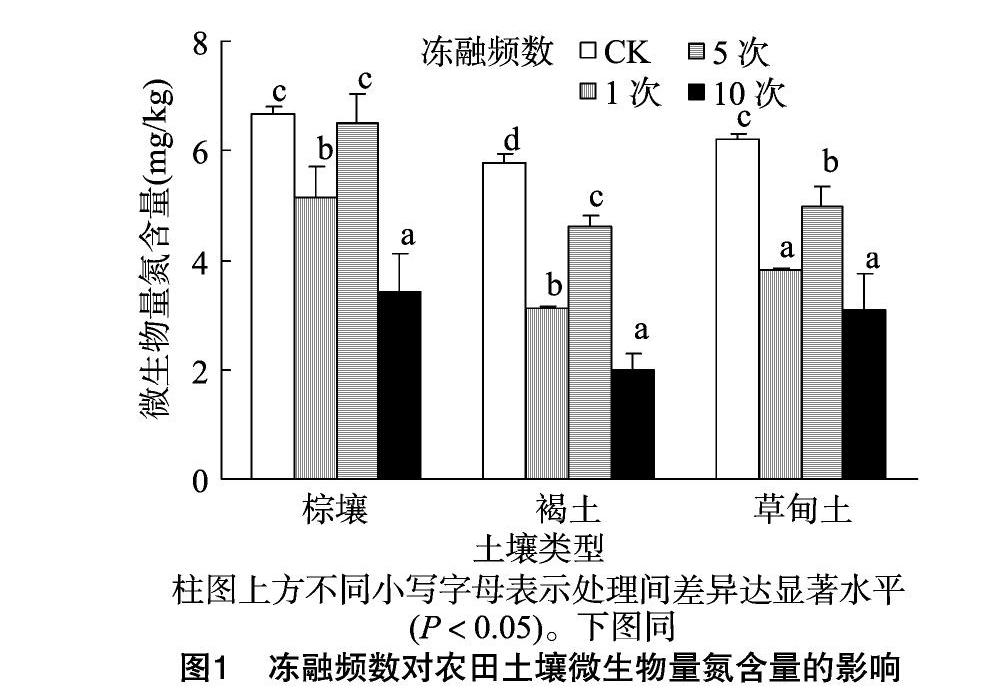
由图1可知,除棕壤冻融5次外,冻融频数对农田土壤MBN含量影响显著(P<0.05)。与未冻融处理相比,除棕壤冻融5次外,3种冻融农田土壤MBN含量均显著降低。随着冻融频数增加,棕壤、褐土和草甸土MBN含量均呈现先增加后降低的变化趋势,以频数5次时达到峰值,其MBN含量分别为6.51、4.60、4.99 mg/kg,较频数1次处理分别增加2665%、46.96%、30.97%。频数10次处理棕壤、褐土和草甸土MBN含量分别为3.43、2.00、3.10 mg/kg,较频数1次处理分别降低33.27%、36.10%、18.64%。说明农田土壤MBN含量受冻融作用影响的缓冲能力因肥力水平而异,其大小顺序为棕壤、草甸土>褐土。
2.2冻融频数对土壤可溶性氮组分的影响
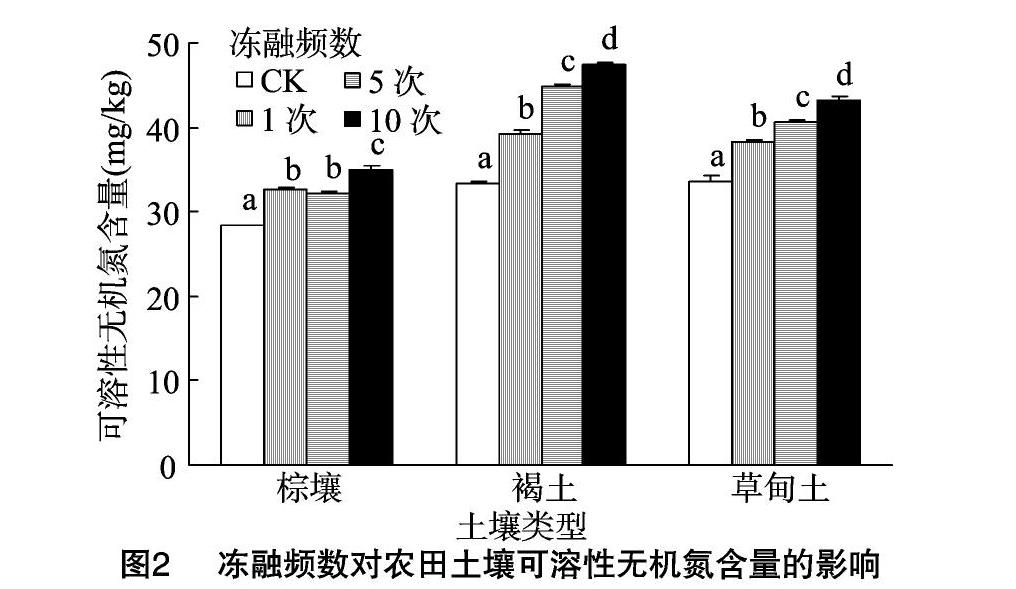
由图2可知,冻融频数对农田土壤DIN含量影响显著(P<0.05),其作用程度因土壤类型而异。与未冻融处理相比,3种冻融农田土壤DIN含量均显著增加。随着冻融频数增加,棕壤、褐土和草甸土DIN含量总体显著增加,以频数10次的含量最高,分别为34.95、47.37、43.21 mg/kg,较未冻融处理分别增加23.41%、42.34%、28.41%。可见,冻融作用能够提高农田土壤DIN含量。
由图3可知,除棕壤冻融1次外,冻融频数对农田土壤
DON含量影响显著(P<0.05),其作用程度因土壤类型而异。与未冻融处理相比,除棕壤冻融1次外,3种冻融农田土壤DON含量均显著增加。随着冻融频数增加,棕壤DON含量先增加后降低,以频数5次时达到最大值,为5.18 mg/kg,较未冻融处理增加131.25%;褐土冻融频数为5次时的DON含量与频数为1次时相比变化不显著,但显著小于频数为10次的处理;草甸土DON含量显著增加,以频数为10次的含量最高(6.61 mg/kg),较未冻融处理增加349.66%。农田土壤DON含量对冻融作用的响应行为受循环次数和土壤类型的多重制约。冻融1、5、10次后,棕壤DON含量的增加幅度分别为23.66%(与未冻融相比)、87.00%(与冻融1次相比)、-5.41%(与冻融5次相比),褐土DON含量的增加幅度分别为132.99%(与未冻融相比)、-2.18%(与冻融1次相比)、54.12%(与冻融5次相比),草甸土DON含量的增加幅度分别为92.52%(与未冻融相比)、83.75%(与冻融1次相比)、27.12%(与冻融5次相比)。
由图4可知,冻融频数对农田土壤DTN含量影响显著(P<0.05),其作用程度因土壤类型而异。与未冻融处理相比,3种冻融农田土壤DTN含量均显著增加。随着冻融频数增加,棕壤、褐土和草甸土DTN含量均显著增加,以频数10次的含量最高,分别为39.95、54.28、49.83 mg/kg,较未冻融处理分别增加30.73%、53.94%、41.88%。由此可见,褐土DTN含量对冻融作用的响应程度最大,其次为草甸土。随着冻融频数增加,棕壤、褐土和草甸土DTN含量的增加幅度逐渐降低,以频数1次的增加幅度最大,分别为17.64%、2411%、17.20%。说明短期冻融更有利于农田土壤DTN的释放。
2.3冻融频数对土壤净氮矿化速率的影响
由图5可知,冻融频数对农田土壤净氮矿化速率影响显著(P<0.05),其作用程度因土壤类型而异,其大小顺序为褐土>棕壤、草甸土。随着冻融频数增加,棕壤、褐土和草甸土净氮矿化速率均显著降低,以频数10次的最小,分别为012、0.20、0.14 mg/(kg·d),较频数1次分别降低8378%、76.19%、79.10%。说明,较棕壤和草甸土相比,褐土氮素转化过程对冻融作用的响应程度更大。
3讨论与结论
冻融作用对土壤微生物量氮含量的影响程度受到冻融频数、冻融强度、土壤含水量、土壤质地、植被覆盖等多因素的综合制约[14],因而在不同地区可能存在较大差异[15-16]。本研究表明,除棕壤冻融5次外,冻融频数对农田土壤微生物量氮含量影响显著(P<0.05),这也佐证了范志平等的研究结论[17];与其不同的是,本研究在经过1次冻融后,土壤微生物量氮含量显著降低,之后随着冻融频数增加又显著升高。这是因为冻融初期环境因子的剧烈变化导致一部分微生物死亡;之后连续冻融使得微生物产生了较快的适应性,同时死亡微生物也为残留微生物提供了足够的营养物质,刺激了存活的微生物活性[18]。冻融作用引起农田土壤微生物量氮的变化行为因土壤类型而异,变化幅度大小顺序为褐土>棕壤、草甸土。说明高肥力农田土壤微生物量氮含量对冻融作用的响应程度较小。这是因为高肥力土壤能够为微生物提供充足的碳源、氮源,促进微生物的生长及发育,使其存留在土壤中的微生物数量明显增加,活性明显增强,大大缓冲了冻融作用对土壤微生物的影响程度。可见,本试验条件下造成微生物量氮含量变化的主要原因是冻融频数和土壤类型,为了进一步探知冻融过程对土壤微生物变化的影响,须要进行长期冻融试验来验证。
冻融作用通过改变土壤水分状况和分布,直接影响土壤理化性质与微生物活动,导致土壤养分含量的变化[19]。在本研究中,冻融作用引起土壤可溶性氮组分含量显著增加,且随着冻融频数增加,各组分含量均显著增加,这与Zhou等的研究结果[14,19-20]一致。这是因为冻融作用过程中土壤结构、孔隙等物理性状的变化,破坏了土壤团聚体和微生物群落结构,有利于土壤包裹吸附着的小分子释放出来,造成土壤可溶性氮组分释放量的增加[21-22]。不同类型土壤可溶性氮组分含量对冻融作用的响应程度不同,以褐土最大,这可能与褐土初始可溶性无机氮含量比较高有关。本试验条件下,冻融作用显著影响了农田土壤净氮矿化速率(P<0.05);随着冻融频数增加,土壤凈氮矿化速率的降低幅度逐渐减小。这可能是由于室内培养试验排除了植物的吸收和降雨的淋溶,造成土壤中氮素矿化量积累,累积的养分能够抑制有机氮的进一步矿化,使得土壤矿化氮量增加缓慢或降低[23]。然而,Hentschel等在森林流域野外试验研究表明,土壤净氮矿化速率受冻融作用影响不显著[24]。可见,冻融作用对土壤净氮矿化速率的影响结果受供试对象和试验方法的影响。
可见,冻融作用通过影响土壤物理性状和微生物活性增加了土壤可溶性无机氮含量[19],由于农田土壤融化期作物对氮素的吸收量较小,造成春季土壤根系吸收与微生物矿化释放养分过程在时间和空间上不同步[25],增加了土壤氮素的淋溶流失风险。
参考文献:
[1]Henry H A L. Soil freeze-thaw cycle experiments:trends,methodological weaknesses and suggested improvements[J]. Soil Biology & Biochemistry,2007,39(5):977-986.
[2]蔡延江,王小丹,丁維新,等. 冻融对土壤氮素转化和N2O排放的影响研究进展[J]. 土壤学报,2013,50(5):1032-1042.
[3]王洋,刘景双,王国平,等. 冻融作用与土壤理化效应的关系研究[J]. 地理与地理信息科学,2007,23(2):91-96.
[4]Doney S C,Schimel D S. Carbon and climate system coupling on timescales from the Precambrian to the anthropocene[J]. Annual Review of Environment and Resources,2007,32:31-66.
[5]Schmidt S K,Lipson D A. Microbial growth under the snow:implications for nutrient and allelochemical availability in temperate soils[J]. Plant and Soil,2004,259:1-7.
[6]Schimel J P,Bilbrough C,Welker J M. Increased snow depth affects microbial activity and nitrogen mineralization in two Arctic tundra communities[J]. Soil Biology and Biochemistry,2004,36(2):217-227.
[7]隽英华,刘艳,田路路,等. 冻融交替对农田棕壤氮素转化过程的调控效应[J]. 土壤,2015,47(4):647-652.
[8]Herrman A M,Witter E. Source of C and N contributing to the flush in mineralization upon freeze thaw cycles in soil[J]. Soil Biology and Biochemistry,2002,34(10):1495-1505.
[9]刘金玲,吴福忠,杨万勤,等. 季节性冻融期间川西亚高山/高山森林土壤净氮矿化特征[J]. 应用生态学报,2012,23(3):610-616.
[10]周旺明,秦胜金,刘景双,等. 沼泽湿地土壤氮矿化对温度变化及冻融的响应[J]. 农业环境科学学报,2011,30(4):806-811.
[11]徐俊俊,吴彦,张新全,等. 冻融交替对高寒草甸土壤微生物量氮和有机氮组分的影响[J]. 应用与环境生物学报,2011,17(1):57-62.
[12]魏燕华,赵鑫,翟云龙,等. 耕作方式对华北农田土壤固碳效应的影响[J]. 农业工程学报,2013,29(17):87-95.
[13]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000.
[14]Zhou W M,Chen H,Zhou L,et al. Effect of freezing-thawing on nitrogen mineralization in vegetation soils of four landscape zones of Changbai Mountain[J]. Annals of Forest Science,2011,68(5):943-951.
[15]Schimel J P,Clein J S. Microbial response to freeze-thaw cycles in tundra and taiga soils[J]. Soil Biology & Biochemistry,1996,28(8):1061-1066.
[16]Walker V K,Palmer G R,Voordouw G. Freeze-thaw tolerance and clues to the winter survival of a soil community[J]. Applied and Environmental Microbiology,2006,72(3):1784-1792.
[17]范志平,李胜男,李法云,等. 冻融交替对河岸缓冲带土壤无机氮和土壤微生物量氮的影响[J]. 气象与环境学报,2013,29(4):106-111.
[18]Haei M,Rousk J,Iistedt U,et al. Effects of soil frost on growth,composition and respiration of the soil microbial decomposer community[J]. Soil Biology and Biochemistry,2011,43(10):2069-2077.
[19]Judd K E,Likens G E,Buso D C,et al. Minimal response in watershed nitrate export to severe soil frost raises questions about nutrient dynamics in the Hubbard Brook experimental forest[J]. Biogeochemistry,2011,106(3):443-459.
[20]田路路,隽英华,刘艳,等. 冻融作用对农田土壤可溶性氮组分的影响[J]. 土壤,2017,49(3):512-518.
[21]郑秀清,樊贵盛,邢述彦. 水分在季节性非饱和冻融土壤中的运动[M]. 北京:地质出版社,2002.
[22]李忠佩,张桃林,陈碧云. 可溶性有机碳的含量动态及其与土壤有机碳矿化的关系[J]. 土壤学报,2004,41(4):544-552.
[23]Amador J A,Grres J H,Savin M C. Role of soil water content in the carbon and nitrogen dynamics of Lumbricus terrestris L. burrow soil[J]. Applied Soil Ecology,2005,28(1):15-22.
[24]Hentschel K,Borken W,Matzner E. Repeated freeze thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil[J]. Journal of Plant Nutrition and Soil Science,2008,171(5):699-706.
[25]Yano Y,Shaver G R,Giblin A E,et al. Nitrogen dynamics in a small arctic watershed:retention and downhill movement of 15N[J]. Ecological Monographs,2010,80(2):331-351.

