不同剂量神经节苷脂治疗糖尿病周围神经病变效果分析
闫博阳
糖尿病周围神经病变(DPN)是糖尿病常见的并发症之一,其发病率较高,也是糖尿病患者致残、致死的重要原因。其发病机制目前尚不清楚,且临床治疗效果不佳。单唾液酸四己糖神经节苷脂钠(GM-1)主要存在于神经系统中,位于细胞膜外层,是神经细胞膜的主要成分,具有非常重要的生物功能,对神经元的分化、生长和轴浆运输起重要作用,可通过维持神经细胞中酶的活性和神经细胞膜的稳定性,维持细胞内外的各种离子平衡,降低细胞水肿和神经细胞损伤[1],预防兴奋性氨基酸在细胞内的积累,降低其毒性,减轻自由基对神经细胞的伤害,促进神经重构,恢复神经功能[2],具有保护神经的作用,可用于DPN的治疗[3],但目前临床上用药剂量不一。本研究分析了不同剂量GM-1对DPN的效果和安全性,探讨GM-1治疗DPN的最佳剂量,以期为DPN的临床合理用药提供参考。
1 资料与方法
1.1 病例资料 选取2015年3月~2018年3月医院收治的DPN患者81例,按照入院先后顺序编号,采用随机数字法分为3组,A组为低剂量共28例,男 15 例,女 13 例;年龄 40~72(52.31±7.15)岁;病程 1~8(4.32±1.02)年;周围神经病变部位(部分患者有多个病变部位):手指12例,小鱼际13例,内踝8例,大脚趾15例。B组为中剂量组共27例,男16 例,女 11 例;年龄 42~73(53.85±7.13)岁;病程 2~9(4.98±1.57)年;病变部位:手指 11 例,小鱼际 10例,内踝9例,大脚趾13例。C组为高剂量组共26例,男 15 例,女 11 例;年龄 45~70(51.65±7.56)岁;病程 2~8(4.58±1.47)年;病变部位:手指 13 例,小鱼际12例,内踝10例,大脚趾14例。3组一般资料比较无统计学差异(P>0.05)。所有患者均签署知情同意书,本研究获得医院医学伦理委员会批准。
1.2 治疗方法 所有患者在控制血糖水平达标(空腹血糖<7.0 mmol/L,餐后 2 h 血糖<9.0 mmol/L)的同时,A组、B组和C组分别给予不同剂量的GM-1(齐鲁制药有限公司,国药准字H20046213)治疗。A 组:20 mg/次;B 组:40 mg/次;C 组:60 mg/次,均为加入生理盐水中静滴,1次/d,持续治疗1 w。1 w后,A组剂量维持不变,B、C组剂量变更为20 mg/次。均改为肌肉注射给药,1次/d,再持续治疗1 w。之后服用依帕司他片,50 mg/次,3次/d,持续治疗2 w。
1.3 观察指标 在治疗前1 d和治疗结束后1 d,检测下列指标:(1)感觉阈值:采用TSA-Ⅱ型定量感觉测定分析仪(美国Medoc公司),测定患者手背、足背的冷感觉阈值、热感觉阈值,测定方法:3 cm×3 cm电极置于测试区域皮肤,轻压电极使其与皮肤完全贴合,测量的基础温度为32~34℃,变化范围0~50℃。当患者感受到冷、热给出信号时,温度停止上升或下降,此时的温度值即为冷、热感觉阈值。(2)NO水平:采集患者空腹静脉血3 ml,采用硝酸盐还原酶法测定NO水平,试剂盒由渤海生物有限公司提供。(3)症状程度:采用密歇根糖尿病神经病变量表(MDNS)对患者症状程度进行评分,包括肢体末端感觉、趾指运动和四肢腱反射。MDNS总分为0~10分,>6分为异常,分值高表明病变越严重。记录患者治疗期间的不良反应发生情况。
1.4 统计学方法 应用SPSS 20.0统计软件分析,计量资料以±s表示,组间比较采用方差分析和两两t检验;计数资料以例和百分率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组治疗前后感觉阈值比较 治疗后,A组感觉阈值变化不显著(P>0.05),但B、C组冷感觉阈值显著升高,热感觉阈值显著降低(P<0.05),均与A组有显著差异(P<0.05),见表1。
2.2 3组治疗前后NO水平及MDNS评分比较治疗后,3组NO水平均升高,MDNS评分显著降低,且B、C组变化幅度均大于A组(P<0.05),见表2。
2.3 3组不良反应比较 A组发生口唇发绀2例,皮疹1例;B组发生口唇发绀3例,皮疹2例;C组发生口唇发绀5例,皮疹5例,呕吐2例;不良反应发生率分别为10.71%、18.52%和46.15%,C组显著高于A组和B组(P<0.05)。
3 讨论
DPN对感觉神经产生影响,严重时可导致感觉减弱、感染等的发生,甚至截肢[4]。目前临床对于该病没有特效药,常采用依帕司他和GM-1治疗,但对于GM-1的使用剂量不同。有研究采用GM-1 40 mg静滴,1 w后更改为20 mg肌肉注射1 w,取得了较好的临床效果[5]。也有文献报道,采用60 mg静滴,1 w后更改为20 mg肌肉注射1 w,可显著改善患者的神经传导速度,临床效果显著[6]。
本研究中,低剂量组治疗前后的感觉阈值没有明显变化,而中剂量和高剂量组的冷觉阈值明显升高,热感觉阈值明显降低,提示中高剂量组的感觉障碍得到明显改善。可能是由于中高剂量GM-1能够更好地促进神经细胞的生长、分化,促进神经系统的生长发育和损伤后修复,具有更好的神经保护作用[7]。另外,中高剂量GM-1还可通过影响磷脂酶、腺苷酸化酶等的活性而影响信号传导,激活细胞相关酶,平衡轴突膜内外离子,具有更明显修复神经传导作用,促进神经电生理活动恢复,从而显著改善患者的运动神经和感觉神经传导速度[8],进一步改善患者的感觉障碍。而低剂量GM-1可能由于剂量不足,而没有达到治疗效果。
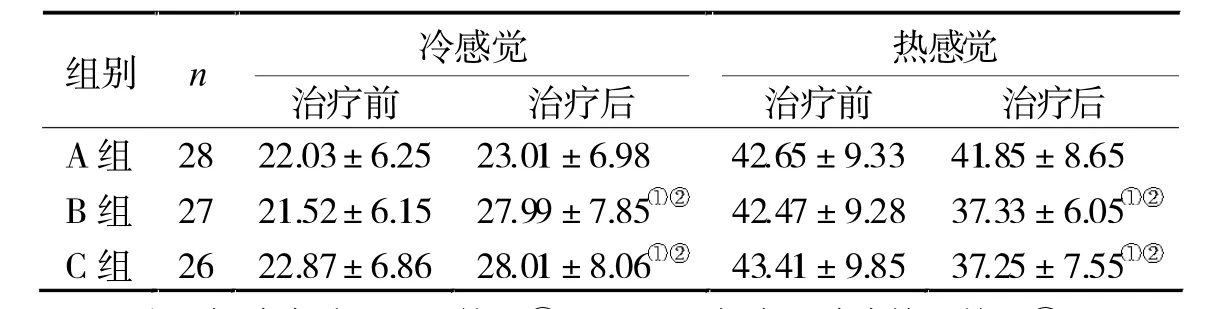
表1 3组治疗前后感觉阈值比较(℃)
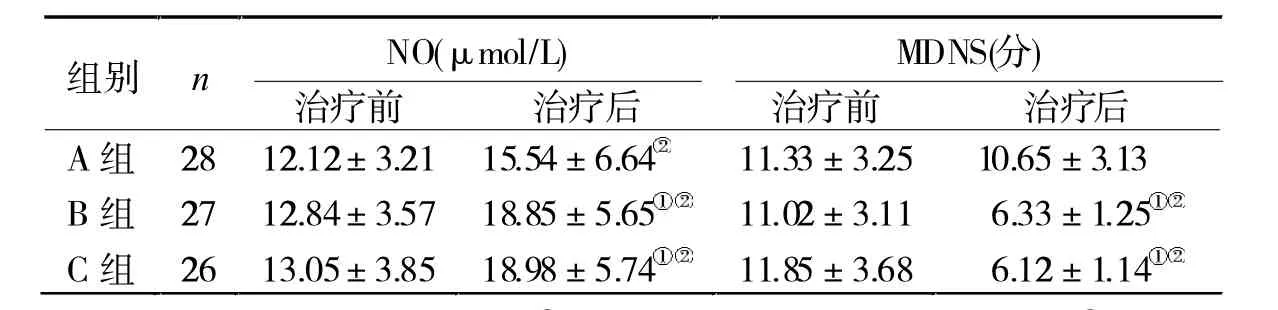
表2 3组治疗前后NO水平及MDNS评分比较
糖尿病患者血糖长期处于高水平状态,导致血管内皮受损,NO生成降低,导致自由基损害神经传导,而自由基生成过多,进一步导致血管内NO水平下降,使得血管舒张障碍,长期作用导致神经纤维变性、失活,减慢神经传导速度[9]。本研究发现,3组治疗后NO水平均显著高于治疗前,但中剂量和高剂量组显著高于低剂量组,提示中高剂量GM-1提高NO水平的效果优于低剂量。可能是由于中高剂量GM-1可更好地促进神经细胞的修复,显著降低内皮细胞损伤,从而提高NO水平[10]。此外,治疗后,中高剂量组的MDNS评分显著优于低剂量组,说明中高剂量可更显著改善患者的临床症状,这可能与其可显著改善患者的感觉阈值和促进神经功能恢复有关。但高剂量的不良反应较高,而中剂量的不良反应较低,表明其治疗安全性更高。
综上所述,40 mg GM-1可显著改善DPN患者的感觉阈值和和临床症状,降低血清NO含量,不良反应少,具有较好的临床效果和安全性。

