不同菌种发酵对巴戟天活性成分含量的影响
谭丽容,代文豪,罗志锋,李文治,黎 攀,林微微,程 敏*,杜 冰
(1.无限极(中国)有限公司,广东 广州 510623;2.华南农业大学 食品学院,广东 广州 510642)
巴戟天(Morinda officinalisHow.)来源于茜草科巴戟属植物巴戟天的干燥根,主要成分包括多糖及寡糖、蒽醌、水晶兰苷、有机酸等化合物及无机元素,是我国著名的四大南药之一[1],具有补肾壮阳、提高细胞免疫功能等功效[2-3]。炮制作为巴戟天入药前必须经过的工序,主要有盐制巴戟天、发酵法炮制、蒸制巴戟天、甘草水制巴戟天(制巴戟天)、煮制巴戟天,目前巴戟天的炮制研究主要集中在盐制及甘草水制方面。对于各类炮制品的质量和工艺,目前行业尚未定制统一标准,这阻碍了炮制品的研发和生产等[4-5]。
发酵法炮制中草药是中药炮制方法之一,是中草药通过微生物发酵,借助于酶和微生物的作用改变中草药原有的性质药效等,进而增强原有功效或产生新的功效,扩大中草药原有的用药品种,以适应临床用药的需要[6]。目前,国内外有关巴戟天发酵法炮制鲜有文献报道,只有一篇论文报道了巴戟天发酵炮制的研究,其利用酵母菌发酵巴戟天提高了巴戟天多糖的含量[7]。因此,本研究在筛选适合巴戟天发酵炮制菌种的基础上,研究发酵炮制过程中活性成分的变化,旨在为发酵法炮制巴戟天的研究开拓新的领域。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
工厂巴戟天(抽芯干燥巴戟天(MorindaofficinalisHow.):广东省云浮市郁南县大方镇巴戟天市场。
1.1.2 菌种
芽孢杆菌属(Bacillussp.)DU-106、鼠李糖乳杆菌(Lactobacillusrhamnosus)、植物乳杆菌(Lactobacillusplantarum):华南农业大学新资源食品与功能性原料研究及评价中心保藏,并委托广州市微生物所制成1×1012CFU/g菌粉,作为实验室备用;酿酒酵母菌(Saccharomyces cerevisiae)RV171:安琪酵母公司。
1.1.3 试剂
氯仿、甲醇、乙醇(均为分析纯):国药集团化学试剂有限公司;甲基异茜草素、甲基异茜草素-1-甲醚、寡糖、水晶兰苷标准品(纯度均>98%):由本研究室分离纯化得到。
1.1.4 培养基
发酵培养基:10 g葡萄糖,10 g NaCl,1 000 mL蒸馏水,115℃高压灭菌20 min。
1.2 仪器与设备
DHG-9070A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;DHP-600电热恒温培养箱:北京市永光明医疗仪器厂;YSC-2数控超声波清洗器:昆山禾创超声仪器有限公司;VD-650桌上式洁净式工作台:苏州净化设备有限公司;Ultimate3000高效液相色谱(high performance liquid chromatograph,HPLC)仪:美国赛默飞世尔科技公司。
1.3 方法
1.3.1 盐制巴戟天
将工厂巴戟天用清水洗净,去除泥土,沥干待用。每50 g工厂巴戟天中加入50 mL、2%的NaCl中煮沸60 min,捞出沥干,于60℃条件下热风干燥24 h,得盐制巴戟天。
1.3.2 发酵巴戟天
活化液:分别将0.10 g产乳酸芽孢杆菌DU-106、0.10 g鼠李糖乳杆菌、0.10g植物乳杆菌、0.10g酿酒酵母菌RV171溶于50 mL的2%葡萄糖水中,37℃、160 r/min条件下振荡混匀活化30 min即为活化液。
发酵:将沥干待用的巴戟天用清水于100℃煮制20min,在超净工作台上将150 g煮制后的巴戟天置于350 mL发酵培养基,分别取1 mL活化液接种于培养基中,摇匀。30℃条件下发酵12 d。取出沥干,60℃条件下烘干24 h,烘干的样品粉碎后过2号筛,于4℃保存,得芽孢杆菌DU-106发酵巴戟天、鼠李糖乳杆菌发酵巴戟天、植物乳杆菌发酵巴戟天、酿酒酵母发酵巴戟天。
1.3.3 活性成分的检测
水分含量测定:采用水分含量测定仪测定水分含量,每个样品重复3次[8]。
水溶性浸出物测定:精确称定样品4 g,按照2010年版《中国药典》中冷浸法对可溶性浸出物进行测定[9]。
多糖含量测定:精密称量巴戟天粉末0.200 g于圆底烧瓶中,加入150 mL体积分数为80%的乙醇,80℃条件下水浴加热2 h,过滤;滤渣加入150 mL体积分数为80%的乙醇,80℃条件下水浴加热2 h,过滤;滤渣加入150 mL水,100℃水浴加热2h,过滤,取滤液浓缩,冷却,定容至100mL。采用苯酚-硫酸法测定多糖含量[10-11]。
游离蒽醌含量测定:精密称量巴戟天粉末1.0 g置圆底烧瓶中,加入50 mL氯仿,85℃条件下水浴回流1 h后补加20 mL氯仿,继续回流1 h,过滤,将滤液中的氯仿挥干,加入0.5%醋酸镁-甲醇溶液溶解,采用0.5%醋酸镁-甲醇法测定游离蒽醌的含量[12]。
甲基异茜草素-1-甲醚、甲基异茜草素含量测定:精密称量巴戟天粉末2.000g,加氯仿100mL,85℃回流提取2次,每次2 h,滤液合并,回收氯仿,残渣加甲醇定容至5 mL容量瓶中,摇匀,以0.22μm微孔滤膜过滤,取滤液,采用HPLC外标法测定滤液中甲基异茜草素-1-甲醚、甲基异茜草素含量[13]。HPLC条件为色谱柱:DiamonsilTMC18(4.6mm×250mm,5 μm);流动相:乙腈(A)-0.2%磷酸水溶液(B);梯度洗脱(0~5 min,20%A;5~10 min,20~44%A;10~40 min,44%A;40~50 min,44~95%A;50~55 min,95%A);流速:1.0mL/min;进样量:20μL;检测波长:277nm;柱温:30℃。
寡糖含量测定:精密称量巴戟天粉末0.5 g于圆底烧瓶中,精密加入体积分数60%的乙醇50 mL,85℃回流15 min,转移到具塞锥形瓶中,超声处理(功率200 W,频率40 kHz)20min,冷却、称质量,用体积分数60%的乙醇补足至50mL,于4 000 r/min条件下离心10 min,上清液用0.22 μm微孔滤膜过滤,取滤液。采用HPLC外标法测定巴戟天寡糖(D-果糖、D(+)-无水葡萄糖、蔗糖、1-蔗果三糖、耐斯糖、1F-果呋喃糖基耐斯糖)含量[14]。HPLC色谱条件为色谱柱:ZORBAX NH2柱(2500 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:乙腈(A)-超纯水(B);梯度洗脱(0~5 min,70%A~85%A;5~15min,85%A~70%A;15~45min,70%A;后运行5min);流速:1.2 mL/min;进样量:20 μL;检测器:蒸发光散射检测器(evaporative light scattering detector,ELCD)。
水晶兰苷含量测定:精密称量巴戟天粉末1.000 g于具塞三角瓶中,加入体积分数80%的甲醇100 mL,15℃条件下冷浸1 h,超声处理(220 W,55 kHz)1 h,过滤,残渣加入体积分数80%的甲醇50 mL,再超声处理30 min,合并提取液,挥干,残渣加甲醇溶解,并转移至25 mL容量瓶中,经0.22 μm微孔滤膜过滤,取滤液采用HPLC外标法测定水晶兰苷含量[15]。HPLC色谱条件为色谱柱:Kromalsil C18柱(150 mm×4.6 mm,5 μm);流动相:甲醇-0.4%磷酸水溶液(90∶10,V∶V);流速:1.0 mL/min;检测波长:233 nm;检测时间:15 min;进样量:5 μL。柱温:30 ℃。
1.3.4 数据处理与分析
数据采用Office Excel 2016及DPS 7.05软件进行处理;作图采用Office Excel 2016及GraphPad Prism 7。
2 结果与分析
2.1 巴戟天水分含量
不同炮制方法对巴戟天水分含量的影响结果见图1。
由图1可知,工厂巴戟天水分含量最低(15.21%);不同菌种发酵的4种巴戟天水分含量都在19%~21%;盐制巴戟天的水含量较高(26.38%)。盐制巴戟天的水分含量显著高于发酵炮制和工厂炮制的巴戟天(P<0.05),分析原因可能由于盐煮炮制使得盐制巴戟天含盐量较高,贮存时易吸水,导致含水量较高。
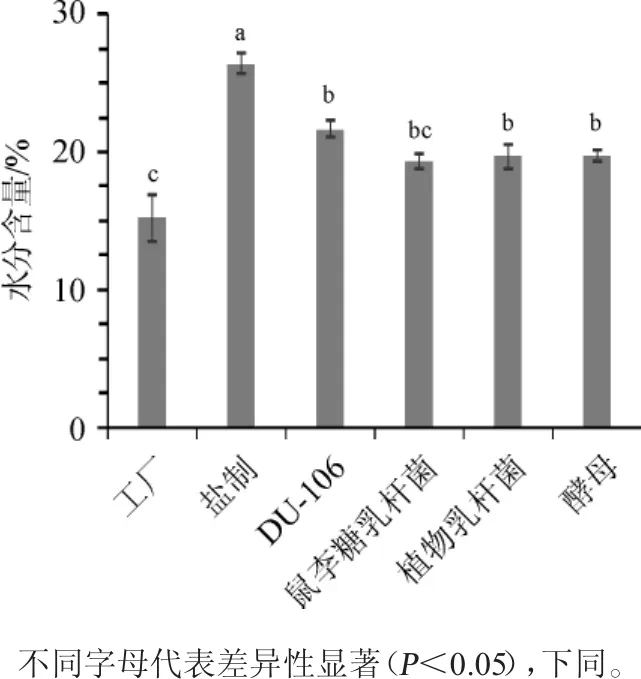
图1 不同炮制方法对巴戟天水分含量的影响Fig.1 Effect of different processing methods on moisture in Morinda officinalisHow.
2.2 巴戟天水溶性浸出物含量
不同炮制方法对巴戟天水溶性浸出物含量的影响结果见图2。

图2 不同炮制方法对巴戟天水溶性浸出物含量的影响Fig.2 Effect of different processing methods on water soluble extracts content inMorinda officinalisHow.
由图2可知,工厂巴戟天和盐制巴戟天的水溶性浸出物含量都较高,均达到了干质量的86%以上,且无显著性差异(P>0.05);而芽孢杆菌DU-106及乳酸菌发酵后的巴戟天水溶性浸出物含量在55%~62%,且无显著性差异(P>0.05);酵母菌发酵后的巴戟天水溶性浸出物含量最低,为34.67%。说明发酵会显著降低巴戟天中的水溶性物质(P<0.05),且酵母消耗最多,而盐煮炮制巴戟天中可能盐含量较高,导致水溶性浸出物含量较高。
2.3 巴戟天多糖含量
不同炮制方法对巴戟天多糖含量的影响结果见图3。
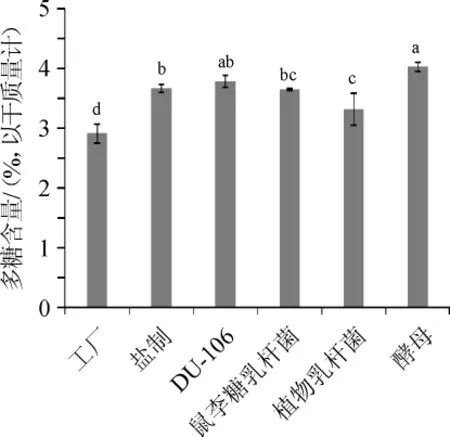
图3 不同炮制方法对巴戟天多糖含量的影响Fig.3 Effect different processing methods on polysaccharide content inMorinda officinalisHow.
由图3可知,酵母发酵巴戟天多糖含量最多,为4.03%,较工厂巴戟天(2.91%)提高了38.38%;其次是芽孢杆菌DU-106发酵巴戟天,多糖含量为3.79%,较工厂巴戟天提高了30.09%;盐制巴戟天和鼠李糖乳杆菌发酵后的巴戟天多糖含量无显著性差异(P>0.05),较工厂巴戟天分别提高26.00%和25.39%;植物乳杆菌发酵后的巴戟天多糖含量为3.32%,也能显著提高巴戟天多糖含量(P<0.05),较工厂巴戟天提高了14.10%。由此得出,发酵炮制和传统盐制相较于工厂巴戟天都能显著性的提高巴戟天多糖含量(P<0.05),说明无论是传统炮制还是发酵炮制,都能显著提高巴戟天多糖含量(P<0.05)。
2.4 巴戟天游离蒽醌含量
不同炮制方法对巴戟天游离蒽醌含量的影响结果见图4。

图4 不同炮制方法对巴戟天游离蒽醌含量的影响Fig.4 Effect of different processing methods on free anthraquinone content inMorinda officinalisHow.
由图4可知,相比于未处理的工厂巴戟天(0.024mg/g),除鼠李糖乳杆菌发酵后的巴戟天外,其他炮制方法都显著提高了巴戟天中游离蒽醌的含量(P<0.05)。芽孢杆菌DU-106发酵后的巴戟天中游离蒽醌含量最高(0.057 mg/g);其次是酵母菌发酵后的巴戟天(0.052mg/g),相比于工厂巴戟天分别提高了139.83%、118.71%,且显著高于传统盐制的巴戟天(P<0.05);植物乳杆菌发酵后的巴戟天游离蒽醌含量为0.047 mg/g,与盐制巴戟天无显著性差异(P>0.05),相比于工厂巴戟天提高了96.37%。
2.5 巴戟天甲基异茜草素-1-甲醚和甲基异茜草素含量
甲基异茜草素-1-甲醚和甲基异茜草素为巴戟天中主要蒽醌类物质,不同炮制方法对巴戟天甲基异茜草素-1-甲醚和甲基异茜草素含量的影响结果见图5。
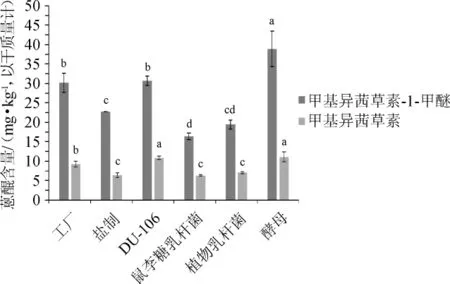
图5 不同炮制方法对巴戟天甲基异茜草素-1-甲醚和甲基异茜草素含量的影响Fig.5 Effect of different processing methods on rubiadin-1-methylether and rubiadin content inMorinda officinalisHow.
由图5可知,工厂巴戟天中甲基异茜草素-1-甲醚和甲基异茜草素的含量分别为30.2 mg/kg、9.2 mg/kg;酵母菌发酵后的巴戟天中的甲基异茜草素-1-甲醚和甲基异茜草素含量都最高,分别为38.9 mg/kg和11.1 mg/kg,与游离蒽醌含量(0.057 mg/g)基本符合,较工厂巴戟天均显著提高(P<0.05);其次是芽孢杆菌DU-106发酵后的巴戟天,甲基异茜草素-1-甲醚的含量为30.7 mg/kg,甲基异茜草素含量为10.9 mg/kg,比游离蒽醌含量(0.057 mg/g)低,分析原因可能是发酵后,部分甲基异茜草素-1-甲醚或甲基异茜草素转化成了其他蒽醌类物质;盐制巴戟天、植物乳杆菌和鼠李糖乳杆菌发酵后的巴戟天中甲基异茜草素-1-甲醚含量分别为22.7mg/kg、19.5mg/kg、16.4mg/kg,甲基异茜草素含量分别为6.4 mg/kg、7.1 mg/kg、6.3 mg/kg,均显著低于工厂巴戟天(P<0.05)。
2.6 巴戟天水晶兰苷含量
不同炮制方法对巴戟天水晶兰苷含量的影响结果见图6。
由图6可以看出,盐制巴戟天中的水晶兰苷含量最高(23.0 mg/g);其次是芽孢杆菌DU-106发酵后的巴戟天(19.9 mg/g);酵母菌发酵后的巴戟天的水晶兰苷含量为14.3 mg/g;鼠李糖乳杆菌发酵巴戟天和植物乳杆菌发酵巴戟天的水晶兰苷含量无显著性差异(P>0.05),分别达到了10.17 mg/g和8.86 mg/g。相比于工厂巴戟天(5.38 mg/g),4个菌种(芽孢杆菌DU-106、酵母菌、鼠李糖乳杆菌和植物乳杆菌)发酵后的巴戟天中水晶兰苷分别提高了269.76%、166.59%、89.01%和64.70%。相比于传统盐制巴戟天,4个菌种发酵后的巴戟天都没有达到盐制巴戟天的水晶兰苷含量。
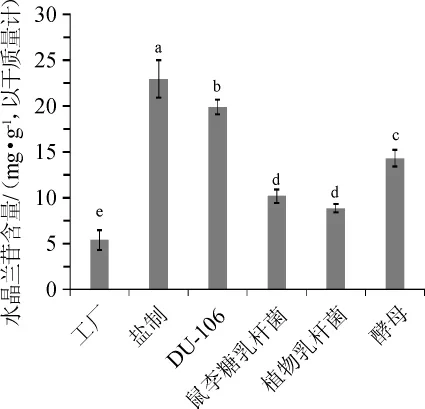
图6 不同炮制方法对巴戟天中水晶兰苷含量的影响Fig.6 Effect of different processing methods on monotropein content inMorinda officinalisHow.
2.7 巴戟天寡糖含量
不同炮制方法对巴戟天寡糖(D-果糖、D(+)-无水葡萄糖、蔗糖、1-蔗果三糖、耐斯糖、1F-果呋喃糖基耐斯糖)含量的影响结果见图7。

图7 不同炮制方法对巴戟天中寡糖含量的影响Fig.7 Effect of different processing methods on oligosaccharide content inMorinda officinalisHow.
由图7可知,盐制、芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌发酵巴戟天均能显著提高巴戟天中果糖含量(P<0.05),果糖含量分别为374.92 mg/g、61.04 mg/g、61.03 mg/g、57.30 mg/g,而酵母菌发酵后的巴戟天未测出果糖,分析原因可能是酵母菌消耗了巴戟天中的果糖;相比于盐制巴戟天,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌发酵后的巴戟天中的果糖含量都显著低于传统盐制巴戟天(P<0.05)。以果糖为指标,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌较为适合发酵炮制巴戟天。
工厂、盐制、酵母菌发酵后的巴戟天中均未测出葡萄糖,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌发酵后的巴戟天中葡萄糖含量分别为17.79 mg/g、11.90 mg/g和11.82 mg/g。原因可能是芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌发酵炮制巴戟天转化生成了葡萄糖,而酵母菌消耗了葡萄糖,故未测出。以葡萄糖为指标,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌较为适合发酵炮制巴戟天。
相较于工厂巴戟天(36.16 mg/g),其中3个菌种芽孢杆菌DU-106(12.68 mg/g)、鼠李糖乳杆菌(28.15 mg/g)、植物乳杆菌(29.02 mg/g)、发酵巴戟天均不同程度消耗了巴戟天中的蔗糖(64.92%、22.14%、19.74%),而盐制巴戟天(102.94 mg/g)提高了蔗糖含量(184.69%),其中植物乳杆菌、鼠李糖乳杆菌消耗较少,而芽孢杆菌DU-106消耗较多,酵母菌全部消耗,说明酵母菌不太适合发酵炮制巴戟天。
4个菌种发酵炮制巴戟天都消耗了1-蔗果三糖,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌发酵后的巴戟天中1-蔗果三糖含量分别为9.89 mg/g、16.24 mg/g、13.33 mg/g,而酵母菌发酵巴戟天中未测出蔗果三糖。相比于工厂巴戟天,DU-106、鼠李糖乳杆菌、植物乳杆菌发酵分别消耗了巴戟天63.12%、39.49%、50.32%的1-蔗果三糖,而酵母菌全部消耗了巴戟天中的蔗果三糖。相比于传统盐制巴戟天[16],4个菌种发酵炮制巴戟天都不能达到盐制提高蔗果三糖含量的效果。
耐斯糖为《中国药典》中规定巴戟天质量的特征指标。经炮制后的巴戟天中耐斯糖含量都有所下降。《中国药典》中规定耐斯糖含量标准是2%,其中酵母菌发酵的巴戟天中耐斯糖含量不达标。相比于工厂巴戟天,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌、酵母菌发酵均显著降低了巴戟天中的耐斯糖含量(P<0.05),分别消耗了巴戟天55.30%、43.22%、43.40%和91.77%的耐斯糖。相比于盐制巴戟天,4个菌种发酵都不能达到传统盐制消耗巴戟天耐斯糖较少的效果。由此得出,无论是传统炮制方法还是发酵炮制方法,巴戟天中的耐斯糖都被不同程度的消耗。
相比于工厂巴戟天,经炮制后的巴戟天中1F-果呋喃糖基耐斯糖含量都有显著性下降(P<0.05)。其中芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌、酵母菌发酵分别消耗了巴戟天58.83%、52.52%、58.26%、93.36%的1F-果呋喃糖基耐斯糖。相比于盐制巴戟天,4个菌株中除酵母菌株外,其他3个菌株发酵后的巴戟天中的1F-果呋喃糖基耐斯糖含量都达到了或高于传统盐制巴戟天的水平,无显著性差异(P>0.05)。由此得出,无论是传统炮制方法还是发酵炮制方法,都会不同程度的消耗巴戟天中的1F-果呋喃糖基耐斯糖,其中芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌较为合适发酵巴戟天。
通过对巴戟天中6种寡糖的测定,与工厂巴戟天和传统盐制巴戟天相比,4个菌种中,芽孢杆菌DU-106、鼠李糖乳杆菌、植物乳杆菌较为适合作为发酵巴戟天的菌种,而酵母菌不适合发酵巴戟天。
3 结论
通过比较不同炮制法巴戟天中的各活性成分发现,以工厂巴戟天为对照,传统腌制法优于发酵法炮制巴戟天;芽孢杆菌DU-106、鼠李糖乳杆菌及植物乳杆菌发酵法炮制巴戟天均显著提高了工厂巴戟天中的水分含量、多糖含量、游离蒽醌总量、水晶兰苷、果糖、葡萄糖含量(P<0.05),而不同程度的消耗了工厂巴戟天中的水溶性浸出物、蔗糖、1-蔗果三糖、耐斯糖、1F-果呋喃糖基耐斯糖,其中酵母菌几乎全部消耗了巴戟天中的寡糖,芽孢杆菌DU-106优于鼠李糖乳杆菌及植物乳杆菌,更适合发酵炮制巴戟天。

