转木糖还原酶基因XYL1酿酒酵母的构建及产木糖醇能力研究
王凤梅,张邦建,岳泰新,马利兵*
(1.包头轻工职业技术学院 食品药品学院,内蒙古 包头 014035;2.内蒙古科技大学 生命科学与技术学院,内蒙古 包头 014010)
木糖醇为五碳糖醇,是一种白色结晶类物质,可由木糖经氢化作用形成。其甜度与蔗糖相近,却具有较低的热值[1]。更为重要的是体内木糖醇的利用无需胰岛素,因此,可作为糖尿病人饮食中的一种増甜剂。此外,其抗龋齿、牙菌斑及口腔生物膜形成的功能也被许多研究所证实[2-3]。
细菌、藻类及酵母均可被用于生产木糖醇。在发酵制备木糖醇方面,与细菌细胞相比,酵母细胞是更为理想的微生物,尤其是酿酒酵母(Saccharomyces cerevisiae),因其广泛被用于葡萄酒酿制中,因此,在食品工业中被认为是总体安全(generallyrecognizedassafe,GRAS)的菌种。在酵母菌种中,多形汉逊酵母(Hansenula polymorpha)、菅囊酵母(Pachysolen tannophilus)、树干毕赤酵母(Pichia stipitis)、假丝酵母属的多个菌种(休哈塔假丝酵母(Candidashehatae)、博伊丁假丝酵母(Candida boidinii)、季也蒙假丝酵母(Candida guilliermondii)及热带假丝酵母(Candida tropicalis))具有发酵D-木糖制备木糖醇的能力[4-9]。这些酵母菌种之所以能够以D-木糖为碳源制备木糖醇,其原因在于这些酵母菌种可编码木糖还原酶(xylose reductase,xyl),该酶可以以烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)为辅因子,将D-木糖还原为木糖醇[4-9]。然而,酿酒酵母中的xyl活性较低,因此,无法以木糖为碳源高效合成木糖醇。木糖还原酶基因XYL1的导入将赋予酿酒酵母发酵木糖的能力,同时,酿酒酵母自身的高乙醇耐受力又会赋予转基因菌株高的发酵能力,此外,酿酒酵母GRAS认证又使发酵终产物木糖醇可被安全应用于食品工业中。
表达载体pYES2携带一个酿酒酵母来源的GAL1启动子,该启动子在半乳糖存在的条件下启动外源基因的高效表达,而在葡萄糖存在的情况下,该启动子受到抑制,外源基因无法表达[10]。此外,该载体携带一个URA3基因,在导入URA3基因缺陷型的酿酒酵母菌株(如INVSc1菌株)后,可采用营养缺陷型培养基筛选转基因酿酒酵母。因此,本研究将人工合成的来源于树干毕赤酵母(Pichia stipitis)的XYL1基因插入酿酒酵母表达载体pYES2中。然后,重组质粒pYES2-XYL1导入感受态酿酒酵母INVSc1中,构建转XYL1基因酿酒酵母菌株INVSc1/pYES2-XYL1,采用营养缺陷培养基对转基因酿酒酵母菌株进行筛选和培养,对转基因菌株发酵制备木糖醇的能力进行检测。为采用基因工程酿酒酵母制备食用木糖醇提供了理论及技术基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酿酒酵母(Saccharomyces cerevisiae)INVSc1、酿酒酵母表达载体pYES2:美国英杰Invitrogen公司;大肠杆菌(Escherichia coli)DH5α:本实验室冻存菌种。

图1 人工合成的XYL1基因Fig.1 Artificially synthesizedXYL1gene
人工合成的XYL1片段经HindIII及BamHI双酶切后插入pUC57克隆载体的多克隆位点处。重组的pUC57-XYL1克隆载体导入E.coliDH5α感受态细胞中,得到E.coliDH5α/pUC57-XYL1。
1.1.2 培养基
LB固体培养基:1%胰蛋白胨、0.5%酵母提取物、1%NaCl、1.5%琼脂粉。121℃高压灭菌20 min。液体LB培养基中不添加琼脂粉。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:1%酵母膏、2%蛋白胨、2%葡萄糖、2%琼脂粉,pH 5.0。121℃高压灭菌20 min。液体YPD培养基中不添加琼脂粉。
酵母尿嘧啶缺陷型合成琼脂培养基(yeast synthetic drop-out agar medium without uracil,SC-URA):6.8 g/L氮 源基础、20 g/L葡萄糖、1.92 g/L不含尿嘧啶的酵母人工合成培养基添加物、20 g/L琼脂粉。121℃高压灭菌15 min。液体筛选培养基中不添加琼脂粉。
1.1.3 试剂
2.3.3 重复性试验 精密称取药材样品(编号:S19)适量,共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下试验条件进样测定,以丹皮酚峰的保留时间和峰面积为参照,记录各共有峰的相对保留时间和相对峰面积。结果,29个共有峰相对保留时间的RSD为0~0.62%(n=6),相对峰面积的RSD为1.47%~4.97%(n=6),表明本方法重复性良好。
质粒小提试剂盒、T4脱氧核糖核酸(deoxyribonucleic acid,DNA)连接酶、质粒小提中量试剂盒、酵母细胞质粒小提试剂盒:天根生化科技(北京)有限公司;核酸内切酶SacI(10 U/mL)、HindIII(15 U/mL)、BamHI(15 U/mL)、EcoRI(15 U/mL)、凝胶回收试剂盒:日本TAKARA公司;山梨醇/木糖醇检测试剂盒:爱尔兰Megazyme公司;三羟甲基氨基甲烷(Tris)(分析纯)、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid,EDTA)(分析纯):苏州亚科科技股份有限公司。
1.2 仪器与设备
DHP-9272型电热恒温培养箱:上海一恒科技有限公司;5430台式高速离心机:德国艾本德公司;SHA-C水浴恒温振荡器:常州国华电器有限公司;UV-1800PC紫外可见分光光度计:上海美谱达仪器有限公司;NanoDrop 2000 Thermo核酸定量仪:美国赛默飞世尔公司。
1.3 方法
1.3.1 重组载体pYES2-XYL1的构建
工程菌E.coliDH5α/pUC57-XYL1的构建:参照《分子克隆实验指南》[11]制备感受态细胞E.coliDH5α,将携带XYL1基因的pUC57克隆载体pUC57-XYL1导入其中。将转化后的E.coliDH5α/pUC57-XYL1涂布于含2%X-gal、20%异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)及100 μg/mL氨苄青霉素钠的LB固体培养基上,于37℃条件下培养12~16 h。
重组质粒pUC57-XYL1的提取:挑取白色单菌落接种于LB液体培养基中,于37℃、150r/min条件下培养过夜。采用质粒小提试剂盒提取重组质粒pUC57-XYL1,采用核酸定量仪定量。
重组质粒pUC57-XYL1的酶切:重组质粒pUC57-XYL1经核酸内切酶SacI单酶切(或HindIII及BamHI双酶切),酶切体系为1 μLSacI(或1 μLHindIII及1 μLBamHI)、2 μL 10×L Buffer(或2 μL 10×M Buffer)、5 μL质粒溶液、12 μL(或11 μL)超纯水,于37℃水浴锅中酶切1 h后,采用0.9%琼脂糖凝胶电泳检测酶切效果,采用凝胶回收试剂盒回收XYL1基因片段,置于4℃备用。
pYES2的酶切:pYES2经核酸内切酶HindIII及BamHI双酶切,酶切体系为1 μLHindIII、1 μLBamHI、2 μL 10×M Buffer、2 μL质粒溶液、14 μL超纯水,酶切条件同上。采用0.9%凝胶电泳、凝胶回收试剂盒检测及回收载体片段。
连接、转化:采用T4 DNA连接酶连接XYL1基因及pYES2载体酶切片段,连接体系为2μLXYL1基因片段、2μL pYES2载体酶切片段、1μLT4DNA连接酶、1μL10×Buffer、4μL超纯水,16℃条件下连接过夜。取3μL连接液至100μL E.coliDH5α感受态细胞中,轻摇混匀,冰浴30 min后,42℃热激90 s,加入400 μL LB液体培养基,37 ℃ 120 r/min振荡培养45min,然后将细胞涂布于含100 μg/mL氨苄青霉素钠的LB固体培养基上,于37℃条件下培养12~16 h,随机挑取10个单菌落,接种于含100 μg/mL氨苄青霉素钠的LB液体培养基中,于37℃、150 r/min条件下培养过夜,采用无内毒素质粒小提中量试剂盒提取重组质粒pYES2-XYL1。
工程菌E.coliDH5α/pYES2-XYL1的验证:采用EcoRI单酶切(或HindIII及BamHI双酶切)重组质粒pYES2-XYL1,酶切体系为1 μLEcoRI(或1 μLHindIII及1 μLBamHI)、2 μL 10×H Buffer(或2 μL 10×M Buffer)、5 μL质粒溶液及12 μL(或11 μL)超纯水,于37 ℃水浴锅中酶切1 h后,采用0.9%琼脂糖凝胶电泳检测酶切产物,确定含单拷贝XYL1基因的重组质粒pYES2-XYL1及正确的工程菌E.coli DH5α/pYES2-XYL1。大量提取单拷贝基因重组质粒pYES2-XYL1,经进一步酶切、电泳鉴定,采用核酸定量仪对重组质粒pYES2-XYL1的浓度及纯度进行检测,采用质粒提取试剂盒中的三羟甲基氨基甲烷-硼酸(Tris-boric acid,TB)洗脱缓冲液将重组质粒浓度调整到0.1 μg/μL,置于4℃备用。
1.3.2 转XYL1基因酿酒酵母INVSc1/pYES2-XYL1的构建
将酿酒酵母菌株INVSc1划线接种于YPD固体培养基,于30℃条件下培养24~48 h。挑取少量酵母细胞接种于10 mL YPD液体培养基中,于30℃、72 r/min条件下培养24 h,2 500 r/min离心10 min,弃上清液,细胞沉淀经1×三羟甲基氨基甲烷-乙二胺四乙酸二钠(Tris-EDTA,TE)缓冲溶液(10 mmol/L Tris、1 mmol/L EDTA,pH 7.5)洗涤1次后,细胞悬浮于2 mL 1×LiAc/0.5×TE缓冲溶液(100 mmol/L LiAc、5 mmol/L Tris、0.5 mmol/L EDTA,pH 7.5)中。
取100 μL酵母细胞悬液,加入10 μL重组质粒pYES2-XYL1(0.1 μg/μL)、10 μL单链DNA(10 μg/μL)及700 μL 1×LiAc/1×TE/40%聚乙二醇(polyethyleneglycol,PEG)-3350,混合均匀,于30℃水浴中孵育30 min。随后,向上述转化液中加入88 μL二甲基亚砜(dimethyl sulfoxide,DMSO),混合均匀,于42℃水浴中热激7 min,6 000 r/min离心1 min,收集细胞,经1 mL 1×TE缓冲溶液洗涤1次后,细胞悬浮于50 μL 1×TE缓冲溶液中。
转化后的细胞涂布于尿嘧啶缺陷筛选培养基表面,于30℃条件下培养2~3 d,挑取单克隆子分别接种于液体筛选培养基中,于30℃、72 r/min条件下培养24 h。采用酵母细胞质粒小提试剂盒提取重组质粒pYES2-XYL1,经EcoRI单酶切或HindIII及BamHI双酶切后,凝胶电泳检测酶切结果。采用T7 Forward primer(5′-TAATACGACTCACTATAGGG-3′)对目的基因进行测序,测序由生工生物工程(上海)股份有限公司完成。
1.3.3 转XYL1基因酿酒酵母INVSc1/pYES2-XYL1产木糖醇能力检测
转XYL1基因酿酒酵母INVSc1/pYES2-XYL1及未转XYL1基因的酿酒酵母INVSc1分别接种于10 mL SC-URA液体培养基中,于30℃条件下静置培养过夜。细胞计数板计数细胞密度,按106CFU/mL接种于50 mL含50 g/L木糖及10 g/L半乳糖(或10 g/L葡萄糖)的SC-URA液体培养基中,于30℃、200 r/min、厌氧条件下培养,每24 h取1 mL发酵液,连续取样5 d,采用山梨醇/木糖醇检测试剂盒检测发酵液中的木糖醇含量。
1.3.4 数据处理
发酵实验重复3次,发酵液中木糖醇含量取3次重复的平均数±标准差表示。采用SPASS 19.0软件对数据进行方差分析。
2 结果与分析
2.1 重组质粒pYES2-XYL1的构建
提取重组质粒pUC57-XYL1,经SacI单酶切或HindIII及BamHI双酶切,酶切产物经琼脂糖凝胶电泳检测,结果如图2所示。
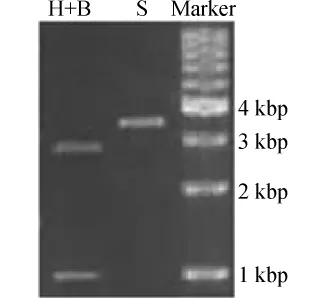
H+B为HindIII及BamHI双酶切产物;S为SacI单酶切产物图2 重组质粒pUC57-XYL1的酶切产物电泳图Fig.2 Electrophoretogram of enzyme-digested products of recombinant plasmid pUC57-XYL1
由图2可以看出,重组质粒pUC57-XYL1经单酶切后,碱基长度为3~4 kbp,与预期单酶切产物(3 667 bp)大小相符;经双酶切后,目的基因条带XYL1大小约1 kbp,克隆载体pUC57大小为2~3 kbp,与预期双酶切产物大小相符。
将带有粘性末端的目的基因XYL1与酵母表达载体pYES2连接,构建重组质粒pYES2-XYL1,结果见图3。
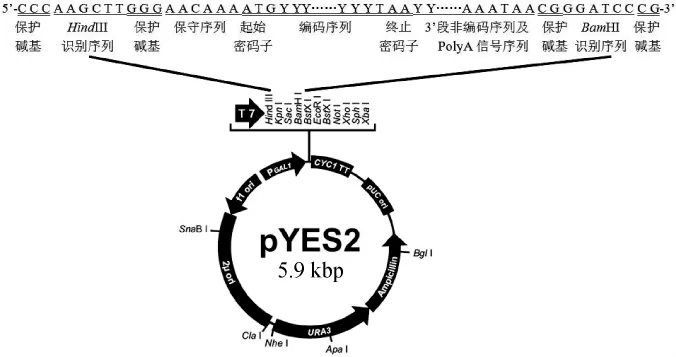
图3 重组质粒pYES2-XYL1Fig.3 Recombinant plasmid pYES2-XYL1
2.2 转XYL1基因酿酒酵母INVSc1/pYES2-XYL1的构建
将重组载体pYES2-XYL1导入酿酒酵母INVSc1感受态细胞中,通过营养缺陷互补型筛选成功获得2株转XYL1基因酿酒酵母菌株INVSc1/pYES2-XYL1,分别为INVSc1/pYES2-XYL1-01、INVSc1/pYES2-XYL1-02。提取转XYL1基因酿酒酵母菌株INVSc1/pYES2-XYL1-01、INVSc1/pYES2XYL1-02的重组质粒pYES2-XYL1-01、pYES2-XYL1-02进行酶切,酶切产物电泳结果见图4。
由图4可以看出,重组质粒pYES2-XYL1-01、pYES2-XYL-02经EcoRI单酶切后,两重组质粒的碱基长度均约为7 kbp,与其预期大小(6 825 bp)相符。经HindIII及BamHI双酶切后,目的基因XYL1碱基长度均约1 kbp,pYES2载体碱基长度均约6 kbp,与预期双酶切产物大小相符。结果表明,已成功制备含单拷贝XYL1基因的酿酒酵母菌株INVSc1/pYES2-XYL1。

H+B为HindIII及BamHI双酶切产物;E为EcoRI单酶切产物。图4 重组质粒pYES2-XYL1的酶切产物电泳图Fig.4 Electrophoretogram of enzyme-digested products of recombinant plasmid pYES2-XYL1
2.3 转基因酿酒酵母INVSc1/pYES2-XYL1发酵产木糖醇能力测定
将筛选到的2株转XYL1基因酿酒酵母菌株INVSc1/pYES2-XYL1-01及INVSc1/pYES2-XYL1-02按1×106CFU/mL菌体浓度接种于含50 g/L木糖及10 g/L半乳糖(或10 g/L葡萄糖)的SC-URA液体培养基中,于30℃、200 r/min、厌氧条件下培养,每隔24 h检测一次发酵液中木糖醇含量,结果见表1。
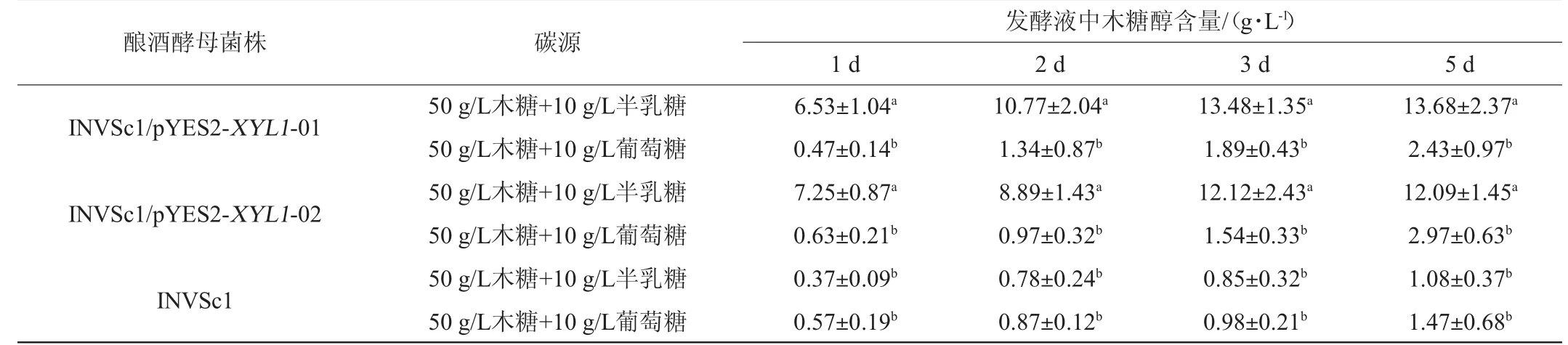
表1 酿酒酵母产木糖醇能力测定结果Table 1 Determination results of the xylitol production ability ofSaccharomyces cerevisiae
由表1可知,2株转XYL1基因酿酒酵母INVSc1/pYES2-XYL1-01、INVSc1/pYES2-XYL1-02以半乳糖及木糖为碳源时,发酵5 d后,木糖醇产量分别可达(13.68±2.37)g/L、(12.09±1.45)g/L,木糖醇产量差异不显著(P>0.05)。而非转XYL1基因酿酒酵母INVSc1的木糖醇产量为(1.08±0.37)g/L,显著低于转基因酿酒酵母组(P<0.05)。结果表明,XYL1基因的导入显著提高了酿酒酵母INVSc1菌株生产木糖醇的能力(P<0.05)。当2株转XYL1基因酿酒酵母INVSc1/pYES2-XYL1-01、INVSc1/pYES2-XYL1-02以葡萄糖及木糖为碳源时,产木糖醇的能力显著下降(P<0.05),木糖醇产量虽略高于非转XYL1基因酿酒酵母组,但无显著差异(P>0.05)。其可能原因在于,当pYES2-XYL1载体导入酿酒酵母INVSc1菌株中,启动外源基因表达的GAL1启动子在葡萄糖存在时受到抑制,导致XYL1基因无法正常表达;而当发酵液中存在半乳糖时,该启动子去阻遏,使得XYL1基因被诱导表达。
当葡萄糖作为木糖的共底物时,转XYL1基因酿酒酵母的木糖醇产量与非转XYL1基因酿酒酵母无显著差异(P>0.05),说明葡萄糖对该启动子的抑制作用很强。这一启动子使制备的转基因酿酒酵母可实现人为诱导表达,即在种子制备阶段,采用含葡萄糖的培养基抑制XYL1基因表达,避免外源基因的过度表达对转XYL1基因酿酒酵母的生理影响,而在发酵木糖阶段,发酵液中添加一定浓度的半乳糖诱导GAL1启动子启动XYL1基因的表达。由于酿酒酵母的发酵过程必然伴随着半乳糖的消耗,因此,发酵液中初始半乳糖的含量对整个发酵过程至关重要。有关发酵液中适宜的半乳糖初始浓度有待进一步研究。
木糖作为自然界中较为丰富的可再生碳源,使人们尝试将高活性xyl酵母菌种中的XYL1基因导入酿酒酵母中,制备转XYL1基因酿酒酵母并发酵木糖制备木糖醇[9,11-15]。目前,已在包括树干毕赤酵母(P.stipitis)在内的多个酵母菌种中检测到XYL1基因的高效表达[4-9]。通常采用聚合酶链式反应(polymerase chain reaction,PCR)技术或反转录酶-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)技术从基因组DNA或转录组核糖核酸(ribonucleicacid,RNA)中扩增目的基因的DNA序列或cDNA序列。在本研究中,在已知树干毕赤酵母XYL1基因DNA序列(GenBank:X59465.1)的基础上,采用人工合成的方法获得该基因的编码序列及部分3′端非编码序列。转XYL1基因酿酒酵母发酵木糖制备木糖醇的能力间接证明了合成基因的高效表达。在转基因领域,由于某些生物材料特别稀少,甚至难以获得,因此,无法采用常规PCR或RT-PCR技术获得目的基因。本研究为类似的转基因研究提供了理论及技术基础。
3 结论
本研究成功构建转XYL1基因酿酒酵母INVSc1/pYES2-XYL1-01、INVSc1/pYES2-XYL1-02,其以50g/L木糖及10g/L半乳糖为碳源发酵5 d后,木糖醇产量分别达到(13.68±2.37)g/L、(12.09±1.45)g/L,显著高于非转基因酿酒酵母INVSc1的木糖醇产量(1.08±0.37)g/L(P<0.05)。结果表明,XYL1基因的导入显著提高了酿酒酵母INVSc1菌株生产木糖醇的能力(P<0.05)。为采用基因工程酿酒酵母制备食用木糖醇提供了理论及技术基础。

