贵州省猪源大肠杆菌对磺胺类抗菌药物耐药性及耐药基因检测
寇 宏,吕世明,谭艾娟,王 想,张顺然,罗致茜,林 习,杨睿智
(1.贵州大学动物科学学院 ,贵州 贵阳 550025;2.贵州大学生命科学学院,贵州 贵阳 550025)
大肠杆菌是人和动物肠道中普遍存在的一类肠道共生菌群,也是一种人兽共患病的条件致病菌群,大肠杆菌也经常作为抗生素耐药基因的贮存库,在细菌耐药性分析及耐药基因传递研究方面起着非常重要的作用[1-2]。近年来,随着规模养殖产业的迅速发展,大肠杆菌等细菌病原对于动物健康的危害日趋广泛而复杂,这也就直接导致了抗菌药物的大量使用,使细菌耐药及耐药基因传递逐渐成为广泛关注的严峻问题[3-4],这给养殖业的健康发展埋下隐患,更为人与动物疾病的预防及治疗带来了极大的危害。
磺胺类药物是广谱抗菌药,对革兰阴性和革兰阳性细菌均有抑菌作用[5]。自从百浪多息(Prontosil)在1935年发现磺胺类药物以来[6],磺胺类药物已经被广泛应用于人类和动物细菌病及原虫感染的治疗[7]。由于磺胺类药物有其独特的优点:(效价高、毒副作用小、口服容易吸收、性质稳定、国内大量生产等[5-6],现仍在兽医抗感染治疗上发挥重要作用[8]。本研究通过对贵州省各个地区得到的66株猪源大肠杆菌,使用微量肉汤稀释法进行药敏试验。使用PCR方法对sul1、sul2和sul3进行了检测,为贵州省猪大肠杆菌病的科学防控提供理论依据,也为兽医临床磺胺类药物的合理应用提供科学依据,从而减少或降低抗生素抗性对人类及动物健康造成的影响。
1 材料与方法
1.1 菌株来源 试验菌株由2012年从贵州省安顺(9株)、铜仁(11 株)、六盘水(11 株)、遵义(11株)、毕节(13株)、黔东南(11株)6个地区的部分规模化养猪场采集样本,并由贵州大学药理实验分离纯化,保种66株猪源大肠杆菌。标准菌株大肠杆菌ATCC25922,购自中国兽医药品监察所。
1.2 药品及试剂 磺胺嘧啶(SD)、磺胺二甲嘧啶(SM2)、磺胺噻唑(ST)、磺胺甲噁唑(SMZ)、磺胺间甲氧嘧啶(SMM),均购自大连美仑生物技术有限公司;LB肉汤,购自北京奥博星生物科技有限责任公司;伊红美兰琼脂(EMB),购自上海博微生物技术有限公司;50×TAE电泳缓冲液、DM-2 000 DNA Marker、2 × Tag PCR Master Mix,均购自北京康为世纪生物科技有限公司;GoldView核酸指示剂购自Solarbio公司。
1.3 PCR扩增产物根据GenBank上登录的sul1基因,利用Premier 5.0软件设计1对sul1特异性引物,而sul2、sul3引物参照周万蓉等[9]设计,引物由生工生物工程(上海)股份有限公司合成(详见表1)。

表1 sul基因引物序列
1.4 方法
1.4.1 药敏试验 以ATCC25922为药敏质控细菌,根据美国临床实验室标准化委员会CLSI 2009年版标准,采用微量肉汤稀释法测定66株猪源大肠杆菌对5种磺胺类抗菌药的最小抑菌浓度(MIC值)。MIC值≥512为耐药菌株,≤256为敏感菌株。
1.4.2 sul基因检测 细菌DNA模板的制备:参照孙硕等[10]方法采用煮沸法提取66株大肠杆菌总DNA作为模板。
PCR反应体系:采用12 μL反应体系,2×Tag PCR Master Mix 5 μL,DNA 模板 5 μL,上下游引物各 0.5 μL 共 1 μL,灭菌蒸馏水补足 12 μL。
PCR反应条件与产物电泳:94℃ 5 min预变性,94℃ 50 s变性,56℃退火,72℃ 50 s延伸,32次循环。配制1.5%的琼脂糖,90 V电泳40 min。在紫外照胶仪下检测PCR产物。
1.4.3 扩增产物的序列测定 将扩增出有sul1、sul2、sul3目的条带的可疑PCR产物。送至生工生物工程(上海)股份有限公司进行单向测序,并与NCBI基因库已经登录的sul基因进行 BLAST比对。
2 结果
2.1 贵州省66株猪源大肠杆菌药敏试验检测结果
试验菌株对磺胺类抗生素药敏情况如表2,其中对磺胺二甲嘧啶耐药率为93.94%,其次是磺胺甲噁唑和磺胺噻唑分别为86.36%、89.39%,磺胺间甲氧嘧啶和磺胺嘧啶分别为84.85%、80.30%。试验菌株对5种磺胺类抗生素中的耐药率均超过50%。表明贵州省猪源大肠杆菌对磺胺类药物耐药现象十分严重。

表2 66株大肠杆菌对5种药物的耐药情况
2.2 sul基因PCR检测结果 3种sul耐药基因的阳性扩增片段如下图1所示。所扩的片段大小与目的片段相一致,将扩增产物送至生工生物工程(上海)股份有限公司进行序列测序,所测序结果与GenBank上登录的sul基因序列BLAST比较结果,其同源性均达到99%。表明扩增产物为3个sul基因。
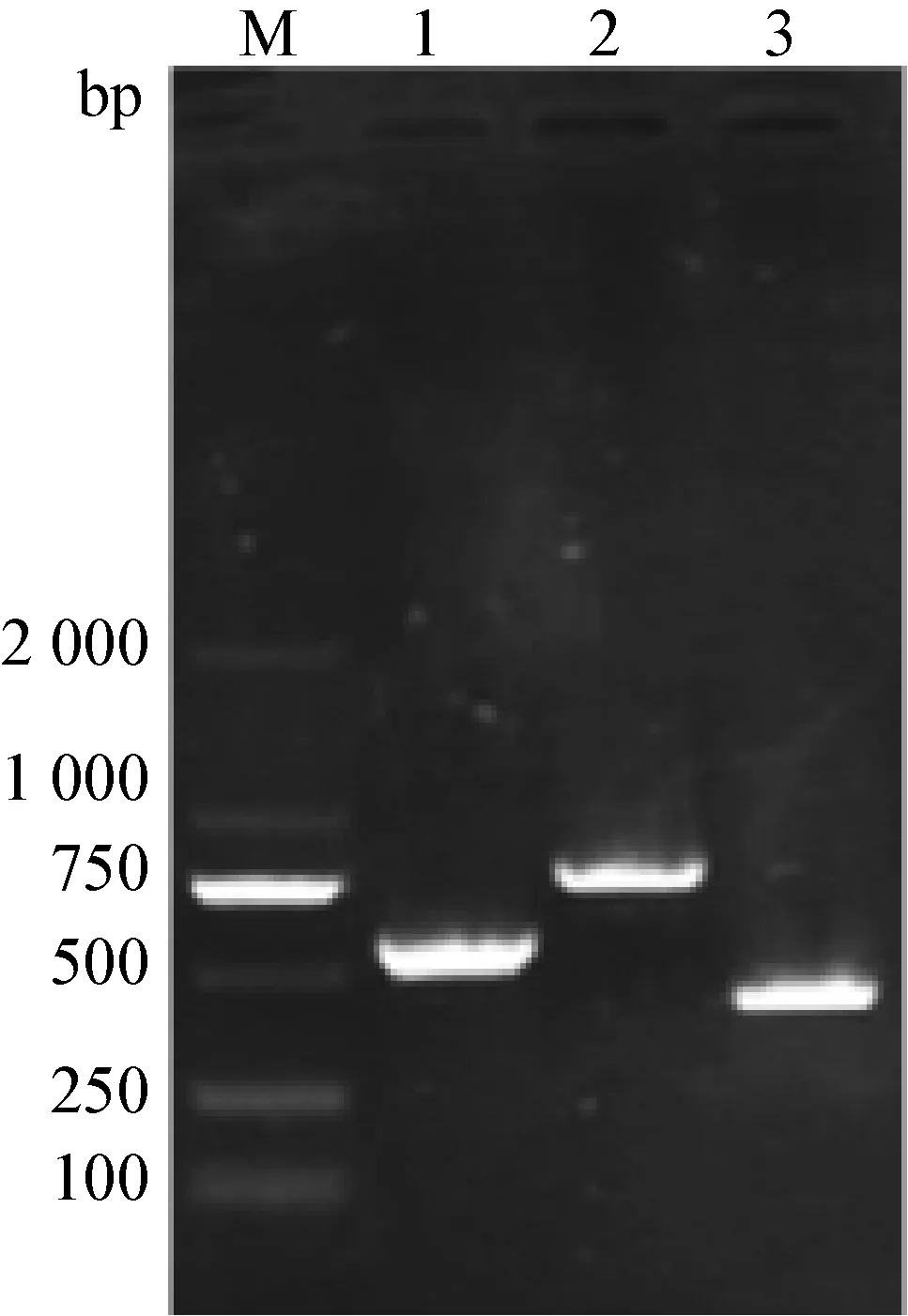
图1 sul基因PCR扩增结果
2.3 贵州省66株猪源大肠杆菌耐药基因检测结果 通过PCR方法对66株猪源大肠杆菌进行sul1、sul2及sul3三种基因的检测(表3)。试验结果显示,3个耐药基因的检出率为100%(66/66)。其中sul1的检出率为 89.4%(59/66),sul2的检出率为77.3%(51/66),sul3 的检出率为 100% (66/66)。只同时携带sul1和sul2的菌株检出率为0(0/66),只同时携带sul1和sul3的菌株检出率为15.2%(5/66)。只同时携带sul2和sul3的菌株检出率为3.0%(2/66)。同时携带sul1、sul2和sul3的菌株检出率为74.2%。
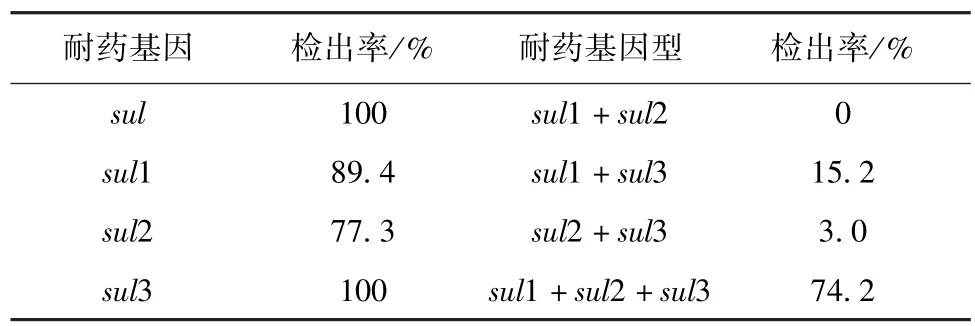
表3 66株大肠杆菌中磺胺类药物主要耐药基因的分布
2.4 耐药表型与耐药基因携带的关系 由表4可知,sul3基因的携带率为100%,sul1+sul2+sul3基因型的检出率在73%以上,对磺胺间甲氧嘧啶耐药的大肠杆菌此类型基因携带率为81%,因此,此类基因的携带在耐磺胺类药物的大肠杆菌中起主要作用,与菌株的耐药性关系明显。sul1、sul2基因型的单独检出率为0,sul3的单独检出率最高为8%,最低为4%;基因型和 sul1+sul2、sul1+sul3、sul2+sul3最高检出率分别为0、16%、4%。
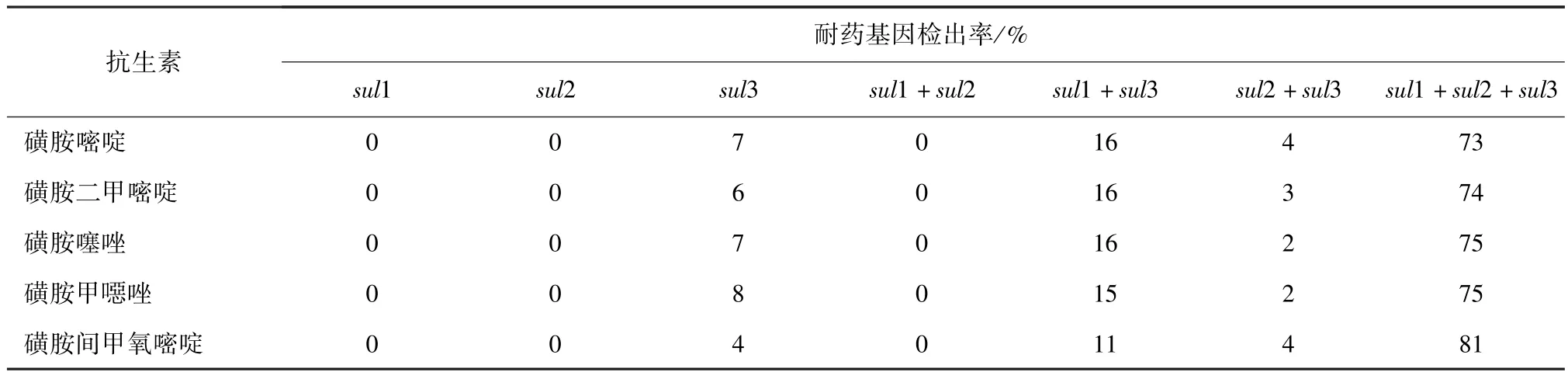
表4 耐磺胺类药物的大肠杆菌耐药表型与耐药基因检出情况比较
3 讨论
3.1 抗菌药物至今仅仅使用了70多年,很多曾经可以轻易治疗的细菌感染性疾病现在已经很难治疗。很多曾经可以用一种药物治疗的传染病目前已经成为严重的公共卫生安全问题[11]。耐药性,特别是多重耐药菌的不断出现,给人和动物的治疗带来极大的困难[12]。
由药敏试验结果可知,66株猪源大肠杆菌对5种磺胺类药物:磺胺嘧啶、磺胺二甲嘧、磺胺噻唑、磺胺甲噁唑、磺胺间甲氧嘧啶的耐药百分率分别为84.85%、93.94%、86.36%、89.39%、80.30%,此结果表明,贵州省各地区磺胺类药物耐药十分严重。与王红宁等[13]研究四川规模化猪场分离的大肠杆菌对磺胺类药物耐药率26.1%相比,明显上升;与刘开成等[14]从山东、内蒙古、山西分离到的161株猪源大肠埃希菌对磺胺异噁唑(SF)和新诺明(SMZ)的耐药率分别为91.30%和90.06%,基本一致;与沈宪文等[15]分析吉林省部分地区仔猪大肠杆菌耐药性对磺胺异噁唑(SF)耐药率89.55%,对新诺明(SMZ)耐药率86.57%相比,基本相一致。与植婵萍等[16]报道的种鹅大肠杆菌对于磺胺类药物复方新诺明的耐药率在90%以上,基本一致。都表现出极高的耐药水平。大肠杆菌对磺胺药的耐药率呈明显的上升趋势,一方面是由于药物长期、大量、不合理的使用[17-18]。另一方面由于磺胺类药物耐药基因主要位于质粒上,细菌通过质粒在细菌间不断的传递[19-20]。
3.2 耐磺胺类药物大肠杆菌体内sul基因可通过转座子、质粒和整合子在细菌间传递,该基因编码可替代性的、对磺胺类药物亲和力更低的新二氢叶酸合成酶并高水平表达,从而导致细菌对磺胺类药物的抗性[21]。目前发现的磺胺类耐药基因sulR主要是sul1、sul2、sul3[22]。本试验首次对贵州省各地区临床分离的大肠杆菌进行了磺胺类药物耐药基因sul1、sul2、sul3分子检测的研究。结果表明,磺胺类药物耐药基因普遍存在于贵州省各地区的耐磺胺类药物的大肠杆菌中,sul2总的检出率为77.3%,此结果与sul2基因在猪源大肠杆菌中分布是最广泛的,在大肠杆菌对磺胺药物耐药性方面的研究具有重要的意义[21]结论相似。也说明sul2基因是猪源大肠杆菌对磺胺类药物耐药的主要决定簇[23]。在Perrten V等[24]的研究中,sul3基因的检出率占sulR基因的三分之一,而在本试验中sul3的检出率为100%,与前者相比sul3的检出率有所上升。说明sul3基因在耐磺胺药菌株中所占比重有所上升。其中最主要的磺胺耐药基因同时携带两种基因型的菌株为18.2%,同时携带3种基因型的菌株为74.2%。由此可见,磺胺类耐药基因在贵州省各地区广泛存在,应给予足够的重视。并且本试验检测的磺胺类耐药基因携带率比较高,究其原因可能耐药基因是通过质粒或染色体进行了水平散播,有待深入研究加以证实。

