甜瓜枯萎病菌ELISA检测方法的初步建立
延 涵,杨瑞秀,盖晓彤,李 刚,赵治国,高增贵,*
(1.内蒙古出入境检验检疫局 检验检疫技术中心,内蒙古 呼和浩特 010020; 2.沈阳农业大学 植物免疫所,辽宁 沈阳 110866)
甜瓜枯萎病是由尖孢镰孢菌甜瓜专化型(Fusariumoxysporumf.sp.melonis)侵染引起的,防治难度较高。甜瓜植株一旦患病,常引起瓜秧整株枯萎死亡,造成不可逆转的损失[1]。目前,甜瓜枯萎病的检测主要依靠传统方法和分子检测方法,单靠传统方法通过分离培养、生物学测定等常规技术进行检测诊断,不仅难度较大,而且效率低、速度慢[2]。分子生物学方法成本较高,且须配备相应的检测设备,限制了其在实际生产生活中的应用。ELISA检测技术建立在抗原和抗体免疫反应的基础上,测定中可使用的抗原种类多样,只要可以附着在固相载体上即可[3],该方法适用于类菌质体、植物病原细菌以及植物病原真菌的检测。病原真菌无需分离、活化便可进行检测,田间检测非常便捷。ELISA检测方法通过测定病原蛋白的含量来研究寄主-病原物互作关系。近年来,许多学者对植物病害的ELISA检测方法进行了研究,如张亮[4]建立了棉花黄萎病菌双抗夹心ELISA法检测技术,孙艳秋等[5]制备了黄瓜细菌性白枯病菌的特异性抗体并建立了其ELISA检测方法。目前,国内有关甜瓜枯萎病菌的血清学检测方法尚无报道,建立快速、简便的甜瓜枯萎病菌血清学检测方法可为田间快速诊断该病害提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 供试病原菌
甜瓜枯萎病菌(Fusariumoxysporumf.sp.melonis)、黄瓜枯萎病菌(Fusariumoxysporumf.sp.cucumerinum)、西瓜枯萎病菌(Fusariumoxysporumf.sp.niveum)和苦瓜枯萎病菌(Fusariumoxysporumf .sp.momdicae)均由沈阳农业大学植物免疫所分离保存。
1.1.2 实验动物
雄性新西兰大白兔3只,体质量约2 kg(沈阳药科大学实验动物中心)。
1.1.3 试剂
抗体(自制);碱性磷酸酶标记羊抗兔Ig-G (Sigma);牛血清蛋白(BSA)(Solarbio);弗氏不完全佐剂(FICA)(Sigma);弗氏完全佐剂(FCA)(Sigma);磷酸缓冲液(PBS)、包被液、洗板液、显色液、终止液,均为国产分析纯试剂,按照陈新建[6]方法自配。
1.1.4 仪器
全波长酶标仪(Thermo);紫外可见分光光度计(尤尼柯仪器有限公司);通用数字加热磁力搅拌器(北京鼎昊源科技有限公司);培养箱(上海一恒科学仪器有限公司);高速冷冻离心机(HITACHI)。
1.2 方法
1.2.1 菌丝体胞内蛋白提取及其浓度测定
将甜瓜枯萎病菌菌体置于PDA培养液,25 ℃连续培养7 d,用纱布将菌丝过滤,无菌水冲洗3次,在冷冻干燥机中干燥48 h去除水分。在干燥后的菌丝中加入一定量的PBS提取液(质量体积比2∶1),液氮中充分研磨;4 ℃、8 000 r·min-1离心20 min,再4 ℃、15 000 r·min-1离心1 h,取上清液即得菌丝蛋白。
用考马斯亮蓝G-250测定提取的菌丝蛋白在595 nm的吸光值。制作牛血清蛋白系列浓度标准曲线,根据标准曲线得出甜瓜枯萎病菌菌丝蛋白的浓度,用提取液稀释,-20 ℃保存备用。
1.2.2 免疫方案
选取体质量为2 kg左右的雄性新西兰大白兔3只进行免疫注射。首次免疫剂量为0.5 mL菌丝蛋白提取液与等体积的弗氏完全佐剂,在无菌注射器内充分混匀,采取腿部肌肉注射的方法免疫注射3只兔子;15 d后进行第2次免疫注射,此次免疫剂量为0.5 mL菌丝蛋白提取液与等体积的弗氏不完全佐剂,之后均使用该剂量,共免疫注射5次。第5次免疫注射10 d后,杀兔取血。免疫注射前后均在兔耳缘静脉取血5 mL,以备检测使用。
1.2.3 抗血清的提取
将提取的兔血清在25 ℃静止5 h,4 ℃过夜。4 ℃、5 000 r·min-1离心30 min,再4 ℃、10 000 r·min-1离心10 min,取上清液即为抗血清,-20 ℃保存备用。
1.2.4 抗血清的纯化
采用饱和硫酸铵分级沉淀法[6]进行抗体纯化。
1.2.5 抗血清的选择
采用间接ELISA方法测定3只兔子抗血清的吸光度(D405),选择效果好的血清用于后续实验。
1.2.6 抗体效价测定
将纯化后的抗血清在冰上解冻后,用PBS倍比稀释,从1∶100稀释至1∶26 500。按间接ELISA方法测定抗体的效价。以阴性血清(即免疫前的血清)为对照,测定D405。计算P/N值,P/N>2.1为阳性,P/N<2.1为阴性。
1.2.7 酶标记抗体的工作浓度确定
用PBS将酶标记抗体分别稀释为1∶250、1∶500、1∶1 000、1∶2 000和1∶5 000,用间接ELISA法筛选出最佳的稀释倍数。
1.2.8 抗原、多克隆抗体最佳工作浓度的确定
将抗原用PBS从1∶100倍比稀释到1∶8 000,将多克隆抗体用PBS从1∶500倍比稀释至1∶8 000。采用方阵滴定法和间接ELISA法测定D405值。
1.2.9 抗体特异性的测定
分别用PBS提取甜瓜枯萎病菌、黄瓜枯萎病菌、西瓜枯萎病菌和苦瓜枯萎病菌的菌丝蛋白,用间接ELISA法测定,检测抗体的特异性。
1.2.10 抗体灵敏度测定
用PBS缓冲液稀释甜瓜枯萎病菌菌液为0.2、0.1、0.05、0.025、0.01、0.005、0.001 μg·mL-1,用间接ELISA法测定D405,绘制标准曲线,对灵敏度进行测定。
1.2.11 田间病样ELISA检测
采集感病的甜瓜植株标样,截取发病部位的根茎,放入研钵中,加入PBS提取液(质量体积比1∶2),充分研磨,静置30 min。将其转移到离心管中,充分混匀,4 ℃、8 000 r·min-1离心15 min,取上清液备用。采用间接ELISA法对上清液进行测定,以未发病的植株提取液作为对照。
1.2.12 土壤中甜瓜枯萎病菌ELISA检测
土壤源于沈阳农业大学实验基地甜瓜种植大棚和非甜瓜种植田地。
分别取种植1 a甜瓜、连作5 a甜瓜以及非甜瓜种植区的土壤,将土壤表层土去掉,采集距离甜瓜植株10~20 cm的土壤约1 kg。去除土壤中的石块、根茎以及其他杂质,将土壤风干后过2 mm筛,并用研磨机打磨。将非甜瓜种植区的土壤于101 kPa、120 ℃灭菌2 h,其他土壤样品不做灭菌处理。分别称取灭菌土壤和连作甜瓜土壤1.00 g于离心管中,加入PBS提取液振荡混匀,静置24 h,25 ℃、8 000 r·min-1离心30 min,取上清液。将上清液过0.22 nm微孔滤膜,以除去细菌;再次离心,取上清液用作检测。采用间接ELISA法进行测定,灭菌土壤上清液作为对照。
2 结果与分析
2.1 抗血清选择结果
用间接ELISA法测定3只兔子所提取的抗血清的反应情况,二抗(碱性磷酸酶标记羊抗兔IgG)稀释浓度为商品说明书推荐的浓度1∶5 000。选取吸光度较高、反应情况好的抗血清为后续实验所用血清。实验结果表明,2号兔子吸光度均值最高,达0.524,可用作后续实验。
2.2 抗体效价
对抗体进行倍比稀释,间接ELISA法测定效价。结果表明,稀释倍数为1∶25 600时,P/N>2.1,呈阳性;当稀释倍数为1∶51 200时,P/N<2.1,呈阴性。因此,抗体的效价为1∶25 600(表1)。
2.3 抗原、抗体最适工作浓度
间接ELISA实验中,抗体的工作浓度是影响实验结果的重要因素,抗体工作浓度直接影响抗原对其的反应灵敏度。本实验采用方阵滴定法确定抗原和抗体的最佳工作浓度。实验结果表明,抗体稀释倍数为1∶1 000时,D405值(1.005)最接近1,为抗体最佳工作浓度(表2)。
2.4 酶标记抗体最佳工作浓度选择
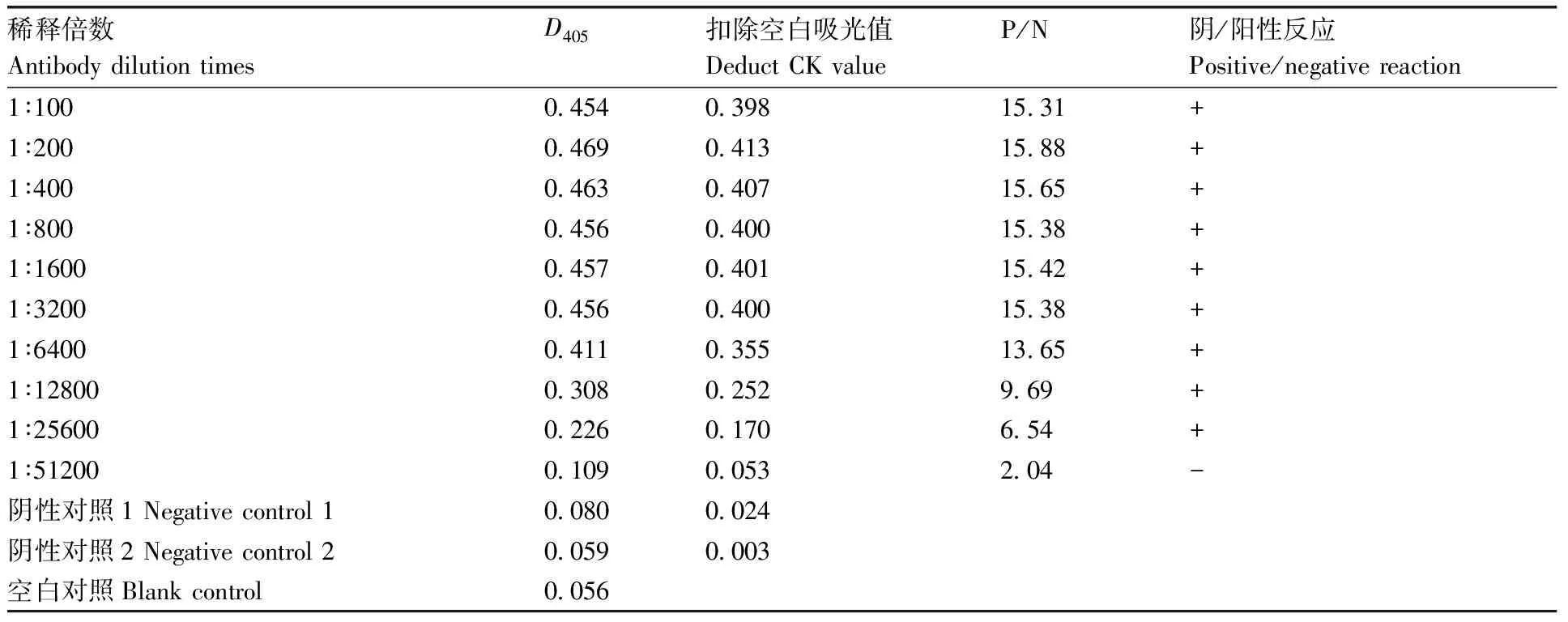
表1 抗体效价
+,阳性;-,阴性。下同。
+,positive; -,negative.The same as bellow.
商品化酶标记羊抗兔IgG说明书推荐稀释比例为1∶5 000。在抗原、抗体最佳工作浓度确定的基础上,对酶标记抗体的稀释比例进行优化。使用间接ELISA法测定D405。实验结果表明,稀释倍数为1∶250、1∶500、1∶1 000、1∶2 000、1∶5 000时,D405分别为1.262、1.017、0.721、0.593、0.399,表明稀释倍数越小,反应结果越好,稀释比例为1∶250时D405最大。综合考虑经济和实验效果,本实验采用1∶1 000的稀释比例作为酶标记抗体的工作浓度。
2.5 抗体特异性
由表3可知,本研究制备的多克隆抗体仅与甜瓜枯萎病菌的蛋白呈阳性反应,与黄瓜枯萎病菌、苦瓜枯萎病菌和西瓜枯萎病菌蛋白均呈阴性反应(表3、图1)。表明本实验制备的多克隆抗体对甜瓜枯萎病菌有特异性,可用于甜瓜枯萎病的特异性检测。
2.6 抗体灵敏度
间接ELISA测定的灵敏度结果如图2。菌体抗原稀释到0.005 0 μg·mL-1时,P/N>2.1;菌体抗原稀释到0.002 5、0.001 0 μg·mL-1时,P/N<2.1。因此,间接ELISA检测的灵敏度为0.005 0 μg·mL-1。
2.7 田间病样检测
采用间接ELISA法测定罹病甜瓜植株样品,结果表明:2份患病甜瓜样品的P/N值均大于2.1,呈阳性反应;而健康植株样品的P/N值小于2.1,呈阴性反应(表4)。
2.8 土壤中甜瓜枯萎病菌检测结果
采用间接ELISA法,以标准尖孢镰孢菌胞内蛋白浓度的对数为横坐标,D405为纵坐标,绘制标准曲线(图3),回归方程为y=0.0555x+0.0312,相关系数r=0.960 9,可见抗原蛋白质浓度与其D405显著相关。表明所建立的ELISA方法可行,据此可进行土壤提取液样品中抗原蛋白的定量测定。
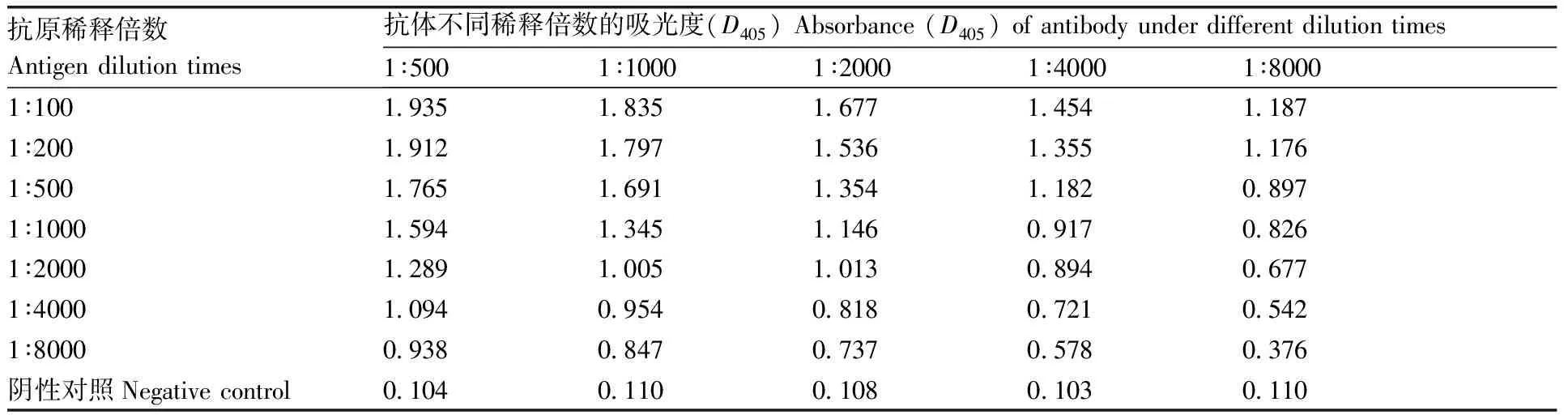
表2 抗原和抗体工作浓度优化

表3 抗体的特异性

1~7依次为甜瓜枯萎病菌、黄瓜枯萎病菌、西瓜枯萎病菌、苦瓜枯萎病菌、阴性对照、阴性对照、空白对照。1-7 represented Fusarium oxysporum f.sp.melonis,Fusarium oxysporum f.sp.Cucumerinum,Fusarium oxysporum f.sp.niveum,Fusarium oxysporum f .sp.momdicae,negative CK,negative CK,blank,respectively.图1 抗体特异性Fig.1 Specificity of antibody

图2 抗体灵敏度Fig.2 Sensitivity of the antibody
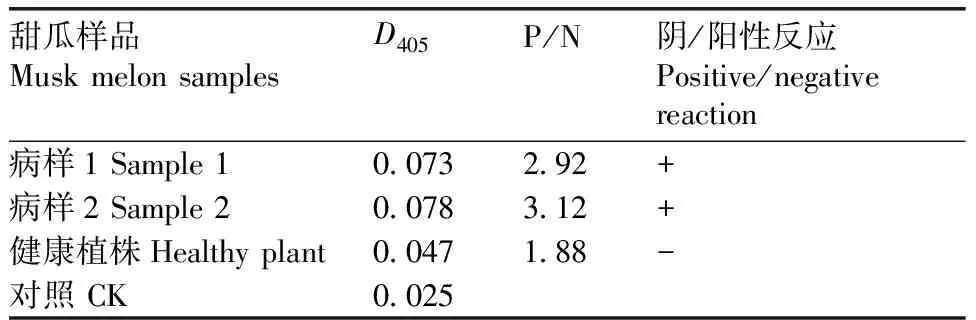
表4 田间病样检测结果
将3份土壤提取液进行间接ELISA测定,未灭菌的种植1 a甜瓜的土壤和连作5 a甜瓜的土壤样品提取液测定结果呈阳性,而灭菌后的土壤样品的测定结果为阴性(表5)。根据标准曲线计算,种植1 a甜瓜的土壤样品提取液中蛋白浓度为2.28 μg·mL-1,连作5 a甜瓜的土壤样品提取液中蛋白浓度为4.43 μg·mL-1。
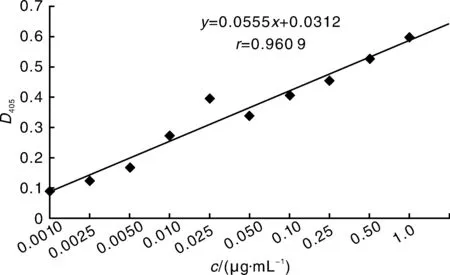
图3 尖孢镰孢菌胞内蛋白标准曲线Fig.3 Standard curve of mycelia protein from Fusarium oxysporum

表5 土壤样品测定结果
3 讨论
近年来,ELISA法日益广泛地用于植物病害的免疫学诊断,特别是植物病害细菌和真菌的检测。该方法不仅具有很强的灵敏性,经过优化后的ELISA反应还可以制成商品化的试剂盒,达到了快速、灵敏、便捷的检测效果。实验中使用甜瓜枯萎病菌的胞内蛋白制备了多克隆抗体,该抗体有较强的特异性和较高的灵敏度。一般来讲,不存在绝对专一的抗体,全血清中会含有一些非特异性的抗体蛋白,如白蛋白、α1和α2球蛋白等,如不进行抗体的纯化会对包被有所影响,同时也会影响抗体的灵敏度,可以采用柱层析方法提高抗体的纯度、制备相应的单克隆抗体和吸附法等。影响ELISA实验的因素诸多,如实验温度、包被条件、包被时间、抗原抗体反应条件、固相载体等,实验过程中试剂、加样、反应时间的控制也是影响实验结果的重要因素,进一步探究这些因素对实验的影响,可以获得更为准确的实验结果[7]。本实验对采集的病样和甜瓜种植土壤中的带菌情况进行了定性和定量测定,结果表明,建立的ELISA检测方法具有良好的特异性和灵敏度,在实际生产中,可以用于甜瓜枯萎病的快速检测。

