单、双指数模型DWI在良恶性肺结节鉴别诊断中的应用
洪琴, 江建芹, 崔磊, 胡春洪, 王玉玲, 徐高峰
肺结节的诊断一直是临床的重点及难点。早期肺癌的5年生存率为77%~92%,中晚期及晚期肺癌的5年生存率不足40%[1],因此,早期诊断是决定患者预后的关键因素。磁共振扩散加权成像(diffusion-weighted imaging,DWI)是在传统MRI形态学诊断的基础上,对组织内水分子运动进行定量评估的功能成像技术,是一种无创、无辐射和无需对比剂的检查方法。近年来已有相关研究结果表明,DWI定量参数如表观扩散系数(apparent diffusion coefficient,ADC)及病灶/脊髓信号比值等在良恶性肺部病灶的鉴别诊断中有潜在应用价值[2-4]。
但是由于b值设定的限制,单指数模型法测量的ADC值不同程度地混入了组织的灌注效应。DWI的体素内不相干运动(intravoxel incoherent motion,IVIM)模型中利用了多个从低到高的b值,可以将水分子的真性扩散与微循环灌注形成的假性扩散区分开,得到纯扩散参数(D),且可在不使用外源性对比剂的情况下得到组织灌注的相关参数(D*)和灌注分数(f),可为肺结节的评估提供更多的信息[5]。目前,已有数篇文献报道了IVIM对良恶性肺部病灶的诊断价值,但这些研究结果间存在争议[6-9]。肺结节是指肺内直径小于3 cm的孤立性类圆形病灶[10]。目前,还没有学者在研究中将肺结节单独进行比较。
因此,本研究旨在评价DWI单指数模型定量参数及IVIM参数在良恶性肺结节中的鉴别诊断价值,为肺结节的临床评估提供理论依据。
材料与方法
1.一般资料
本研究获得本院伦理委员会批准,所有受检者检查前签署了知情同意书。纳入标准:①CT拟诊为孤立性肺结节,病灶最大径≥1.5 cm但≤3 cm,且磨玻璃、钙化、坏死和空洞成分小于病灶体积的1/3[11];②检查前未行任何抗肿瘤治疗及穿刺、支气管镜等侵入性检查,检查后一个月内有组织病理学结果;③无MRI检查禁证,并且能配合完成检查者。排除标准[12-13]:图像质量差,存在严重的磁敏感伪影或运动伪影(3例);病理结果为交界性肿瘤,如炎性肌纤维母细胞瘤(1例)。
2015年8月-2017年7月共32例患者(32个病灶)纳入本研究。其中男15例,女17例;年龄44~77岁,平均年龄(59.3±11.9)岁。所有患者均经病理证实,其中经手术证实20例,经皮肺穿刺活检证实5例,经纤维支气管镜活检5例,胸水找到癌细胞2例。病灶直径1.5~2.9 cm,平均(2.27±0.35) cm。
2.检查方法
使用Siemens Verio Tim 3.0T磁共振扫描仪和8通道相控阵体表线圈。患者取仰卧位头先进,扫描范围自胸廓入口至肺下界。扫描序列包括常规平扫、DWI及IVIM,扫描参数如下。①冠状面单次激发FSE T2WI:TR 1200 ms,TE 83 ms,矩阵288×288,视野36 cm×36 cm,层厚6.0 mm,层间距7.2 mm,扫描层数20,两次屏气完成扫描;②横轴面脂肪抑制T1WI容积内插屏气扫描(volumetric interpolated breath hold examination,VIBE):TR 4.22 ms,TE 1.9 ms,矩阵288×288,视野38 cm×31 cm,层厚3 mm,层间距3 mm,扫描层数72,一次屏气完成扫描;③横轴面呼吸触发脂肪抑制T2WI:TR 2000 ms,TE 90 ms,矩阵320×320,视野36 cm×36 cm,层厚5.0 mm,层间距6.5 mm,扫描层数28。④单指数DWI及IVIM-DWI的扫描参数见表1。

表1 单指数DWI及IVIM-DWI的扫描参数
注:DWI序列均联合基于K空间算法的并行采集技术(generalized autocalibrating partially parallel acquisition,GRAPPA)。
3.数据处理及分析
选择DWI(b=800 s/mm2)上病灶信号强度(signial intenstiy,SI)最高的层面,沿着病灶的边缘勾勒ROI,测量病灶的SI;同时,在同一层面沿着脊髓的边缘勾画圆形ROI,测量脊髓的SI。计算病灶与脊髓SI的比值(ratio of SIlesion-to-SIspinalcord,LSR800)。
参考T2WI及DWI图像,确定肿瘤的最大层面,在相应的ADC图上沿着病灶的边缘手动勾画ROI[11,14],避开肉眼所见的钙化、血管、坏死和伪影等,记录软件自动计算所得的ADC均值(ADCmean)和ADC最小值(ADCmin),测量3次取平均值。
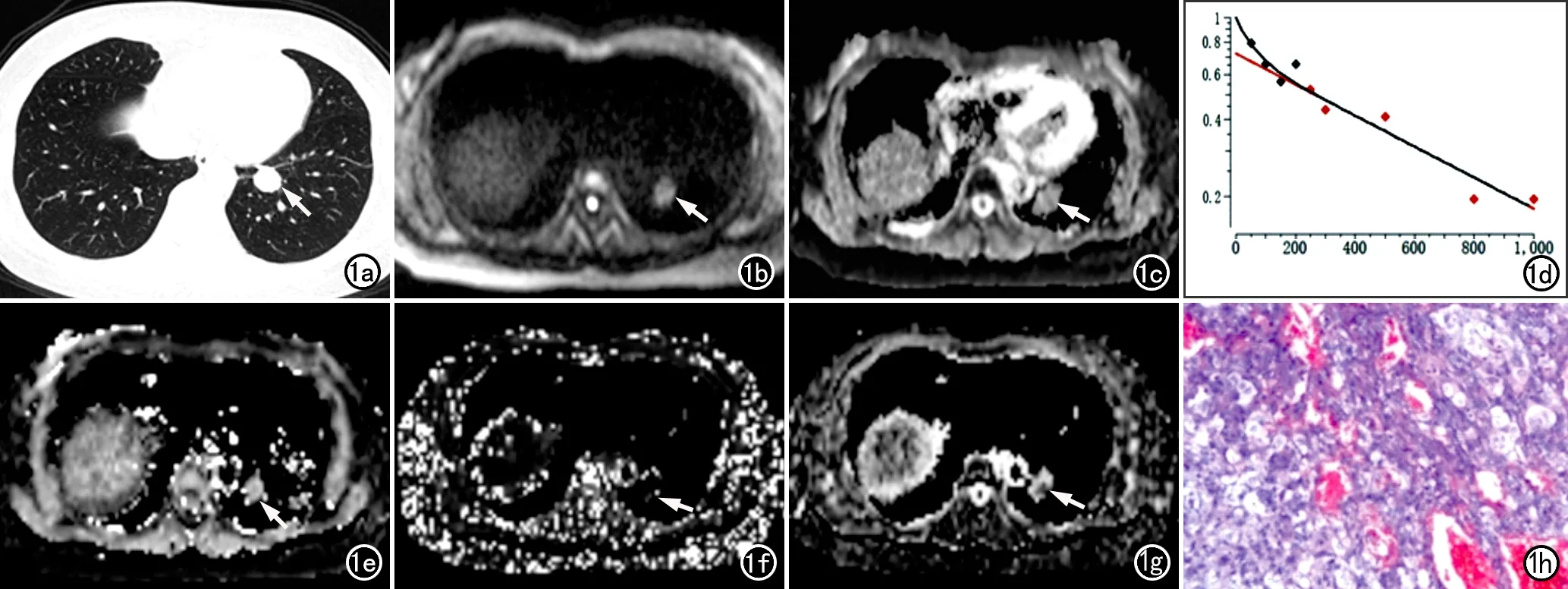
图1 左肺下叶硬化性细胞瘤。a)CT显示左肺下叶小结节,边缘光滑,密度均匀(箭); b) DWI图像(b=800s/mm2),显示病灶呈等信号(箭) ,由于病灶偏小比并靠近膈肌,受呼吸伪影的影响较大,病灶轻微变形,LSR800=0.571; c) ADC图像,显示病灶等信号(箭); d) IVIM生成的非线性最小二乘法拟合模型(nonlinear least squares,NLLS)曲线图,显示随b值的增大病灶信号强度的变化情况,可见有数个点偏离了曲线,提示其数据拟合可能存在误差; e) D值图像,显示病灶呈等信号(箭); f) D*值图像,显示病灶呈低信号(箭); g) f值图像,显示呈高信号(箭); h) 病理片镜下示肿瘤内可见乳头状区、硬化区和出血区(×100,HE)。
使用德国癌症研究中心开发的图像处理软件(medical imaging interaction toolkit,MITK)进行图像后处理,将多b值DWI图像(b=0、50、100、150、200、250、300、500、800和1000 s/mm2)加载到MITK软件的IVIM模块下,将b值调至200 s/mm2进行测量。ROI选择方法同ADC值,即在病灶的最大层面沿着病灶的边缘手动勾勒,避开肉眼所见的钙化、血管、坏死和伪影等,记录软件自动计算所得的f、D和D*值,测量3次取平均值。
以上ROI均由两位测量者(测量者A有10年MRI阅片经验,测量者B有4年MRI阅片经验)分别独立进行测量并记录各参数值。每位测量者每次扫描图像均测量2次,间隔至少2周。
4.统计学分析
使用SPSS 20.0统计学软件进行数据分析。测量者间及测量者不同时间测量值的一致性使用组内相关系数(intraclass coefficient,ICC)进行评价,ICC>0.75认为一致性较好。所有参数采用Kolmogorov-Smirnov正态分布检验,随后采用独立样本t检验(正态分布)或非参数检验(非正态分布)比较各参数值在良恶性肺部病灶间的差异。通过ROC曲线分析,获得鉴别良恶性肺结节/肿块的最佳参数和最佳阈值。
结 果
1.病理结果
32例中良性病变11例,其中硬化性肺细胞瘤4例、肉芽肿性炎3例、结核和局灶性炎症各2例;恶性病变21例,其中腺癌16例、鳞癌3例、小细胞癌2例。良性组中患者平均年龄为(59.6±9.7)岁,恶性组为(59.2±13.5)岁,组间差异无统计学意义(t=0.077,P=0.939);良性组中病灶直径为(2.15±0.42) mm,恶性组为(2.34±0.29) mm,组间差异无统计学意义(t=-1.525,P=0.138)。良性组中位于右肺上叶、中叶和下叶及/左肺上叶、下叶的病灶数分别为1、2、3、3和2个,恶性组中相应部位的病灶数分别为7、2、6、2和4个。
2.各参数值在测量者间的一致性
除了D*值(ICC=0.716),其它参数的测量值(ADCmean、ADCmin、D、D*、f和 LSR800)显示出较好的测量者间一致性(ICC分别为0.848、0.936、0.824、0.939、0.710和0.870)。
3.各参数值在良恶性肺部肿块间的差异
恶性肺结节的ADCmean显著低于良性肺结节,差异有统计学意义(t= 2.749,P= 0.010);而LSR800、ADCmin、D及f值在良恶性肺结节间的差异无统计学意义(图1~2)。相关测量值及统计分析结果见表2。
4.ADC均值诊断良恶性肺结节的效能
ROC曲线分析结果显示,ADCmean诊断良恶性肺结节的曲线下面积(area under ROC curve,AUC)为0.788(图3),以1.44×10-3mm2/s为临界值,诊断恶性肺结节的敏感度为81.0%、特异度为72.7%。

图2 右肺上叶腺癌。a) CT显示右肺上叶小结节,可见分叶和毛刺(箭); b) DWI图像(b=800s/mm2),显示病灶呈高信号(箭),LSR800=0.720; c) ADC图像,显示病灶呈低信号(箭); d) IVIM生成的NLLS曲线图,曲线的拟合度较好; e) D值图像,显示病灶呈等信号(箭); f) D*值图像,显示病灶呈低信号(箭); g) f值图像,显示病灶呈高信号(箭); h) 病理片镜下示瘤细胞异形性明显,呈片状、条索状分布,部分区域可见残留腺管样结构(×100,HE)。图3 ADCmean诊断肺良恶性肺结节的ROC曲线,曲线下面积为0.788。
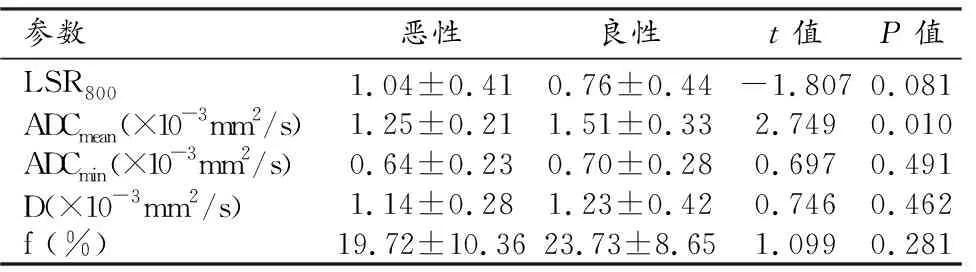
表2 良恶性肺结节各参数测量值及统计分析结果
讨 论
1.ADC值
由于恶性肿瘤细胞密度高,水分子扩散受限,在DWI图像上表现为高信号,ADC图上呈低信号;而良性病灶的ADC值明显高于恶性肿瘤,在ADC图上多表现为相对高信号[4,15]。目前大多数研究中选择的是病灶的ADC均值进行分析,且良恶性病灶的ADC值差异已被较多研究所证实,相关的Meta分析亦显示这些研究结果间的一致性[2,4,6,16]。本研究结果与文献报道基本一致,证实了ADC均值可作为预测肺结节良恶性的有价值的生物学指标。本研究中对病灶的分析采用的是单层面ROI勾画法,也有研究者认为容积ROI法所测量的ADC值诊断准确性更高[9]。但本研究中考虑到对于较小的肺结节,所包含的层数较少,而病灶的边缘层面受部分容积效应的影响较大,故采用的是单层ROI勾画法。未来需要进一步比较不同ROI画法所得的ADC值对肺结节诊断效能的差异。
2.ADC最小值
有研究者者认为,ADCmin比ADCmean更能代表病灶内水分子扩散受限的程度,且其研究结果显示恶性肺结节的ADCmin显著低于良性肺结节,而且ADCmin的诊断效能高于PET[4,17]。但目前尚未有研究者对ADCmean和ADCmin在鉴别良恶性肺结节中的诊断价值进行对比分析。本研究结果显示,ADCmin在良恶性肺结节间的差异并无统计学意义。笔者分析认为,可能的原因是本研究中患者的肺结节直径均小于3 cm,而ADCmin是个极值,容易受到测量误差的影响。
3.LSR
本研究结果显示,尽管恶性肺结节的病灶与脊髓信号的比值(LSR)有高于良性肺结节的趋势,但LSR在良恶性肺结节的鉴别诊断方面并未显示出明显的诊断优势,与相关研究结果较为不一致[8,18,19]。但这些研究中均未根据病灶的大小进行分组。笔者认为,较小的肺结节,病灶内往往不同程度地混入了空气,且测量时受容积效应的影响较大[8];此外,DWI信号还与病灶的病理类型、分化程度及肿瘤分期等因素有关。因此,对于较小的肺结节,LSR的诊断价值有待商榷。
4.IVIM参数值
IVIM是采用双指数模型将水分子扩散和微循环灌注效应区分开,可获得纯扩散参数D及灌注参数D*和f。理论上,D值比ADC值更能反映水分子的扩散运动状况。Yuan等[6]和Wan等[7]研究也证实,D值的诊断价值高于ADC值。但也有研究结果显示IVIM参数值在肺病灶良恶性鉴别方面价值不大[8],与本研究结果较为一致。可能的原因是肺部MRI检查容易受到磁敏感效应以及心跳、呼吸等运动伪影的影响,图像信噪比较低;其次是由于IVIM扫描时间偏长,容易因呼吸运动的影响,病灶的位置发生错配,从而影响病灶的信号及IVIM曲线的拟合,最终引起IVIM参数值的变化,而这种误差在较小的肺结节中尤为明显[12]。有多项研究结果显示,对于<3 cm的肺结节,ADC值及IVIM参数值的可重复性相对较差[12,20]。因此,未来需要改进IVIM扫描及后处理策略,提高IVIM对肺部小病灶的诊断能力。
5.本研究的局限性
本研究存在一定的局限性:①样本量偏少,还需要进一步增大样本量进行更深入的研究;②由于设备和扫描时间的限制,选取的b值的数量偏少;③未纳入小于1.5 cm的病灶,是考虑到小于1.5 cm的病灶信噪比较低[11];④仅仅比较了病灶的良恶性,未对病灶的病理类型、分化程度和生物学行为等进行进一步比较。