纤连蛋白在乳腺病变的组织表达差异及与病灶弹性模量的相关性
李亚帅,王知力,李晔,何艳
1.解放军总医院超声诊断科,北京 100853;2.解放军八九医院,山东潍坊 261041;
乳腺癌居女性恶性肿瘤的首位,2012年全球约170万新发病例,而乳腺良性肿瘤的检出率也随着诊断和治疗方法的进步逐年上升[1]。近年来,关于乳腺病变细胞外微环境的研究逐渐深入,细胞外基质对于乳腺癌的发生、发展、侵袭、转移的作用机制逐渐清晰,本课题组前期研究结果显示,细胞外基质中胶原纤维的变化与剪切波弹性模量值相关[2]。纤连蛋白(fibronectin,FN)是一种糖蛋白,由肿瘤相关性成纤维细胞和肿瘤细胞分泌。乳腺癌患者中,FN蛋白含量增高者,病灶表现出更多的转移特性[3]。而FN蛋白既可以分布在细胞外基质,也可以分布于肿瘤细胞内,FN蛋白在不同组织中表达的差异可能会对乳腺病变产生不同的作用,但FN蛋白的表达是否影响肿瘤弹性变化尚不清楚。本研究拟探讨乳腺病变不同组织中FN蛋白的表达差异以及与病灶弹性模量值的相关性,为深入研究乳腺病变中FN蛋白的作用途径奠定基础。
1 资料与方法
1.1 研究对象 回顾性分析 2014年 5月-2015年12月解放军总医院超声诊断科符合以下标准的患者资料,纳入标准:①行乳腺切除术或真空辅助旋切活检,经病理确诊为乳腺癌或乳腺良性肿瘤的女性患者;②活检前进行剪切波弹性成像检查。排除标准:①有其他器官肿瘤病史;②患者确诊前1年内参加过药物试验或长期进行激素替代治疗。120例患者纳入研究,其中恶性组及良性组各60例。
1.2 剪切波弹性成像超声检查方法 采用法国Super Sonic Imagine公司AixPlorer实时剪切波弹性成像超声诊断仪,探头频率为4~15 MHz。首先对拟手术或真空辅助旋切活检的病灶行常规超声检查,然后切换至弹性成像模式,待图像稳定后,定帧,存图。使用Q-Lab软件选取感兴趣区测量弹性值。选取感兴趣区时,因仪器的测量取样框默认为圆形,取尽可能覆盖病灶大小的取样框面积。同一病灶采用不同的方向重复5次定位,测量,得到弹性模量值最大方向的5组数据,每组数据均包括病灶弹性模量值的最大值(Emax)、最小值(Emin)、平均值(Emean)和周围组织弹性模量比值(Ratio)。记录数值并计算这4组数据的平均值,记录数据并储存。
1.3 FN检测 采用免疫组化法检测FN。免疫组化染色结果通过图像分析仪处理,每张切片任意采集10个高倍视野进行测定,≥10%的细胞染色认为FN阳性,反之为阴性。
1.4 统计学方法 采用SPSS 16.0软件,两组病灶不同组织间 FN染色结果的比较使用χ2检验或Fisher确切概率法,两组病灶弹性模量值比较采用成组资料t检验,FN的表达与各弹性模量值的相关性采用 Pearson相关分析,P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果和临床特征 良性组中,纤维腺瘤41例,乳腺腺病13例,硬化性腺病6例;恶性组中,浸润导管癌52例,原位导管癌7例,浸润小叶癌1例。良性组<50岁47例,≥50岁13例;恶性组<50岁35例,≥50岁 25例,两组患者年龄分布差异有统计学意义(P<0.05)。
2.2 病灶特征 良性组 22例病灶长径≤20 mm,38例>20 mm;恶性组 17例病灶长径≤20 mm,43例>20 mm,差异无统计学意义(P>0.05)。良性组2例病灶为极低回声,46例为低回声,12例为等回声;恶性组16例为极低回声,44例为低回声,回声特征差异有统计学意义(P<0.05)。
2.3 FN在肿瘤细胞外基质和细胞内分布的比较 恶性组60例在细胞外基质中FN均呈阳性,而良性组病灶细胞外基质中27例阴性,两组间在细胞外基质中FN表达差异有统计学意义,而肿瘤细胞中FN表达差异无统计学意义(表1,图1)。
2.4 弹性模量值的比较 恶性组 Emax、Emean与Ratio均大于良性组,差异有统计学意义;而Emin差异无统计学意义(P>0.05)(表2)。细胞外基质中FN的表达与各弹性模量值无显著相关性(P>0.05)。
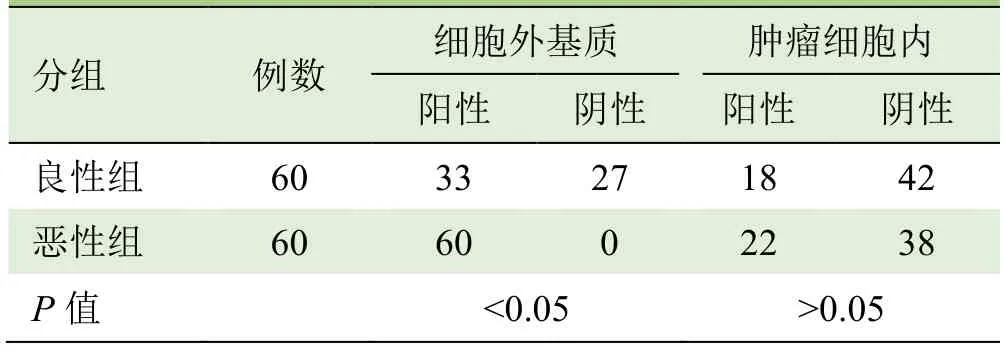
表1 良性组和恶性组乳腺病变患者细胞外基质和肿瘤细胞内FN染色结果比较(例)
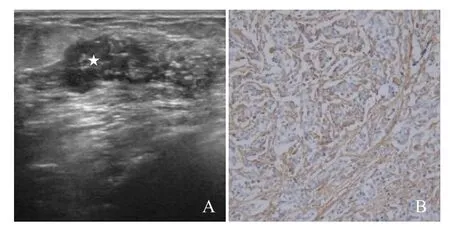
图1 女,48岁,乳腺浸润性导管癌。灰阶超声示左侧乳腺外上象限低回声占位(星号,A);免疫组化染色示FN呈阳性(×400,B)
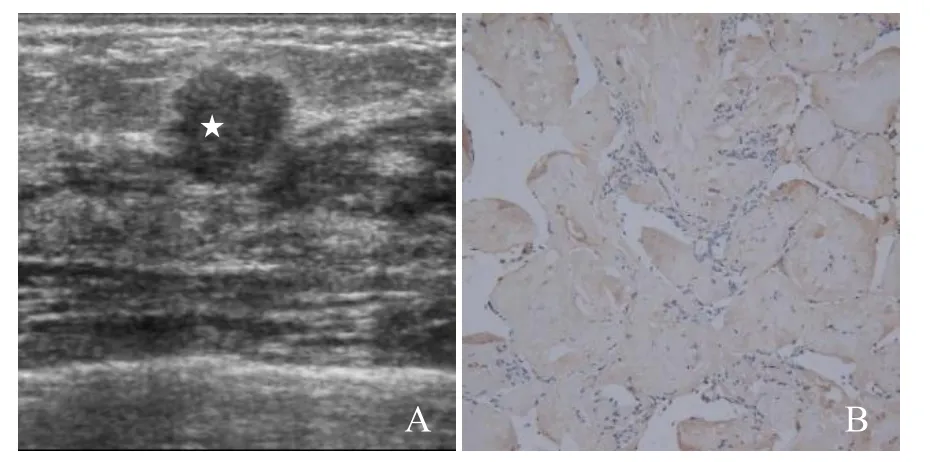
图2 女,38岁,乳腺纤维腺瘤。灰阶超声示左侧乳腺外上象限低回声结节(星号,A);免疫组化染色示 FN呈阴性(×200,B)
表2 良性组和恶性组乳腺病变患者弹性模量比较结果( ±s)

表2 良性组和恶性组乳腺病变患者弹性模量比较结果( ±s)
注:Emax:弹性模量值的最大值;Emin:弹性模量值的最小值;Emean:弹性模量值的平均值;Ratio:周围组织弹性模量比值
分组良性组恶性组例数60 60 Emax(kPa)69.5±15.7 118.3±24.4弹性特征Emean(kPa)40.4±10.3 45.2±12.5 Emin(kPa)24.4±8.7 26.3±8.5 Ratio 3.1±0.9 3.5±1.1 t值P值13.015<0.01 2.305<0.05 0.877 0.384 2.198<0.05
3 讨论
乳腺癌是女性最常见的恶性肿瘤,是导致女性癌症相关死亡的最主要原因[4]。肿瘤细胞外基质成分对肿瘤的发生、发展、侵袭、转移起到重要的调控作用,细胞外基质各成分的分泌、沉积和调控机制等研究备受关注[5]。本课题组的前期研究结果显示,肿瘤发生过程中伴随着胶原交联,肿瘤的硬度不断增加,而细胞外基质的含量变化与肿瘤硬度有直接关系[2]。细胞外基质中FN表达与乳腺癌具有相关性,有助于乳腺癌生物学行为的机制研究。
FN蛋白是一种糖蛋白,由肿瘤相关性成纤维细胞和肿瘤细胞分泌。FN蛋白的沉积可以刺激乳腺癌细胞结合胰岛素样生长因子结合蛋白-3(IGFBP-3)和表皮生长因子(EGF)。当 FN含量增加时,IGFBP-3和EGF可促进乳腺癌细胞增殖;反之,FN缺失时,乳腺癌细胞增殖受到抑制[6]。本研究中,FN沉积仅在细胞外基质中有差异,而且所有恶性肿瘤均可见FN在细胞外基质中沉积,因此,调控肿瘤细胞生物学行为的路径更可能作用于细胞外基质中的FN。
准确的诊断对于乳腺癌的治疗极为重要。剪切波弹性成像是近年来发展的一项评价组织硬度和黏弹性指数的新型诊断方法[7],利用超声探头发射实时声波,而不是靠检查者施加外力,使组织产生相应的位移并通过记录该变化反映不同组织的硬度。实时剪切波弹性成像技术可以实时定量评估组织硬度和黏弹性,敏感地识别组织的硬度变化,从而鉴别病变的良恶性[8]。一项针对 1951例患者 2050处乳腺肿瘤的Meta分析发现,灰阶超声结合弹性成像可以显著提高乳腺癌的诊断效能[9],与近年来针对乳腺[10-11]、前列腺[12]等疾病的诊断性研究相似,良性组弹性模量特征与恶性组具有差异,Emax、Emean及Ratio在恶性组中均明显增高。
既往研究显示,细胞外基质成分的硬度比肿瘤细胞的硬度高一个甚至几个数量级,肿瘤细胞的硬度比周围正常细胞的硬度小,而且侵袭性越强的肿瘤细胞,其硬度越小[13-14]。因此,恶性肿瘤剪切波弹性模量值增加部分应来源于细胞外基质,而基质中各成分的沉积与结构改变,可能是引起乳腺癌弹性模量值增高的重要因素[15-16]。然而本研究发现,FN是否在细胞外基质中表达并不能直接影响肿瘤的硬度,认为乳腺肿瘤的细胞外基质中,FN绝对含量仍然很小,不足以影响肿瘤组织的整体硬度,但是FN含量的微小变化即可对肿瘤组织的生物学行为形成极大的影响。
本研究是针对乳腺肿瘤FN的基础性研究,两组患者年龄等特征均存在差异,因此,两组间比较可能存在一定的偏倚。细胞外基质中的FN表达在良、恶性乳腺肿瘤中存在差异,而且所有乳腺癌细胞外基质中均有FN沉积,细胞外基质中的FN表达研究对于肿瘤生物学行为调控机制的研究具有较大的研究意义。

