3种方法检测食品中单增李斯特菌能力验证结果分析
丁秀琼 杨 劲 刘 骁 郑俏慧 林锏锐 庞晓林
湛江出入境检验检疫局检验检疫技术中心 广东湛江 524000
1前言
实验室能力验证是指利用实验室间比对,按照预先指定的准则评价参加者的能力[1]。中国合格评定国家认可委员会(CNAS)将能力验证作为评价实验室技术能力的重要手段之一,与现场评审构成了互为补充的2种能力评价技术[2]。能力验证作为重要的外部质量评价活动,寻求并参加能力验证是每个合格评定机构的责任和义务[1]。实验室将能力验证用作有效的外部质量保证活动,并将其作为内部质量控制程序的补充,持续监控实验室检测能力。
单核细胞增生李斯特菌,简称单增李斯特菌,属于革兰氏阳性菌,是最常见的人畜共患型食源性致病菌之一[3]。人类感染后可导致肠胃炎、败血症、脑膜炎、流产等,尤其是孕妇、婴幼儿、老年人及免疫力低下者更易感染[4]。单增李斯特菌广泛存在于各类乳制品、蔬菜、肉类等食品中,对人的健康造成了极大的威胁。我国食品安全国家致病菌限量标准中规定熟肉制品及即时生肉制品中不得检出单增李斯特菌[5],世界各国及地区也制定了相应的限量标准和食品法规[6]。食品中单增李斯特氏菌的检测技术则成为食源性疾病预防与控制的关键。为了正确评价并提高实验室的检测能力和技术水平,湛江出入境检验检疫局技术中心食品实验室2017年参加了由国家质量监督检验检疫总局水产品检测重点实验室(广州)组织的水产品中单增李斯特菌检测比对试验,2018年参加了由中国检验检疫科学研究院测试评价中心组织的食品中单增李斯特菌检测能力验证,采用国标法、mini VIDAS、实时荧光PCR 3种方法对测试样品进行检测,综合分析,取得满意结果。现对3种方法检测单增李斯特菌的结果进行分析总结。
2 材料与方法
2.1 材料
2.1.1 主要培养基和试剂
李氏增菌肉汤 LB(LB1、LB2)培养基基础及添加剂、FraserⅠ和FraserⅡ增菌液培养基、PALCAM琼脂培养基基础及添加剂、李斯特菌显色培养基、含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)、半固体动力培养基、革兰氏染液、木糖、鼠李糖、血平板均购自广州陆桥检测技术有限公司;单增李斯特菌酶联免疫检测试剂盒和VITEK 2格兰氏阳性菌鉴定卡,法国生物梅里埃公司生产;单增李斯特菌核酸检测试剂盒(荧光PCR法),深圳生科原生物股份有限公司生产。
2.1.2 主要仪器设备
HFsafe-1500 LC型生物安全柜(上海力申科学仪器有限公司);GHP—9160型隔水式恒温培养箱(上海一恒科学仪器有限公司);GR110DR型立式高压蒸汽灭菌器(美国ZEALWA)Y;DM4B型 leica数字显微镜(徠卡显微系统(上海)贸易有限公司广州分公司)。Mini VIDAS全自动荧光免疫分析仪、VITEK2 Compact全自动微生物鉴定/药敏分析系统(法国生物梅里埃公司);ABIQ6荧光PCR仪(life technologiesTM)。
2.1.3 试验样品
2017年水产品中单增李斯特氏菌检测比对试验样品3个,样品标识分别为:PT64、PT83、PT173;ACAS-PT525(2018)食品中单核细胞增生李斯特菌检测微生物能力验证样品2个,样品标识分别为18-M697和 18-H655。
2.1.4 试验用标准菌株对照
单核细胞增生李斯特菌 (L.monocytogenes),ATCC19111;英诺克李斯特菌(L.innocua),ATCC33 090。
2.2 方法
2.2.1 国标方法
按照组织方提供的《参试指导书》进行水化,振摇充分混匀,全部样品混悬液作为一个整体样品,按照GB4789.30-2016《食品微生物学检验 单核细胞增生李斯特氏菌检验》[7]进行增菌、分离、初筛及鉴定。检验过程中设置阳性及阴性菌株对照。
2.2.2 mini VIDAS全自动荧光免疫分析仪
参照GB/T 22429-2008 《食品中沙门氏菌、肠出血性大肠埃希氏菌O157及单核细胞增生李斯特氏菌的快速筛选检验 酶联免疫法》[8],从样品FB1增菌液中取1 mL加到9 mL FB2增菌液中进行增菌培养。移取1 mL FB2增菌液加入到小试管中,置沸水浴中加热15 min,吸取灭活的增菌液 0.5 mL,加入试剂条中,按照仪器使用规程及试剂盒说明书进行上机操作和判读结果。检测过程中按要求设置试剂盒质量控制。
2.2.3 实时荧光PCR方法
按照SN/T 1870-2016《出口食品中食源性致病菌检测方法 实时荧光PCR法》[9]进行样品制备、增菌培养。取1mL李氏增菌肉汤(LB2)加到1.5 mL无菌离心管中,按照检测试剂盒说明书进行模板DNA制备,然后按照仪器使用规程及试剂盒说明书进行上机操作和判读结果。检测过程中按标准要求分别设置阳性对照和空白对照。
3 结果与分析
3.1 国标法
5个样品中的国标法检测结果与指定值一致,结果详见表1。

表1 国标法检测结果
由表1可见,单增李斯特菌和英诺克李斯特菌在PALCAM平板上的菌落特征基本相同,在李斯特显色平板上菌落特征有不同,前者有模糊圈,后者无。单增李斯特菌和伊氏李斯特菌在PALCAM平板上的菌落特征不同,可以区分,但在李斯特显色平板上菌落特征一样。在两种平板质量达到要求的前提下,两种平板结合是可以区分这几种李斯特菌的。单增李斯特菌和英诺克李斯特菌木糖、鼠李糖生化反应结果相同,单增李斯特菌和伊氏李斯特菌(L.ivanovii)木糖、鼠李糖生化反应结果不同。全自动微生物鉴定系统(VITEK2)有时不能区分单增李斯特菌和英诺克李斯特菌。本研究中,样品18-M697鉴定显示为极好的鉴定,生物编号142200224733621,结果为99%L.innocua。样品18-H655的鉴定结果显示为低分辨率,不能区分单增李斯特菌和英诺克李斯特菌,人工选择结果为99%L.monocytogenes,生物编号142200224733621,和判定为英诺克李斯特菌的菌株有同样的生物编号。单增李斯特菌、英诺克李斯特菌和伊氏李斯特菌在血平板上有不同的溶血反应,可以很好的区分。综合平板菌落特征、生化鉴定和溶血试验判定结果。
3.2 mini VIDAS全自动荧光免疫分析仪
5个样品中的mini VIDAS检测结果与指定值一致,结果见表2。
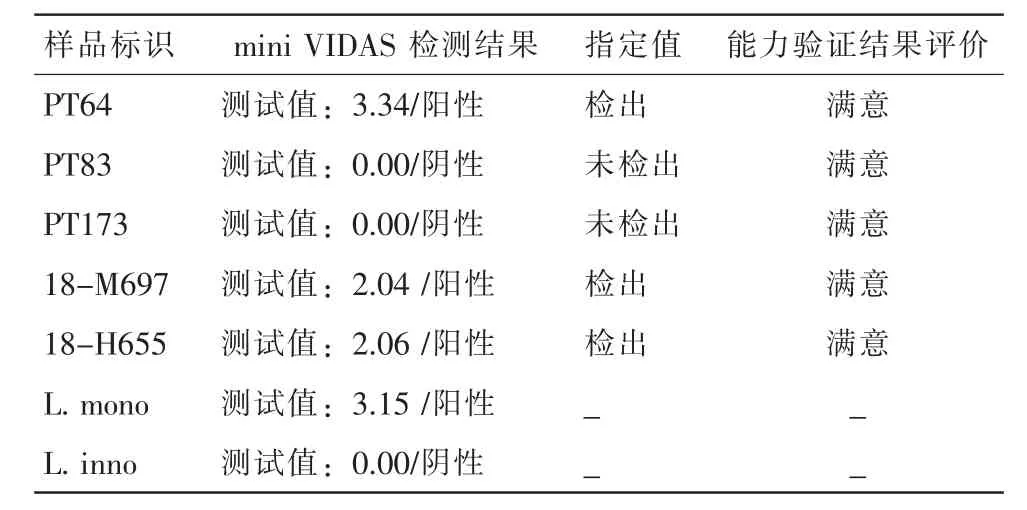
表2 mini VIDAS检测结果
由表2可见,单增李斯特菌酶联免疫检测试剂盒能快速准确地对单增李斯特菌进行初筛。mini VIDAS检测的特点是只要增菌液存在目标菌,不需纯培养即可检出,但无法判断目标菌的死活,阳性结果需按国标法进一步确证,并报告结果。
3.3 实时荧光PCR方法
5个样品的荧光PCR检测结果与指定值一致,结果见表3、图1、图2。
由表3可见,单增李斯特菌核酸检测试剂盒(荧光PCR法)能快速准确地对单增李斯特菌进行初筛。实时荧光PCR检测的特点是灵敏度高,特异性好,快速高通量,是很好的食源性病原菌初筛方法。若选择增菌肉汤进行初筛,24 h内可以有初筛结果;若选择平板分离得到的菌落进行检测,72 h内可以得到比较准确的检测结果。
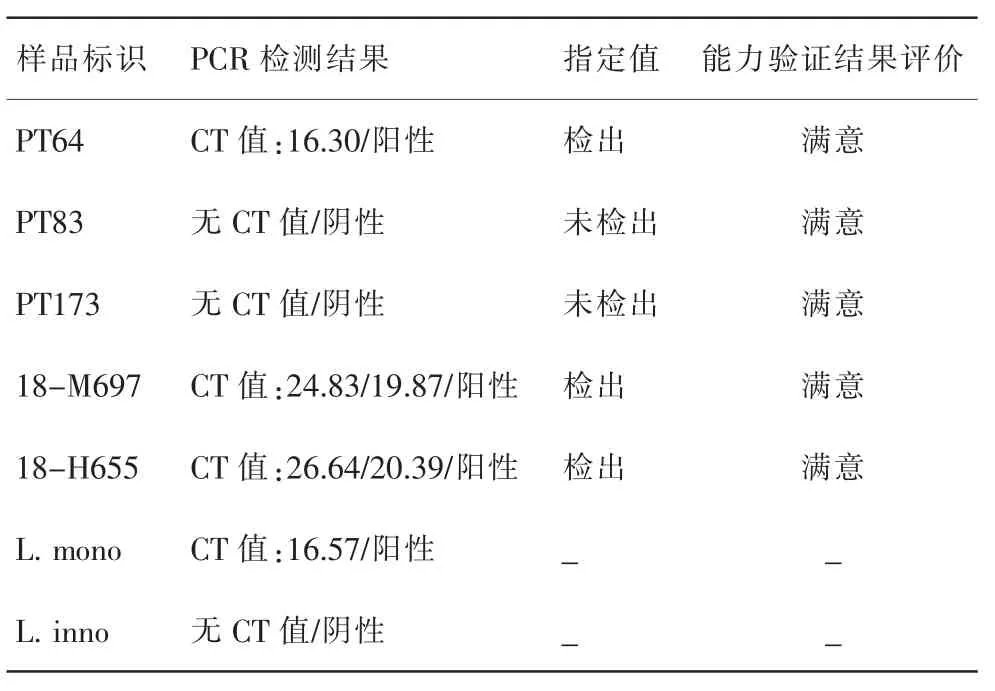
表3 PCR检测结果汇总表
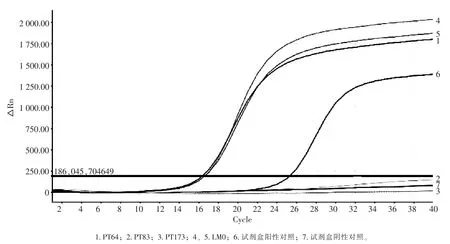
图1 单增李斯特比对试验荧光PCR检测结果
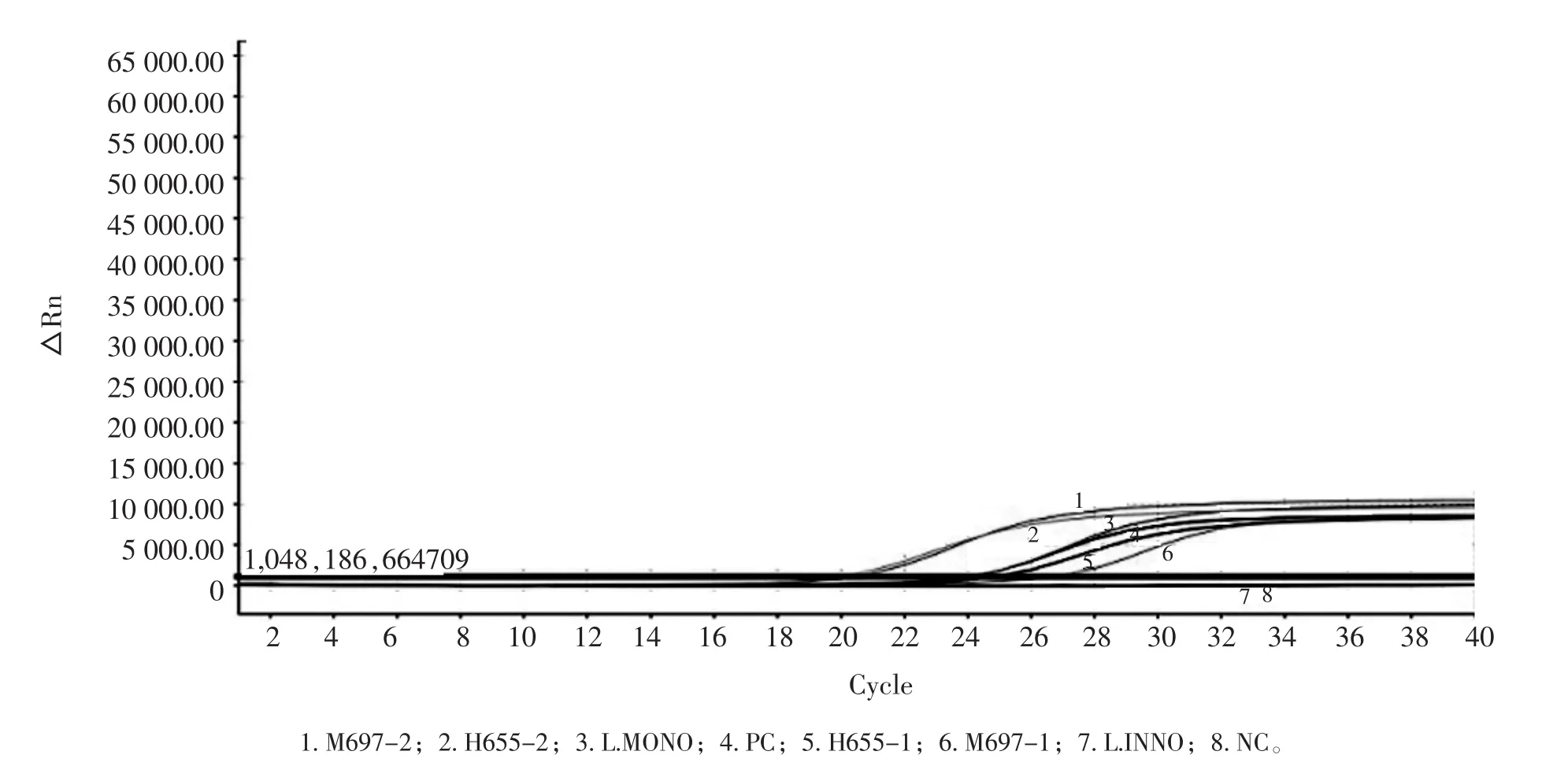
图2 单增李斯特菌能力验证荧光PCR检测结果
4 结论
能力验证结果分析表明,国标法是经典的检测方法,但检测周期长,过程复杂,对检验人员的检测技术要求高。全自动荧光酶联免疫法和实时荧光PCR法检测都具有简单快速、检测限低、灵敏度高、特异性好及不需纯培养即可检出等特点,是很好的初筛方法,但不排除存在死菌等其他原因造成的假阳性结果,有时也会出现位于临界点不好判定的结果,需重做或经过国标法确证才能报告结果。在能力验证中,组织方都会添加一种甚至几种干扰菌,加大了检测难度[10]。用国标法检验,可能出现未挑中目标菌落或目标菌落生化反应不典型等情况,导致未检出,出现不满意结果。在实验室条件允许的情况下,3种方法有机结合,综合判断,可确保检测结果的准确性。

