香草兰豆荚发酵过程中挥发性成分的变化
,,,,*,, ,,,,,
(1.中国热带农业科学院香料饮料研究所,海南万宁 571533; 2.华中农业大学食品科学技术学院,湖北武汉 430070; 3.国家重要热带作物工程技术研究中心,海南万宁 571533; 4.海南省热带香料饮料作物工程技术研究中心,海南万宁 571533)
香草兰,又名香荚兰,多年生、半附生多汁草本植物,喜炎热潮湿气候[1-2]。公元1500年,墨西哥土著居民将其用于饮品增香,后被西班牙人传入欧洲,十九世纪传入亚洲和非洲等热带、亚热带地区[3-4]。香草兰鲜荚经过发酵(包括杀青、发汗、干燥、陈化)过程,产生独特的芳香气味。目前在不同产地、不同品种的香草兰豆荚中的所鉴定出的挥发性物质已超过460种,包括醛类、酚类、芳香酯、脂肪酸、酮类等[5-8]。其中醛类如香草醛、对羟基苯甲醛等物质含量较高,对香味的贡献也较大,但香草兰豆荚浓郁独特的香气并非由这两种物质决定,一些含量低的物质对香草兰的整体香气也有重要的影响[9]。Pe’rez-Silva等[10]通过GC-olfactometry(GC-O)在成品香草兰豆荚中检测到了26种香气活性成分,其中21种物质的含量低于20 mg/kg。在之前的研究中已经发现,将不同阶段的香草兰豆荚中香兰素补偿到同一水平后进行电子鼻和电子舌分析,结果显示几种豆荚的风味不同[11]。因此,进行香草兰发酵过程中挥发性物质的定量分析,有助于对影响香草兰香气的关键因素的研究。
在对挥发性成分的鉴定分析研究中,主要有顶空固相微萃(Headspace solid-phase microextraction,HS-SPME)、溶剂萃取及同时蒸馏萃取(simultaneous distillation extraction,SDE)等方法,结合GC-MS进行[10,12-17]。Tomislav等[14]采用HS-SPME-GC-MS方法应用于香草兰挥发性成分的提取鉴定,并对萃取条件进行了优化;Sabik Hassan等[15]采用不同的固相微萃取头提取,研究得出可用于香草兰挥发性成分半定量的HS-SPME-GC-MS方法,并鉴定出81种挥发性成分。Pe’rez-Silva等[10]分析比较了不同溶剂提取的香草兰豆荚香气成分,发现以戊烷和乙醚的混合溶液提取效果最佳,GC-MS和GC-olfactometry(GC-O)分析鉴定出65种香气成分。Zhang等[16]以二氯甲烷为溶剂提取香草兰豆荚,鉴定出78种香气成分。Brunschwig等[17]采用微型同时蒸馏萃取法对三个不同品种的香草兰豆荚中挥发性成分进行提取,鉴定出38种挥发性成分。SPME方法具有快速、稳定、无需溶剂等优点,对痕量物质的鉴定稳定,此外由于香草兰豆荚香气成分复杂,萃取头难以较彻底的提取。SDE具有节省溶剂、回收率高等优点,但此方法操作温度较高,挥发性成分损失较大。
因此,本文戊烷和乙醚为混合溶剂提取,提取前采用液氮对样品进行速冻,并用冰浴保持提取过程中的低温环境,来减少挥发性成分的损失。内标法结合GC-MS对香草兰发酵过程中挥发性物质的含量进行定量分析,确定香气成分的富集过程。
1 材料与方法
1.1 材料与仪器
香草兰豆荚 11月份采收于中国热带农业科学院香料饮料研究所香草兰种植基地,长约9~15 cm,呈两侧弯曲的圆柱形,豆荚饱满;C8~C30正构烷烃(标准品) 美国o2si公司;正己醇(分析标准品) 上海阿拉丁生化科技股份有限公司;所有提取用有机溶剂 均为国产分析纯。
Aglient-7890A/5975气相色谱-质谱联用仪 美国安捷伦科技有限公司;R-215旋转蒸发仪 瑞士步琪实验设备公司;WD-12氮吹仪 杭州奥盛仪器有限公司;FJ200-S高速均质分散机 上海标本模型厂;18ND真空冷冻干燥机 宁波新芝生物科技控股有限公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 香草兰豆荚的发酵 豆荚加工方法为单元式热空气发酵法[18-19]。取约500 g完好的香草兰鲜豆荚(Fresh vanilla beans,FVB)放于70 ℃水浴中3~5 min进行杀青,沥干表面水分后以干净的毛巾包裹,取样标记为杀青豆荚(Blanched vanilla beans,BVB)。每天放在55 ℃恒温培养箱中发汗5 h,重复发汗5 d,得到发汗豆荚(Sweated vanilla beans,SVB)。收取黑褐色、柔软的豆荚放在晾干架上晾干,直至豆荚水分含量降低到30%左右,干燥结束,取样并标记为干燥豆荚(Dried vanilla beans,DVB)。将干燥好的豆荚真空包装,放在阴凉干燥处陈化约6个月,豆荚发酵完成,得到陈化豆荚(Cured vanilla beans,CVB)。取上述5个阶段的豆荚进行真空冷冻干燥,干燥后的豆荚在液氮的保护下研磨成粉,于-80 ℃冰箱中保存。
1.2.2 挥发性成分的提取 根据Pe’rez-Silva[10]等的方法调整后进行:分别称取1.2.1中得到的豆荚粉于150 mL圆底烧瓶中,在圆底烧瓶中加入10 mL超纯水、80 mL乙醚-正戊烷(1∶1,v/v)混合溶剂,准确加入82 μg的正己醇作为内标。在冰浴条件下用高速均质分散机搅拌10 min混匀,取上层有机层加入无水硫酸钠除水后经旋转蒸发仪在30 ℃下浓缩至约10 mL,再以氮吹仪浓缩至1 mL,过0.22 μm滤膜进行GC-MS分析。分析前待测样品储藏于-20 ℃冰箱,每个样品重复提取两次。
1.2.3 GC-MS分析 安捷伦7890A气相色谱仪结合安捷伦5975c四极杆质谱仪进行分析。方法A[10]:以DB-Wax熔融石英毛细管柱(30 m×0.25 mm,0.25 μm)为分离柱,载气(He)流速1 mL/min,进样量1 μL,电子冲击能量70 eV。离子源温度230 ℃,四极杆温度150 ℃,进样器及检测器温度为250 ℃。升温程序:40 ℃保持3 min,然后以3 ℃/min升温至245 ℃,保持5 min。质量扫描范围m/z 40~600。方法B[20]:以DB-5毛细管柱(30 m×0.25 mm,0.25 mm)为分离柱,载气(He)流速1 mL/min,进样量为1 μL,离子源温度230 ℃,接口温度280 ℃,四级杆温度150 ℃。升温程序:40 ℃保持2 min,以1.5 ℃/min升温至65 ℃,保持2 min,以0.5 ℃/min升温至70 ℃,再以5 ℃/mi 升温到90 ℃,再以3 ℃/min升温至170 ℃,最后以4 ℃/min升温到280 ℃并保持2 min。质量扫描范围m/z 30~300。两种方法均为不分流进样。
1.2.4 定性定量分析 定性:分别以两种色谱柱为分离柱进C8~C30正构烷烃标准品,其他条件与进样品的条件保持一致。经仪器配置的NIST 14谱库检索,再计算保留指数(retention index,RI)并与文献报道的保留指数对比进行定性。根据各组分的峰面积与内标峰面积的对比进行定量。
1.3 数据统计分析
保留指数(RI)=100(N-1)+[lg(tN+1)-lgtN]/[lg(tN+1)- lg(tN-1)]×100
式中:N为待定性组分的碳原子数;N-1和N+1分别为待定性组分保留时间前后的正构烷烃碳原子数;t为保留时间。
2 结果与分析
2.1 两种方法鉴定结果比较分析
以DB-5毛细管柱为分离柱,气质联用检测出45种挥发性成分,其中鲜豆荚(FVB)、杀青豆荚(BVB)、发汗豆荚(SVB)、干燥豆荚(DVB)及陈化豆荚(CVB)分别有19、17、25、33、37种挥发性成分。以DB-Wax毛细管柱为分离柱,气质联用检测出53种物质,发酵不同阶段的五种豆荚中分别含有20、21、27、38、46种挥发性成分。两种方法共分离检测出69种物质。对比表1和表2可以看出,DB-Wax对大分子脂肪酸的分离优于DB-5,而DB-5对碳原子数低于20的烷烃的分离及定量更好。1-十九碳烯和1-十八碳烯2种烯烃及四甲基吡嗪、癸烷、十四烷、2,4-二叔丁基苯酚、异香兰素乙酮、8-甲基十七烷、2-甲氧基-4-丙基苯酚、4-羟基-3-甲氧基丁酰苯、丁基异丁基邻苯二甲酸酯、(S)(+)-Z-13-甲基-11-十五碳烯-1-醇乙酸酯共12种物质在发酵后豆荚(CVB)中被检测到,在其他相关研究中未见报道。
2.2 醛类物质分析
如表1和表2所示,反式-2-癸烯醛(33.52 mg/kg)只在发汗后的豆荚中出现,该结果在Pe’rez-Silva等[21]研究中也有出现,并推断其为脂肪酸的氧化而得,而高温可以促进脂肪酸的氧化,这可能是在发汗阶段产生反式-2-癸烯醛的一个原因,杀青阶段未检测到可能与水分活度有关,发酵后期可能受存储及发酵条件的影响而无法再检测到。香草醛、对羟基苯甲醛也被检测到,如表1和表2所示,香兰素和对羟基苯甲醛在发酵过程中逐渐累积,且在发汗阶段产生量较多。以DB-5为分离柱得到陈化豆荚中香兰素含量为15067.56 mg/kg,约为1.5%,而以DB-Wax为分离柱检测到的陈化豆荚香兰素含量为8131.45 mg/kg,约为0.8%。可以发现,DB-5对香兰素的分离能力较强。但其他以有机溶剂提取并通过HPLC定量的研究中香兰素含量多为2%~3%[10,19],可能受提取溶剂中水影响,使香兰素提取率降低。
2.3 酚类物质分析
DB-5和DB-Wax分别分离出6种和7种酚类物质,两种色谱柱对豆荚中酚类物质的分离效果相当(表1和表2)。根据Sharp等[22]、Brunschwig等[23]的报道,愈创木酚、4-乙烯基愈创木酚、对甲酚等酚类物质是V.planifolia和V.tahitensis两种香草兰起源的生物标志,因此酚类物质含量应该成为衡量香草兰豆荚质量的关键指标。与Brunschwig等[17]研究的几种香草兰豆荚比,本实验中的陈化豆荚所含苯酚含量(33.26 mg/kg)明显偏低(表2),4-乙烯基愈创木酚含量(20.30 mg/kg)与Parahurahu相近,愈创木酚含量(417.25 mg/kg)与几种豆荚均不相同。根据本实验的研究结果,酚类物质主要在干燥及陈化阶段产生,这两个阶段受气候条件影响较大[24],降雨量的增加会延长干燥时间导致挥发性成分的挥发,同时也可能导致霉菌的产生,影响豆荚菌群结构而影响发酵。
2.4 醇类物质分析
根据表1和表2的结果,以DB-5为分离柱共检测到2种醇类,而DB-Wax检测到8种醇类,可以得出,DB-Wax色谱柱对醇类物质的分离能力较强。如表2所示,在陈化豆荚中含量较高的醇是香兰醇,发汗阶段开始产生,干燥阶段含量明显增加,在陈化阶段含量下降,根据Palama等[25]的报道,香兰醇苷在发酵3~5个月内含量不变,5个月后含量增加,因此香兰醇不完全来自于糖苷的转化,还存在其他方式,而陈化阶段的含量下降可能是由于挥发损失或与糖苷的转化[1]。Pe’rez-Silva等[10]、Brunschwig等[17]通过GC-O分析香草兰发酵豆荚的结果显示,醇类物质中茴香醇、苯乙醇香味强度较高。其中茴香醇被发现呈八角味、甜香味,表2以DB-Wax检测到的茴香醇结果显示在鲜豆荚干基中含量为19.76 mg/kg,在之前的研究中发现鲜豆荚也有微弱的甜香味及花香味[11],茴香醇可能是其来源。杀青过程未检测到茴香醇,在发汗过程重新又检测到,表明在发汗过程中发生了茴香醇的生成反应,在干燥和陈化过程中含量逐渐增加。苯乙醇仅在陈化后的豆荚中检测到,呈花香味[17]。在Dignum等[9]对香草兰中葡萄糖苷酶的研究中发现,苯乙醇的糖苷并不是该酶的底物,生成方式还有待进一步研究。醇类物质的生成可能与醛、酮类物质催化氢化有关。
2.5 酮类物质分析
如表1和表2所示,两种色谱柱对酮类物质的分离能力相当。在香草兰豆荚的挥发性成分中,酮类物质报道较多的是香兰素乙酮,呈甜香味、蜂蜜味、香草兰味[10,15]。在以DB-5和DB-Wax为分离柱的检测结果中均未出现香兰素乙酮,但出现了同分异构体异香兰素乙酮,目前还未出现对该物质的报道,其生成途径和气味特性有待研究。Pe’rez-Silva等[21]的研究中,3-羟基2-丁酮的产生可能与一种杆菌如枯草芽孢杆菌有关,并且在发酵过程中含量呈现逐渐降低的趋势。在本实验中,3-羟基-2-丁酮在干燥阶段开始产生,且含量增加,陈化豆荚中达到566.50 mg/kg(干重),而在Brunschwig等[23]的研究中,五种香草兰品种中含量最高的达到951 mg/kg(干重),考虑香草兰品种不同的影响。Pe’rez-Silva等[10]以正戊烷和二氯甲烷为混合溶剂提取出的1-辛烯-3-酮,在本文中的两种方法均未检测到,可以排除分离柱极性的原因。
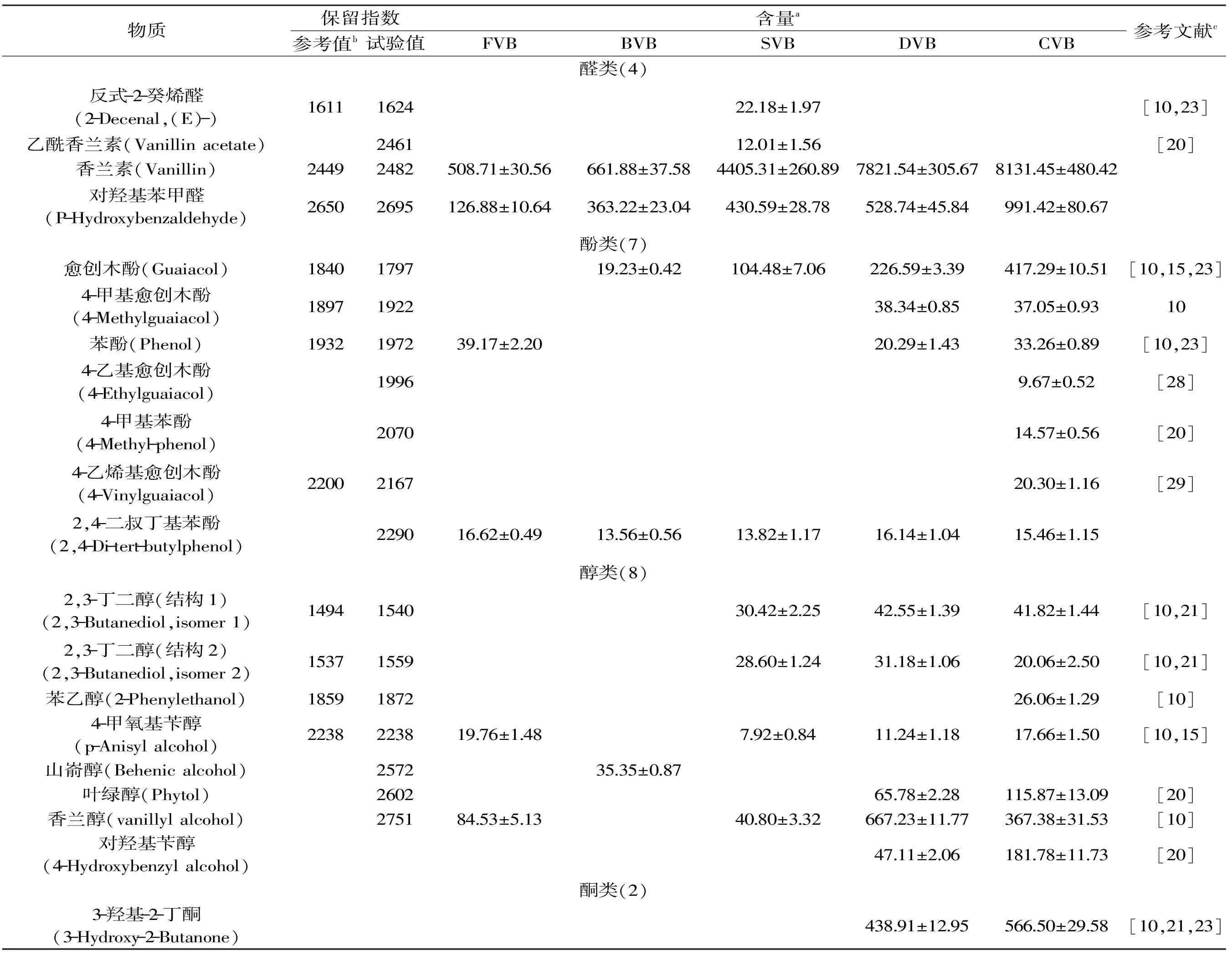
表2 以DB-Wax为分离柱检测到的香草兰发酵不同阶段的挥发性成分Table 2 Aroma compounds identified in vanilla beans in different curing stages by DB-Wax
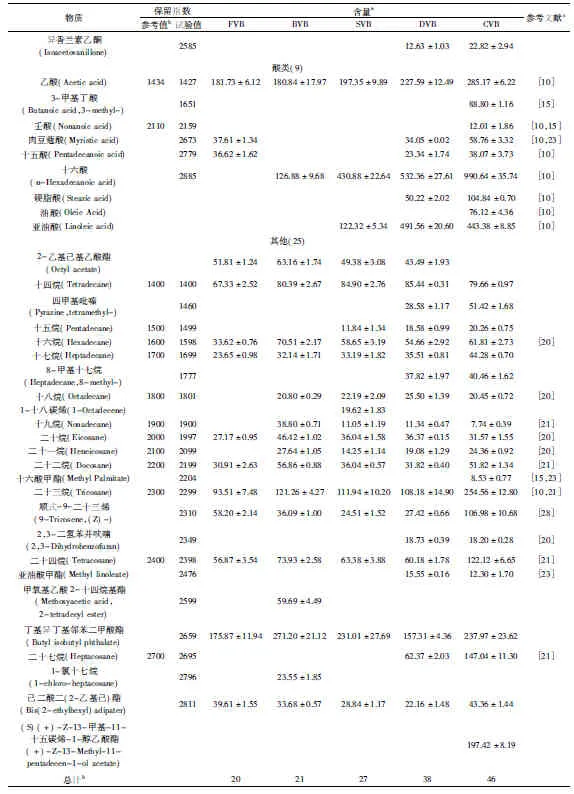
续表
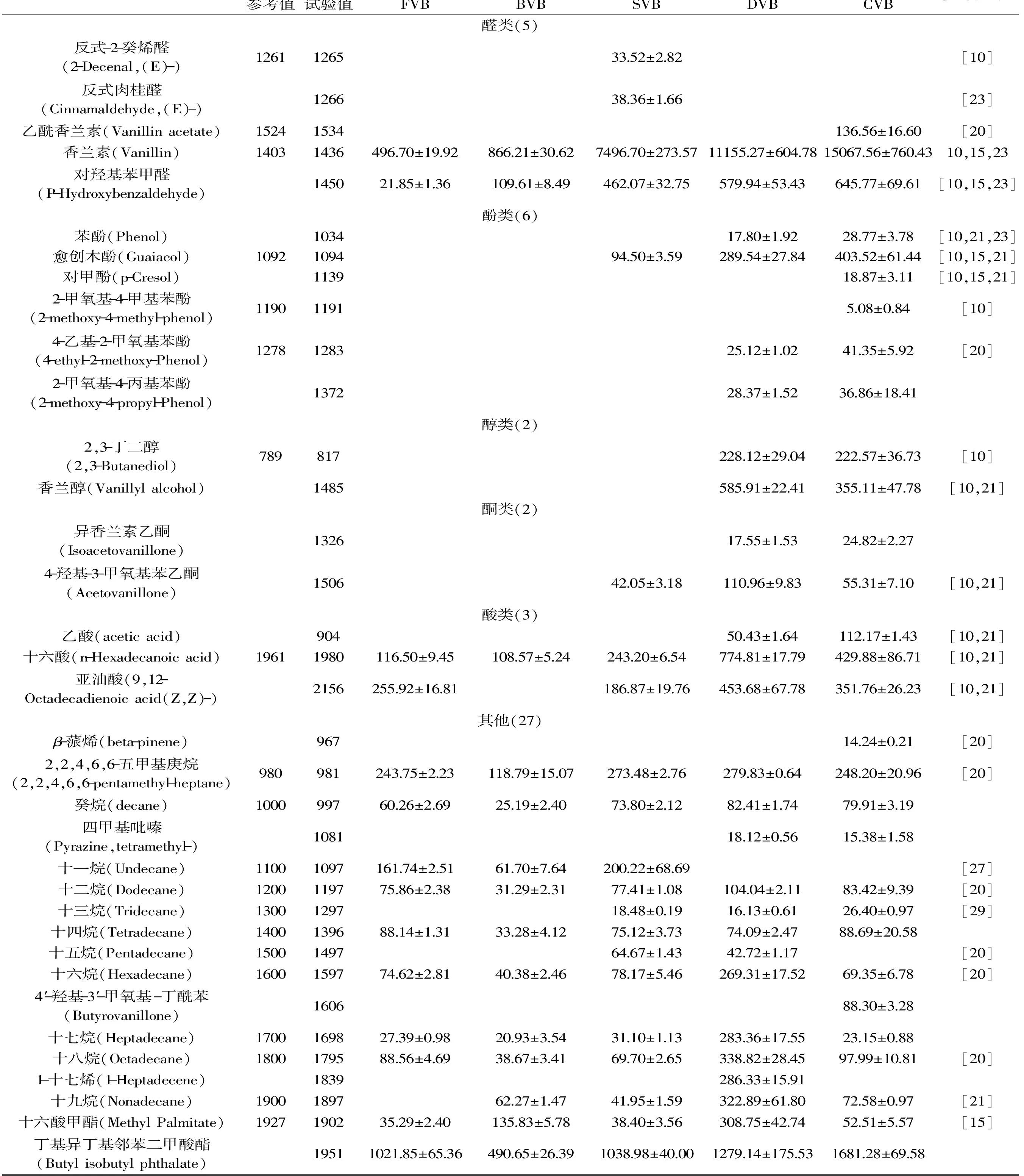
表1 以DB-5为分离柱检测到的香草兰发酵不同阶段的挥发性成分Table 1 Aroma compounds identified in vanilla beans in different curing stages by DB-5

续表
2.6 酸类物质分析
对比表1和表2的酸类物质可以发现,DB-Wax对酸类物质的分离能力更强,共检测到9种。脂肪酸的氧化是香草兰豆荚中非常重要的生香反应,如上面提到的醛类及其他小分子酸、醇等。根据表1和表2的结果,豆荚中酸类物质的含量处于较高的水平,如乙酸、十六酸及亚油酸。可以看出,亚油酸在干燥过程以后含量降低,氧化生成以反式-2-癸烯醛为代表的二烯醛类物质可能是其降低的原因[21]。3-甲基丁酸等被报道可以产生花香味、甜香味的物质[10,23],在陈化豆荚中均被检测到。
2.7 其他物质分析
与发酵后的豆荚(CVB)对比,发酵前期的豆荚中出现了一些物质,随着发酵的不断进行含量逐渐下降最终消失,如2-乙基己基乙酸酯(表2)、己二酸二(2-乙基己)酯(表1)。另有一些物质仅出现在了发酵过程中的某个阶段,如反式肉桂醛、硬脂酸甲酯等。烷烃类物质在整个发酵过程含量变化不大,且多为大分子烷烃,沸点高。因此可以推断其对香气的贡献不大。
3 结论
DB-5与DB-Wax两种色谱柱对香草兰豆荚中挥发性成分的检测有互补作用。两种分离柱共检测到69种挥发性成分,它们至少出现在香草兰发酵过程中的一个阶段。在香草兰豆荚发酵的过程中,发汗阶段开始产生挥发性成分,干燥阶段和陈化阶段为挥发性成分的主要产生和累积阶段,生香反应在这两个阶段缓慢进行,氧化反应是香草兰豆荚中非常重要的生香途径,受氧气、水分活度等影响,氧化反应的速率大大降低,使得豆荚需要较长的干燥和陈化期累积香气成分,而长时间的发酵也会造成挥发性成分的少量损失。但这并不能解释一些沸点高的物质含量的降低,如亚油酸、大分子烷烃等。因此在发酵后期,可能存在挥发性成分间的相互作用或者分解,具体机理还需进一步研究。

