Vinculin在大肠癌及肾癌中的表达及意义
郑 岩,鄢 超,孙景春,赵文波,何成彦,方 玲
(吉林大学中日联谊医院 1.检验科;2.门诊部,吉林 长春130033)
大肠癌(CRC)是全球常见的恶性肿瘤之一,包括结肠癌和直肠癌,具有很高的死亡率。根据世界卫生组织调查研究,新诊断为大肠癌的患者数量增加77%,预计到2030年大肠癌的死亡病例数会增加80%[1]。肾癌(RCC)是最致命的泌尿生殖系统癌症之一,且呈年轻化趋势,约占人类恶性肿瘤的3%[2]。因此,了解大肠癌和肾癌的发生发展过程对于其防治及预后至关重要。 Vinculin(纽蛋白)是一种细胞骨架蛋白,集中在钙粘附蛋白介导的细胞-细胞连接处的胞质表面及整合素介导的细胞-细胞外基质的粘着斑部位,在细胞内高度保守[3]。 现已证实,vinculin通过VCL基因头部(Vh)和尾部(Vt)相互作用调节细胞扩散、连接及黏附功能[4]。因vinculin可增强细胞粘附性,故将其认为是细胞迁移的抑制剂,而癌症的侵袭性和转移性与细胞-细胞、细胞-细胞外基质的粘附性密切相关[5]。本文应用二维液相色谱-质谱联用技术和免疫印迹技术研究 vinculin在大肠癌及肾癌组织中的表达情况,旨在探讨 vinculin与大肠癌、肾癌发生发展的联系。
1 材料与方法
1.1 组织来源
本实验所用的20例大肠癌组织、18例肾癌组织均来自吉林大学中日联谊医院经外科手术切除的标本,经病理学检查证实大肠癌标本均为DukesB期腺癌,肾癌标本均为透明细胞肾癌。手术前均经患者同意且确定没有接受任何治疗。所取的大肠癌癌旁标本均为位于癌组织上端距离癌边缘10 cm之外的组织。标本离体后,立即用生理盐水冲洗干净,液氮冻存备用。
1.2 主要试剂与仪器
二硫代苏糖醇(DTT)、测序级TPCK修饰的胰蛋白酶为美国GE公司产品;2-碘乙酰胺(IAM)、BCA蛋白定量试剂盒、尿素(Urea)为Bio-Rad公司产品;PMSF、TMED、SDS、DNA酶和RNA酶为美国Sigma公司产品;LTQXL线性离子阱质谱仪为ThermoFisher公司产品,1200纳升级液相色谱分析仪购于Agilent公司。
1.3 实验方法
1.3.1组织总蛋白提取并测定浓度 取出冻存的组织样本,充分研磨成粉末。加入裂解缓冲液(30 mmol/L Tris-HCL,9 mol/L Urea,65 mmol/L DTT,2 mmol/L PMSF),室温振荡1h,充分溶解混合物,用RNA酶和DNA酶去除RNA和DNA,4℃离心50 min后留取上清,即为总蛋白质。考马斯亮蓝法染色,以不同浓度的标准蛋白和595 nm处测得的吸光度绘制标准曲线,计算出样本蛋白浓度。
1.3.2组织样品蛋白分离及制备水解多肽混合物 对各样本组织的总蛋白进行电泳分离,为降低所得组织蛋白的尿素浓度,用25 mmol/L NH4HCO3进行清洗。加入一定体积1 mol/L的DTT,56℃避光放置1 h。待反应物降至室温,再加入1 mol/L的2-碘乙酰胺(IAM),室温下避光反应30 min。按1∶50比例加入测序级TPCK修饰的胰蛋白酶和待测蛋白37℃酶切过夜,真空抽干所得样品,置于-80℃冰箱。
1.3.3液质联用技术分析分离鉴定多肽混合物 用Buffer A溶解所得样本,各取50 μg色谱上样,进行反向色谱洗脱。将洗脱的多肽运用LTQXL离子肼质谱仪分析,再用数据依赖的方式进行质谱扫描。
1.3.4免疫印迹试验 用免疫印迹试验再次测定目标蛋白vinculin,验证其在各样本组织中的表达情况。vinculin单克隆抗体为美国Abgent公司产品,内参抗体为β-Actin。
1.4 统计学分析 使用SPSS11.0软件对所得的液质联用图谱进行t检验分析,算法依据SEQUEST法,P<0.05时差异具有统计学意义。
2 结果
2.1 二维液相色谱-质谱联用技术分析结果
本实验对于有丰度变化的蛋白质判定标准为:其质谱数在配对样品中的比值≥1且差值≥72。通过二维液相色谱-质谱联用技术对大肠癌组织及癌旁组织、肾癌组织及癌旁组织的总蛋白分析测定,得出目标蛋白vinculin在大肠癌组织中表达水平明显下调,而在肾癌组织中为上调表达,vinculin质谱结果见图1。
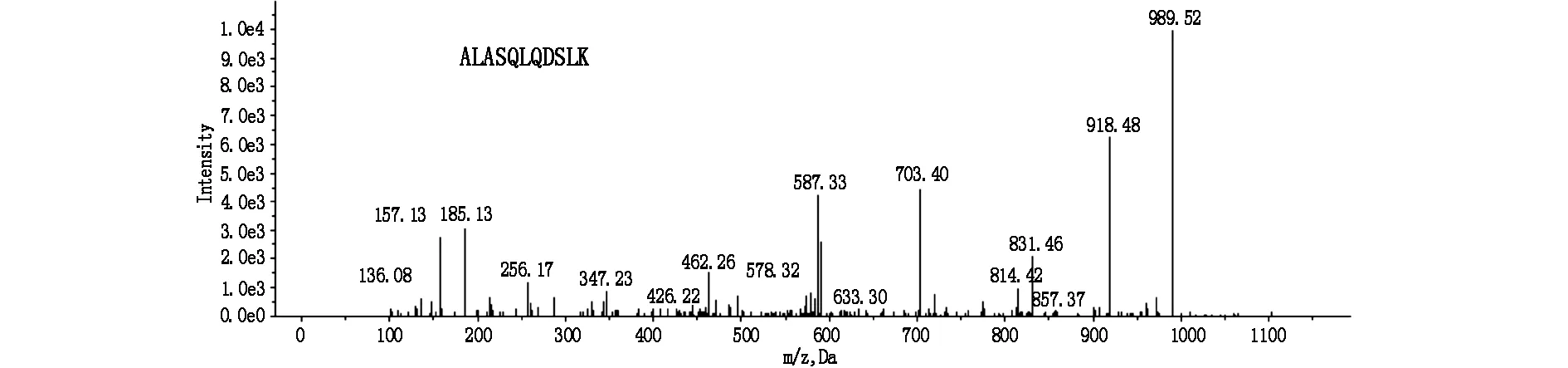
图1 Vinculin质谱图
2.2 免疫印迹验证vinculin的表达情况
用Western blot检测各组织中vinculin的表达水平。结果证明vinculin在大肠癌中的表达水平明显低于配对的癌旁组织,结果见图2;而肾癌组织中vinculin的表达水平高于配对的癌旁组织,结果见图3。进一步的验证了二维液相色谱-质谱联用技术的鉴定结果。

图2大肠癌中Vinculin免疫印迹图图3肾癌中Vinculin免疫印迹图
3 讨论
蛋白质组学(proteomics)技术于20世纪90年代发展起来,具有与以往不同的研究思路,其着眼点为目标对象的总蛋白水平,测定分析样本中的差异蛋白,对初步筛选与肿瘤细胞转移相关的蛋白质有着重要作用,也为肿瘤细胞浸润转移方面研究提供新的启示[6,7]。本实验使用的质谱技术是目前蛋白质组学中研究最热,最有价值的技术。
癌症进展中最关键的步骤之一是肿瘤细胞获得侵入基底膜并进入周围组织的能力,这与癌症转移扩散和最终死亡相关。在这个过程中,肿瘤细胞通常重组他们的肌动蛋白细胞骨架并改变其细胞形状[8]。vinculin作为粘着斑的一个组成蛋白,对肌动蛋白重组和细胞黏附有一定的调控作用,当运用siRNA干扰法对vinculin的表达进行阻断时,可观察到细胞迁移显著增加[9]。有研究表明,纽蛋白影响细胞扩散及肌动蛋白重组的机制是由VCL磷酸化造成的,而这种磷酸化则是SRC 激酶激发引起[10]。Rothenberg KE等人运用新的FRET-FRAP技术研究发现,纽蛋白通过与Talin或肌动蛋白多种结合形式引起不同的机械状态,进而调节粘着斑的细胞及组织力学敏感性,增强力的传递或重排能力[11]。目前,对vinculin在肿瘤发生发展中的作用研究颇热,多篇报道指出在多种类型癌症中vinculin上调表达。Jin GH证实,VCL的基因表达值在胃癌组织中显著上调,表明vinculin可能通过促进肿瘤恶性度和侵袭性参与胃癌进展[12];Ai J等发现,在前列腺癌中vinculin也高度表达,预示着部分患者将从VCL基因的敲低中受益[13]。还有一些研究显示,在鳞状细胞癌、肾癌、膀胱癌等类型肿瘤中均上调表达vinculin。但并非所有类型癌组织中vinculin均为高表达。研究表明,Vinculin在大肠癌组织中低表达,且与膜结合β-catenin 成正相关,缺乏纽蛋白表达可作为大肠癌患者的独立预后因素[14]。
本研究运用液质联用技术证实了vinculin在大肠癌组织中的表达水平明显低于其癌旁组织,而在肾癌组织中的表达却显著高于其癌旁组织,并通过免疫印迹技术得到证实。虽然多种肿瘤疾病中vinculin的表达情况有所不同,但这同时证明vinculin与肿瘤的发生发展过程有关,具体机制目前尚未完全明确,仍需进一步深入探究。

