小鹅瘟卵黄抗体酸化水脱脂工艺优化
胡瑞鸿,丛秋实,李艳飞
(1.东北农业大学动物医学学院,哈尔滨 150030;2.哈药集团生物疫苗有限公司,哈尔滨 150069)
卵黄免疫球蛋白(Immunoglobulin of yolk,IgY)是母鸡受免疫刺激后将血清中相应特异性IgG选择性转移至卵黄蓄积而成[1]。鸡卵黄中含48%水、17.6%蛋白质和30%脂肪[2],脂肪易与蛋白质结合形成脂蛋白[3]。传统粗制卵黄含有大量外源非水溶性蛋白及磷脂等大分子,提取卵黄抗体必须脱脂处理[4],抗体纯度、效价是影响小鹅瘟抗体使用效果的关键因素[5]。
国内研究除脂方法主要有水稀释法、聚乙二醇沉淀法、硫酸葡聚糖沉淀法、天然树胶沉淀法、氯仿、苯酚、辛酸等有机溶剂抽提沉淀法以及超滤、超临界萃取法与冻融等物理化学方法[6]。Kim与Hatta等利用非离子型表面活性剂原理,采用聚乙二醇6000和泊洛沙姆使卵黄液脱脂,破坏卵黄脂类水化膜,打破卵黄乳化状态,卵黄脂类互相凝结形成沉淀,实现脂水分离[7-8]。若两种活性剂浓度过高,破坏抗体蛋白水化膜,形成沉淀,影响抗体效价[9-10]。但上述方法除脂工艺流程长、步骤多、试剂消耗量大,须去除残留化学物质[11]。因此,研究无毒、无害、除脂效率高且除脂后对卵黄抗体影响最小的方法具有重要意义。
本试验研究酸化水不同稀释度、pH、存放时间及离心力对除脂率及卵黄免疫球蛋白提取的影响,筛选同条件下,脱脂率、琼扩效价及蛋白浓度最高的参数组合,旨在确定适用于小鹅瘟卵黄抗体脱脂工艺优化条件,为小鹅瘟卵黄抗体规模化生产提供理论依据及试验基础。
1 材料与方法
1.1 试验材料
小鹅瘟卵黄抗体高免鸡蛋:按照既定免疫程序,免疫合格产蛋鸡,收集鸡蛋[12]。
0.12 mol·L-1(pH 5.0)醋酸盐缓冲液、0.1 mol·L-1(pH 7.2)PBS、辛酸(CP)、硫酸铵(AR)。
小鹅瘟阳性血清:东北农业大学动物免疫学实验室惠赠。
小鹅瘟琼扩抗原:哈药集团生物疫苗有限公司制备。
1.2 方法
1.2.1 IgY抗体测定
1.2.1.1 操作方法
将制备琼脂板按模板用打孔器打孔,挑出孔中琼脂。中心1孔,周围6孔,孔径3 mm,孔距4 mm(见图1)。中央孔加入标准琼扩抗原,1孔加入标准阳性血清,3、5孔加入倍比稀释产品。各孔均加满(25 μL)。将加样后琼脂板放入填有纱布湿盒内,置于37℃,24 h首次判定,72 h最终判定。

图1 琼脂扩散试验Fig.1 Agar diffusion test
1.2.1.2 判定标准
当标准阳性血清孔与抗原孔之间形成清晰沉淀线时,被检产品与抗原孔之间出现沉淀线,被检血清判为阳性;当标准阳性血清孔与抗原孔之间形成清晰沉淀线,被检产品孔与抗原孔之间无沉淀线出现时,被检血清判为阴性;当被检产品最高稀释度孔与抗原孔之间形成清晰沉淀线时,即判为被检产品的琼扩效价,小鹅瘟琼扩效价应不低于1:16。
1.2.2 脂肪含量测定
用香草醛显色法测定[13]。

1.2.3 蛋白含量测定
考马斯亮蓝染色法测定[14]。
1.2.4 电泳分析
SDS-PAGE电泳检查[15]、分离胶浓度12%、浓缩胶浓度5%、电压120 V、考马斯亮蓝R-250染色。
1.2.5 IgY提取
以酸化水、辛酸-硫酸铵法提取IgY。卵黄经酸化水稀释除脂后,加入1.5%辛酸,搅拌混合,1 900 g离心30 min后,加入33%硫酸铵,搅拌混合,经1 900 g离心20 min后,加入pH 7.2 PBS溶解沉淀,置4℃冰箱内保存。
1.2.6 除脂主要影响因素
1.2.6.1 酸化水稀释度对除脂率的影响
每组取10个鸡蛋卵黄液,分别用0.12 mol·L-1醋酸盐缓冲液作1:4~1:9共6组稀释,调pH至5.0,4℃冰箱过夜,测定上清液中脂肪含量,计算除脂率。
1.2.6.2 酸化水pH对除脂率的影响
每组取10个鸡蛋卵黄液,分别用0.12 mol·L-1醋酸盐缓冲液作1:8稀释,调pH至4.8、5.0、5.2、5.4共4组,4℃冰箱过夜,测定上清液中脂肪含量,计算除脂率。
1.2.6.3 酸化水作用时间对除脂率的影响
每组取10个鸡蛋的卵黄液,分别用0.12 mol·L-1醋酸盐缓冲液作1:8稀释,调pH至5.2,置于4℃冰箱内5、8、12、15 h,测定上清液中脂肪含量,计算除脂率。
1.2.6.4 离心条件对除脂率的影响
每组取10个鸡蛋卵黄液,分别用0.12 mol·L-1醋酸盐缓冲液作1:8稀释,调pH至5.2,置于4℃冰箱内15 h(过夜),1 900 g离心20、30 min;7 598 g离心20、30 min;空白作对照;测定上清液中脂肪含量,计算除脂率。
1.2.7 除脂条件对IgY提取的影响
将上述除脂主要影响因素,在相同条件下经辛酸和硫酸铵作用,提取IgY,测定其效价、蛋白浓度及蛋白质纯度等,观察不同除脂条件对IgY提取的影响。
1.2.8 脱脂条件优化参数组合试验
取600枚高免鸡蛋,分6个批次,按上述试验确定最优参数组合作脱脂工艺试验,提取上清液,测定脂肪含量,计算除脂率、琼扩效价、蛋白浓度。
1.3 统计与分析
使用Excel 2007、SPSS 16.0软件作多重比较,平均值±标准差(Mean±SD)表示。结果数据列表中,同列肩标大写字母不同表示差异极显著(P<0.01);小写字母不同表示差异显著(P<0.05);字母相同表示差异不显著(P>0.05)。
2 结果与分析
2.1 除脂主要影响因素
2.1.1 酸化水稀释度对除脂率的影响
比较6组不同酸化水稀释度,根据颜色、澄清度、沉淀状态及除脂率评价条件,随稀释倍数增加,上清液澄清,卵黄沉淀逐渐结实,稀释度为1:8时,除脂率达96%以上,均一、稳定,除脂率最高。结果如表1、图2所示。

表1 酸化水稀释度对除脂率的影响Table 1 Effect of acidified water dilution on lipids removal rate
2.1.2 酸化水pH对除脂率的影响
比较4组不同酸化水pH,根据颜色、澄清度、沉淀状态及除脂率评价条件,pH为4.8时,几乎无沉淀且浑浊,随pH增大,上清液澄清,沉淀逐渐结实,呈胶质状,当pH至5.2时,除脂率达96%以上。结果见表2。

图2 酸化水稀释度对除脂率的影响Fig.2 Effect of acidified water dilution on degreasing rate

表2 酸化水pH对除脂率的影响Table 2 Effect of acified water pH on degreasing rate
2.1.3 酸化水作用时间对除脂率的影响
4℃作用5、8、12、15 h,除脂率无明显差异,均达96%以上,但卵黄沉淀随着作用时间增加,沉淀密度增加且无流动性,倾倒未随上清液流出,结合规模化生产15 h为最优时间。结果如表3所示。

表3 酸化水作用时间对除脂率的影响Table 3 Effect of action time of acidified water on degreasing rate
2.1.4 离心条件对除脂率的影响
比较上清液未离心、离心力1 900 g、7 598 g,在不同离心时间下除脂率,无明显差异,其中以离心力1 900 g,20 min除脂率最高,达96.91%,结果如表4所示。
2.2 除脂条件对IgY提取的影响
2.2.1 酸化水稀释度对IgY提取的影响
不同稀释度水脱脂后,经辛酸和硫酸铵作用,提取IgY作琼脂扩散试验,测定AGP,效价值为64、128倍。蛋白质含量和纯度存在差异,稀释度1:5和1:8组蛋白质含量与其他组存在差异,提取IgY含量高,但1:5稀释度AGP效价比1:8低,稀释度1:8时为最优稀释度。结果见表5、图3。
2.2.2 酸化水pH对IgY提取的影响
卵黄液经不同pH脱脂后,测定提取IgY琼扩效价,达到64、128倍。随pH升高蛋白质纯度增高,但差异不显著,pH 5.2时蛋白浓度略高,为最优pH,结果见表6、图4。
2.2.3 酸化水作用时间对IgY提取的影响
四种时间作用脱脂后,测定提取IgY琼扩效价,达到64、128倍,蛋白质含量5 h为19.79 mg·mL-1、8 h为20.90 mg· mL-1、12 h为20.10 mg· mL-1、15 h为20.16 mg·mL-1,差异不显著,结果见表7。
2.2.4 离心条件对IgY提取的影响
取鸡卵黄,用醋酸盐缓冲液1:8稀释后,调pH5.2,置4℃过夜,取200mL卵黄液经不同离心条件脱脂后,提取IgY,结果显示离心力为1900g,离心20 min时,提取数量最多,且蛋白浓度最高,琼扩效价无差异。结果见表8。

表4 离心条件对除脂率的影响Table 4 Effects of centrifugal conditions on degreasing rate

表5 酸化水稀释度对IgY提取的影响Table 5 Effect of acidified water dilution on IgY extraction
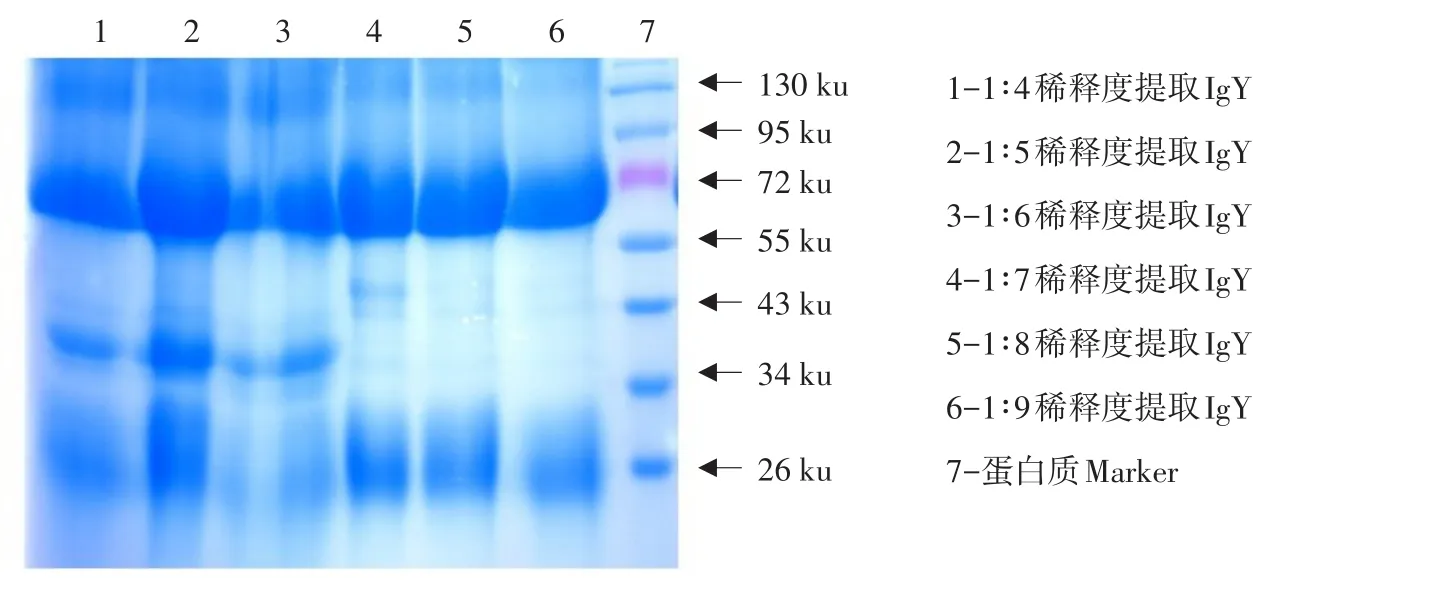
图3 酸化水稀释度对提取IgY影响电泳Fig.3 Electrophoresis image of the effect of acidified water dilution on the extraction of IgY
2.3 脱脂条件优化参数组合试验验证
取600枚高免鸡蛋,分为6个批次,按上述试验确定最优参数组合,酸化水1:8稀释、pH 5.2、4℃存放15 h,1 900 g离心20 min作脱脂试验,结果显示琼扩效价均达1:64以上,蛋白浓度达19 mg·mL-1以上,除脂率超过96%。结果见表9。

表6 酸化水pH对IgY提取的影响Table 6 Effect of acified water pH on IgY extraction

图4 酸化水pH对IgY提取的影响电泳Fig.4 Electrophoresis image of the effect of pH of acified water on IgY extraction

表7 酸化水作用时间对IgY提取的影响Table 7 Effect of storage time of acidified water on IgY extraction

表8 离心条件对IgY提取的影响Table 8 Effect of centrifugal conditions on IgY extractionn

表9 脱脂条件优化参数组合试验Table 9 Combination test of skim condition optimization parameters
3 讨论与结论
3.1 除脂主要影响因素
卵黄脱脂研究国外起步较早、相对成熟,如PEG法及其改进方法(1980和1985)、氯仿-PEG法(1984)、硫酸葡聚糖法(1981)和水稀释法等[16]。国内研究中,柴家前提出甲醛脱脂法,添加0.3%~1.2%甲醛溶液[17];常维山提出苯酚脱脂法,采用2%~3%纯苯酚溶液[18];王辉龙等研究聚乙二醇一步沉淀提取法[19];杨严俊等利用高分子胶结合超滤技术[20]。以上方法普遍存在成本高、产量低、抗体纯度低、效价低等缺点,小鹅瘟抗体使用效果较差。本试验运用相似相溶原理,探讨稀释度、酸碱度、存放时间和离心条件4个因素对卵黄除脂的影响。将卵黄混匀于水中,使脂蛋白聚集沉淀或离心分离,获得含IgY上清液。醋酸盐缓冲液作1:4~1:9稀释卵黄,共6个稀释度,调pH 5.2,置于4℃冰箱内15 h。上清液颜色由黄逐渐转变为乳白色,由浊变清,上清液增多,沉淀部分密实。1:7以上的3个稀释度除脂率可达96%以上,本研究增加1:4、1:9两组试验,差异显著,说明醋酸盐缓冲液稀释倍数对除脂率影响显著,其中1:8稀释度除脂效果最佳,且IgY含量与琼扩效价最理想,因此作为酸化水除脂的稀释度。
用水稀释卵黄后,稀释液pH显著影响除脂和IgY提取效果。pH 4.8时,上清液浑浊,沉淀松散,随pH升高,上清液逐渐澄清,沉淀密实,呈胶体状,除脂率升高。当pH升至5.2时,除脂率达96%以上。Akita等研究表明,酸度影响卵黄浆液中脂类含量,pH 4.6~5.2时,水溶液中几乎无脂类物质,pH继续增加,水溶性脂类含量增加,可能是酸度升高影响脂肪去除[21]。为此,将卵黄液pH调至5.2,除脂率和IgY提取效果较好。
卵黄液1:8稀释后,pH 5.2,不同时间除脂效果基本相同,存放5 h除脂率较大,在工厂化前提下,考虑大量提取的实际情况,选用存放15 h(过夜),沉淀较密实且呈胶体状,保证除脂效果。
以酸化水除脂时,卵黄作1:8稀释,pH 5.2,经15 h作用后,上清液较为澄清,脂蛋白沉淀密实。比较离心力1 900 g、7 598 g与未离心处理,未离心上清液量较少,除脂率略低。为此,在保证除脂效果及IgY提取量、纯度情况下,采用1 900 g离心20 min方法,但工业化生产中对离心设备容量、安全性、电力及人工成本要求较高,未来将进一步考虑调整工艺参数,达到工业化标准。酸化水具有操作简便、成本低廉、除脂效果好等优点,但提取液中仍有脂类与蛋白结合,存在微量非目的蛋白,提高提取IgY纯度尚待深入研究。
3.2 除脂条件对IgY提取质量的影响因素分析
氯仿、苯酚、辛酸等有机溶剂抽提沉淀法及Kim与Hatta等利用非离子型表面活性剂原理[7-8],使卵黄脂类互相凝结,发生沉淀,实现脂水分离。但浓度过高时,破坏抗体蛋白水化膜使之发生沉淀,影响抗体效价[9-10]。本试验中稀释度、酸碱度、存放时间和离心条件4个因素是制约去除IgY中脂类重要因素。在稀释度试验中,琼扩效价及蛋白浓度呈先升后降趋势,虽然1:6、1:7、1:8稀释度蛋白含量较高,结合除脂率影响故选择1:8稀释倍数,但酸化水稀释度对提取IgY影响的电泳图中可见其他条带,说明存在杂蛋白,应考虑进一步去除。
在酸化水pH对IgY提取的影响试验中,pH 5.2可得到较高蛋白含量,但电泳图上可观察鸡免疫球蛋白分子质量67 ku左右重链、分子质量为22 ku左右轻链和分子质量为45 ku、35 ku电泳条带,为杂蛋白条带。蛋白含量高可由杂蛋白引起,需进一步提纯分析。酸化水作用时间对IgY提取试验中各组琼脂扩散效价及蛋白浓度并无显著差异,结合除脂率及工业化生产需要,选择人力、电力较为经济的15 h(过夜)工艺方法,方便生产转化。酸化水离心条件对IgY提取试验中,未离心试验组获得目的蛋白含量较低,可能是无外力作用下目的蛋白较少,但此方法对设备、人力要求不高,琼脂扩散效价无差异,但获得IgY纯度略低。因此,考虑除脂工艺时应结合除脂率综合评定蛋白含量及琼脂扩散效价。

