土壤及凋落物源氮对中亚热带森林土壤SON的影响
马红亮,马 芬,,邱 泓,,高 人,,尹云锋,,彭园珍,
1 福建师范大学地理科学学院,福州 350007 2 福建师范大学,湿润亚热带山地生态国家重点实验室培育基地,福州 350007
土壤溶解性有机氮(Dissolved Organic Nitrogen, DON)被定义为土壤溶液中溶解的有机氮,而土壤可溶性有机氮(Solube Organic Nitrogen, SON)是指用水、KCl、K2SO4、电超滤、CaCl2或其他萃取剂从土壤中提取的有机态氮[1]。DON虽仅占土壤有机氮库的一小部分,却是土壤氮库中最活跃的组分之一,在陆地生态系统氮循环中起着重要作用[2- 3]。尽管很少有SON和DON关系研究的报道,但是,理论上讲,SON应该是DON潜在的源。因此,SON在生态系统氮素循环以及维持陆地生态系统养分平衡方面均起着重要作用。

因此,本研究以中亚热带森林土壤为研究对象,选用针、阔叶林凋落物,及阔叶林15N标记材料,探究土壤有机质和凋落物对土壤SON动态的影响差异,为认识凋落物与土壤之间的氮素关系提供理论依据。
1 材料与方法
1.1 供试土壤概况
供试土壤采自福建省建瓯市万木林自然保护区(27°03′N,118°09′E),地处武夷山山脉东南、鹫峰山脉西北,属中亚热带季风气候,年平均气温19.4℃,相对湿度81%,全年无霜期达277 d,年平均降水量1673.3 mm,土壤为花岗岩发育的微酸性山地黄红壤。样地海拔350 m,坡向300°,坡度21°,为1969年杉木(Cunninghamialanceolata)幼苗造林形成的人工林,树种单一,林分结构简单,灌木层以杜茎山(Maesajaponica(Thunb.)Moritzi)、狗骨柴(Tricalysiadubia(Lindl.)Ohwi)为主,草本有狗脊蕨(Woodwardiajaponica(L.f.)Sm.)、草珊瑚(Sarcandraglabra(Thunb.)Nakai)等。在样地的上、中、下坡随机选取10个采样点,收集样方内土壤表层的新近杉木凋落物,去除表层凋落物后,用铁锹采集表层土壤(0—15 cm),挑除石头、根系、动植物残体等杂物,充分混匀土壤带回实验室,过2 mm筛,装入自封袋,置于冰箱(4 ℃)内保存备用。土壤基本理化性质:pH(H2O)5.7,饱和持水量(WHC)638.2 g/kg,全碳 23.8 g/kg,全氮 1.8 g/kg,C/N 12.9,铵态氮20.6 mg/kg,硝态氮11.1 mg/kg,可溶性有机氮 17.7 mg/kg,土壤容重1.2 g/cm3。土壤粘粒(<0.002 mm),粉砂(0.02—0.002 mm)和砂粒(2—0.02 mm)分别为35.3%,49.3%和15.4%。
将收集的新近的、保持原有形态、外表无分解痕迹的杉木凋落物(新鲜杉木,FS),以及自米槠盆栽内收获的米槠叶及细枝凋落物(新鲜米槠,FM)(15N丰度为6.1%),剪成1 cm×1 cm(叶)或1 cm(细枝)后装入自封袋备用,并测定凋落物的碳、氮含量(表1)。

表1 凋落物的主要性质
SON: 土壤可溶性有机氮,Soil soluble organic nitrogen; FS: 新鲜杉木凋落物, Fresh China fir litter; FM: 新鲜米槠凋落物,FreshCastanopsiscarlesiilitter
1.2 试验设计
设置土壤(S)、土壤+新鲜杉木(S+FS)和土壤+新鲜米槠(S+FM),共3种处理。称取相当于烘干土重40 g的供试鲜土,装入300 mL培养瓶中,开盖置于25℃(25℃为微生物提供较适宜的土壤温度)的生态培养箱中预培养7天。预培养后,根据野外单位面积年凋落物现存量[16]来确定凋落物添加量为12.5 g/kg干土(以凋落物干重计),均匀平铺于土壤表层,并根据土壤含水量和饱和含水量(WHC),用去离子水调节土壤含水量为60% WHC。置于25℃的生态培养箱中培养,培养期间每3天通过称重法保持土壤水分恒定。在培养开始后的第0、15、30、90、150、210 天随机选取每种处理的3个培养瓶进行破坏性取样,挑除土壤表面未分解完的残留凋落物。土壤和凋落物样品分别提取测定氮含量。
1.3 研究方法
1.3.1 测定方法
土壤含水量用烘干法测定;土壤容重和饱和持水量用环刀法测定;土壤pH值采用玻璃电极法,土水比为1∶2.5;土壤粒径组成用土壤粒径分析仪(SEDIMA 4- 12, 德国UGT)测定;土壤全碳、氮含量用碳氮元素分析仪(Elemantar vario MAX CN, 德国)测定;土壤和凋落物可溶性总氮、铵态氮和硝态氮采用0.5 mol/L K2SO4(土壤水土比为5∶1,凋落物水凋比为50∶1)浸提,振荡1 h(250 r/min),离心10 min(4000 r/min),过滤后连续流动分析仪(SKALAR SAN++,荷兰)测定;土壤微生物量氮采用氯仿熏蒸-K2SO4浸提法测定[17];铵态氮和硝态氮的15N丰度采用N2O产生法测定[18];可溶性有机氮的15N丰度采用碱性过硫酸钾氧化法[19],将含氮化合物的氮元素转化为硝酸盐,再利用N2O产生法测定。
1.3.2 计算方法
(1)土壤可溶性有机氮含量的计算[20]:
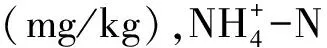
(2)土壤微生物量氮含量的计算[17]:
式中,MBN为微生物量氮(mg/kg),E熏蒸为熏蒸土壤浸提液的总氮含量(mg/kg),E未熏蒸为未熏蒸土壤浸提液的总氮含量(mg/kg),k为转换系数0.45。
(3)可溶性有机氮的15N丰度和含量计算[21]:
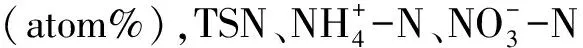
(4)土壤SON来自凋落物的比例计算[22]:
SONf=(δ15Nfinal-t- δ15Nsoil)/(δ15NLitter-δ15Nsoil)
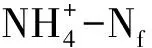
1.4 数据处理
所有数据用Microsoft Excel 2013进行整理后,使用SPSS 20.0软件进行统计分析,用Origin 9.0软件进行绘图。采用单因素方差分析(one way ANOVA)和最小显著差异法(LSD)比较培养期间不同处理间的差异;采用双因素方差分析处理和时间,及它们的交互作用,显著性水平设定为ɑ=0.05。
2 结果与分析
2.1 土壤可溶性有机氮和微生物生物量氮含量的变化

图1 不同处理土壤可溶性有机氮和微生物生物量氮含量的变化Fig.1 Changes of soil SON and MBN content under different treatmentsFS: 新鲜杉木凋落物, Fresh China fir litter; FM: 新鲜米槠凋落物,Fresh Castanopsis carlesii litter
由图1可以看出,0—30天,凋落物添加并没有增加土壤SON,甚至在第30天显著低于对照(P<0.05);在0—15天S+FS处理最低。第90天后,各处理没有显著差异。土壤SON含量随培养而增加,培养结束时,比第0天显著(P<0.05)增加了6.6—13.6 mg/kg,凋落物添加处理增幅较大。土壤MBN含量在前30天快速降低,S, S+FS和S+FM分别显著(P<0.05)降低135.5、164.2 mg/kg和92.5 mg/kg,之后,维持在平均52.3 mg/kg。在0和15天,各处理间MBN差异显著(P<0.05),在30、90天和150天S+FS处理与S+FM处理差异显著(P<0.05)。方差分析显示,处理、培养时间及它们的交互作用对土壤SON和MBN含量影响显著(P<0.05)。
2.2 土壤SON的15N丰度及含量的变化
由图2可以看出,除30天外,S+FM处理显著(P<0.05)提高了土壤SON的15N丰度和含量;培养结束时,S+FM处理土壤SON的15N丰度为4.70%,是对照S的约13倍。土壤SO15N含量为1.26 mg/kg,是对照S的约14倍。由表2可知,土壤SON来自米槠凋落物处理的比例在210天最高,土壤氨态氮的比例在30天内增加后,不断升高,然而土壤硝态氮的比例很小。
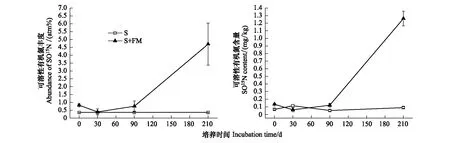
图2 不同处理土壤可溶性有机氮的15N丰度及含量的变化Fig.2 Changes of 15N abundance and content of SON under different treatments
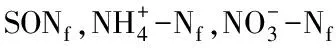
2.3 土壤无机氮含量的变化
由图3可知,第15天和30天,S+FS处理的土壤铵态氮含量显著(P<0.05)高于S处理;然而,0—30天,S+FM处理显著(P<0.05)低于S处理。从第90天开始,各处理间的土壤铵态氮含量没有差异。培养结束时,各处理比第0天时显著(P<0.05)降低了9.6—17.4 mg/kg。相反,各处理的土壤硝态氮含量均呈线性增加趋势,S+FS处理从第30天开始显著(P<0.05)高于S处理21.2%—83.4%;而S+FM处理的低于S处理12.2%—38.4%,且除第0天和30天外,与S处理的差异显著(P<0.05)。培养结束时,各处理的土壤硝态氮含量比第0天显著增加了121.6—180.3 mg/kg,以S+FS处理的增幅最大。方差分析显示,处理、培养时间及它们的交互作用对土壤铵态氮和硝态氮含量影响显著(P<0.05)。
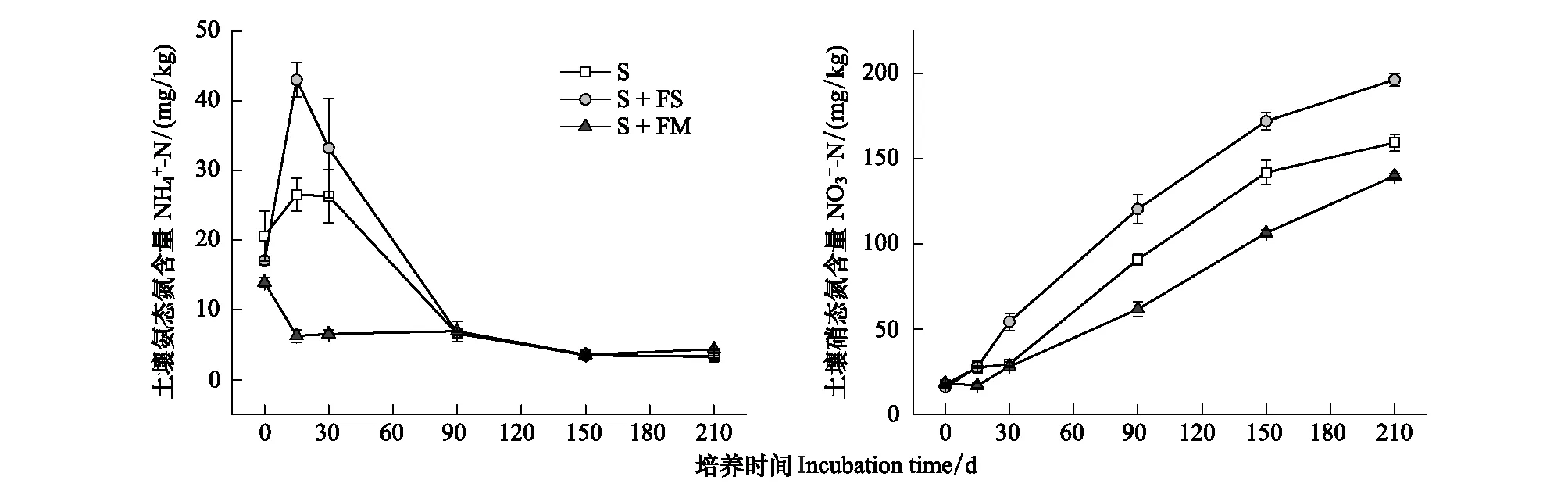
图3 不同处理土壤铵态氮和硝态氮含量的变化Fig.3 Changes of soil and content under different treatments
2.4 凋落物可溶性氮含量的变化
由图4可以看出,FM的可溶性铵态氮迅速在15天升高,然后随着培养而降低,培养结束时,FS和FM的可溶性铵态氮比第15天(最高值)分别显著(P<0.05)降低了0.50 g/kg和0.47 g/kg。然而,可溶性硝态氮含量均呈上升趋势(图4),90天开始FS的显著高于FM(P<0.05)。培养结束时,FS和FM的硝态氮比第0天分别显著(P<0.05)增加了1.08 g/kg和0.42 g/kg。凋落物可溶性SON含量随培养而降低,仅在0、30天和90天处理之间有显著差异(P<0.05);培养结束时,与第0天相比,FS和FM的SON分别显著(P<0.05)降低0.52 g/kg和0.24 g/kg。方差分析显示,处理、培养时间及它们的交互作用对凋落物可溶性铵态氮、硝态氮、SON含量影响显著(P<0.05)。
图4 不同凋落物可溶性氮含量的变化Fig.4 Changes of soluble nitrogen content in different plant litters
2.5 全氮含量及C/N比的变化
2.5.1 土壤全氮含量及C/N比的变化
由图5可以看出,在整个培养期,土壤全氮含量在S+FS处理最高、S+FM处理最低。在0天S+FM处理显著(P<0.05)低于S和S+FS处理,而在90天和210天S+FS处理显著(P<0.05)高于S和S+FM处理。培养结束时,S,S+FS和S+FM处理的土壤全氮含量分别是1.82、1.88 g/kg和1.80 g/kg。土壤C/N在S+FM处理的0天最高(P<0.05),且随培养结束S+FS和S+FM处理的降低明显(P<0.05),而S处理变化不大(图5)。方差分析显示,处理对土壤全氮含量及C/N比影响显著(P<0.05),培养时间仅对C/N比影响显著(P<0.05),而处理与培养时间的交互作用不显著(P>0.05)。
2.5.2 凋落物全氮含量及C/N比的变化
由图6可知,凋落物全氮含量在30天之前快速升高,然后FS的全氮随培养而降低。FM的C/N比在30天之前快速降低,而后缓慢下降到23.3;但是FS在30天之前降低后,没有继续下降。在第0、30天和90天,全氮在FM显著(P<0.05)低于FS,C/N在FM显著(P<0.05)高于FS,第210天则相反。方差分析显示,处理、培养时间及它们的交互作用对凋落物全氮含量及C/N比影响显著(P<0.05)。
3 讨论
凋落物中含有大量的可溶性有机氮[9-10],影响表层土壤氮含量[8,10]。凋落物作为氮含量较高的外源有机物质,由易分解成分(如糖类、淀粉、脂肪等)和难分解成分(如木质素、多酚等)组成[23],其阶段性分解进入土壤的物质必然对SON的产生影响。本研究发现,针阔叶凋落物含有较高的可溶性有机氮(表1),置于土壤表面开展研究,凋落物SON降低,但是并有显著提高土壤SON(图1)。表明凋落物SON没有直接影响土壤。
研究表明,凋落物的C/N比与土壤氮矿化呈负相关,即凋落物C/N比低,氮释放快,但是C/N比存在阈值,当超过阈值时,氮矿化和固定发生转折[24-25]。张圣喜等[26]研究表明,土壤微生物的C/N比一般维持在10左右,如果添加的凋落物C/N比较高,在其降解过程中,土壤微生物对氮的需求就较多,如果添加的凋落物C/N比接近于25,那么土壤微生物的生物量往往较高,凋落物的分解速率也较快。本研究中,杉木凋落物(FS)的C/N比最低,为24.1,大于土壤C/N比(12.9)。培养90天,S+FS处理的土壤铵态氮含量高于对照,土壤以氮矿化为主,因此,SON低于S处理。S+FS处理土壤氨态氮在15天迅速升高(图3),一方面是由于土壤SON矿化而增加氨态氮(图1),另一方面杉木林凋落物可溶性氨态氮持续降低(图4)。但90天后因硝化作用增强,S+FS处理的土壤和凋落物硝态氮含量在不断升高,且土壤氨态氮最低。由于杉木林凋落物的可溶性硝态氮含量本身并不高(表1),因此,杉木凋落物源SON降低主要发生硝化作用,并没有直接提高土壤SON。有研究显示表土层水溶性有机氮浓度随着森林凋落物层的增加而增加,表明凋落物层的淋溶起主要作用[8],而本文土壤SON没有增加可能与缺少淋溶向下运输有关。结合对半分解杉木凋落物C/N比(57.7)、可溶性氨态氮(13.9 mg/kg)和可溶性有机氮(178.3 mg/kg)的分析,我们判断,从新近杉木凋落物(表1)到半分解状态,将释放大量的可溶性氮,因此,在自然状态下,凋落物分解对土壤的影响是存在的。本研究中,添加杉木凋落物提高了土壤硝态氮含量,然而,野外样地土壤硝态氮含量没有增加[27],说明野外无机氮被植物吸收利用或淋溶损失。Qualls等[7]认为凋落物层无机氮含量很少,主要归因于根系和菌根吸收。当杉木凋落物粉碎后和土壤混合培养,土壤无机氮降低[28],而本文将杉木凋落物放于土壤表面,无机氮并没有降低,表明表层凋落物对土壤氮的贡献是积极的[7- 8]。由于来自凋落物层和土壤层的SON分解难易程度不同[13- 14],且随着分解凋落物SON含量降低[8],而含有较高SON的新鲜杉木没有增加土壤SON的结果表明,在没有降雨情况下,土壤中的SON主要来自土壤有机质的分解。林宝平等[29]研究去除人工林凋落物1年后降低土壤氮储量,强调了凋落物输入的重要性,但并未区分土壤和凋落物源DON的动态差异。而来自凋落物源的易变(labile)碳氮对土壤有机质有激发效应[30],因此,研究认为即使凋落物提供了大量SON给土壤,由于它的可利用性,土壤中的SON主要还是来自土壤自身有机物的转化。
新鲜米槠凋落物(FM)的C/N比分别为57.5,远大于土壤C/N比(12.9)。阔叶林凋落物的可溶性氨态氮非常低,加入土壤培养后,S+FM处理土壤氨态氮低于对照,且在15天内迅速降低,而凋落物可溶性氨态氮则在同时间段迅速升高,然后开始降低(图4),说明有较高C/N比的阔叶林凋落物的分解初期需要足够的氨态氮,土壤以氮固定为主。土壤氮可以向凋落物转移来提高凋落物的分解[31],因此,在后期FM添加处理土壤SON高于对照。同时FM添加降低土壤硝态氮含量,这可能与较高C/N比的凋落物具有较低的净硝化和较高的硝态氮生物消耗有关[32],也可能与硝态氮的固定有关[28]。Jones等[33]认为,土壤中难溶性的有机氮分解为SON,特别是易降解的低分子量有机氮,是限制土壤氮矿化的关键因素。而SON的生物降解性由微生物的碳需求驱使,而并非氮有效性[34]。在凋落物分解初期或新近凋落物可产生易分解的水溶性物质、碳水化合物以及含氮化合物,大量养分迅速释放,供微生物利用而提高其活性[35-36],外源营养物质的输入会刺激微生物对土壤DOM的矿化[10]。因此,培养90天之前的SON主要来自土壤中有机质的分解,90—210天,F+FM处理来自凋落物的SON比例增加。然而,90天之前来自凋落物的氨态氮比例的升高(表2),表明FM凋落物中SON迅速矿化或凋落物中可溶性氨态氮的释放,且微生物优先利用来自土壤的氨态氮发生硝化作用,导致土壤的氨态氮降低,以及来自凋落物的硝态氮比例非常低(表2)。本研究虽然没有开展15N标记的杉木林凋落物添加实验,根据杉木林凋落物可溶性氮的变化情况,与阔叶林凋落物的影响比较,土壤中来自杉木凋落物的最高可溶性有机氮的比例可能需要更短的时间,氨态氮的比例会更高。可见,土壤中的SON是与凋落物分解的动态、以及对土壤的影响有关,而正如凋落物之间氮素转移受到淋溶的影响一样[37],降雨将影响氮素由凋落物向土壤层的转移。

