不同干扰方式下松江湿地土壤微生物群落结构和功能特征
李森森,马大龙,臧淑英,王璐璐,孙弘哲
哈尔滨师范大学地理科学学院,哈尔滨 150025
湿地作为陆地和水体的过渡区域,是具有丰富生物多样性和较高生态服务价值的特殊生态系统[1]。微生物参与湿地生态系统的物质循环和能量流动,对维持湿地生态过程和功能具有重要作用[2-4]。微生物对其生存的微环境变化十分敏感,其群落结构和功能都会随着环境条件的变化而发生迅速改变,是指示湿地生态系统健康状况的重要生物指标。城市湿地是现代城市生态系统的重要组成部分,具有调节区域小气候、保障水源水质、缓解城市环境污染等重要生态服务功能。然而,在快速城市化过程中人类干扰活动已经成为城市湿地生态健康水平下降的主要驱动因素。国内外许多研究表明,农业开垦、旅游开发对湿地土壤养分、土壤物理性状、植物群落多样性和生态景观等方面都产生严重影响,而对比和辨识不同人为干扰对城市湿地土壤微生物的影响,将有助于深入理解湿地生态系统退化的关键驱动因素及其退化机制[5-8]。
土壤微生物群落结构组成极为复杂,而传统的培养方法仅能分离鉴定1%的微生物,很难全面解析自然状况下土壤微生物群落结构和多样性[9-10]。近年来,随着研究方法的不断创新和改进,使土壤微生物的研究得到长足的发展。磷脂脂肪酸(phospholipid fatty acid,PLFA)图谱分析技术是一种快速、可定性和定量分析土壤微生物群落的方法,能够反映不同生境中微生物群落结构组成和多样性变化规律[11]。BIOLOG微平板分析法通过土壤微生物对不同碳源利用能力和代谢的差异来表征其功能多样性,在微生物群落功能的研究中得到广泛应用[12]。已有的研究结果表明,微生物群落结构和多样性与多种土壤环境因子(如pH值、有机质、含水量及可利用性的碳、氮等)密切相关[13-16]。因此,通过分析微生物群落结构及功能特征能够较为快速地反映或预警城市湿地生态环境质量及其变化趋势。
松江湿地依托松花江主航道,介于哈尔滨市南、北两城区之间,全长约123 km,总面积约为410 km2,是我国面积最大的天然城市湿地[17]。近年来,随着城市化的加速发展,工农业污水排放增多,旅游活动日趋频繁,对松江湿地生态环境造成不同程度的破坏,使其功能和效益受到严重影响,研究人为干扰对微生物群落功能和结构的影响规律,是准确估算城市湿地环境承载力的前提。目前对松江湿地的研究多集中在旅游开发与生态修复等领域,尚缺乏对湿地土壤微生物群落结构、功能特征及与环境因子关系的研究。因此,本研究以松江湿地为典型研究区域,采用BIOLOG微平板法和磷脂脂肪酸(PLFA)技术,系统分析4种(农业、工业、旅游和保护)不同干扰方式下土壤微生物代谢功能和群落结构多样性,探明微生物与土壤环境因子间的响应关系,旨在为揭示人为干扰对湿地生态系统的影响机制和科学评价松江湿地生态服务功能提供理论和科学依据。
1 材料与方法
1.1 研究区概况
松江湿地西起双城区与道里区交界处,东至大顶子山航电枢纽(126°10′—127°23′E),南北以松花江沿岸堤坝外延2—5 km为界(45°40′—46°03′N),属典型沼泽化低湿平原地貌的河流湿地,也是我国面积最大的原生态城市湿地,主要包括金河湾湿地、呼兰河口湿地、太阳岛湿地、阿什河湿地、白鱼泡湿地、滨江湿地、民主湿地、长岭湖湿地和阳明滩湿地等,对调节区域气候、防洪蓄洪、净化水质环境以及生物多样性保护起着至关重要作用[18]。该区域属典型半湿润大陆性季风气候,冬季寒冷漫长,夏季炎热短暂,春、秋季气温升降变化较快,年平均气温4.3℃,最冷月(1月份)平均气温-18.3℃,最热月(7月份)平均气温23℃;年均降水量400—600 mm,降水多集中在夏季。

图1 研究区及采样点分布Fig.1 The distribution of Research area and sampling pointsTYD:太阳岛湿地,Sun Island wetland;JHW:金河湾湿地,Jinhe Bay wetland;BJG:滨江湿地,Binjiang wetland;HLH:呼兰河口湿地,Hulan Estuary wetland;ASH:阿什河湿地,Ashi River wetland;BYP:白鱼泡湿地,Baiyupao wetland
1.2 样品采集
2015年7月,根据松江湿地的地域分布特征兼顾采样可行性和代表性原则,选择土壤类型相同、地形地貌一致的天然湿地,按照不同人为干扰方式分别设置农业干扰类型(呼兰河口湿地HLH,周围有农耕活动,主要干扰源为化肥和农药污染物),工业干扰类型(阿什河湿地ASH,靠近工业污染源,工业废水和固体废弃物等外源污染物输入较多),旅游干扰类型(金河湾湿地JHW、白鱼泡湿地BYP和太阳岛湿地TYD,建设有湿地公园,旅游干扰强度较高,主要干扰源为旅游垃圾)和保护类型(滨江湿地BJG,属沿江生态湿地保护区,人类活动干扰较弱),共6个研究样地(图1)。每个样地中设置5块10 m×10 m的标准样方,样方内以“品”字形设置3个采样点,用柱状采样器采集0—10 cm土壤样品并立即用聚乙烯无菌袋密封置于冰盒中带回实验室,充分混匀后分为3份,一份置于4℃冰箱保存,用于测定土壤微生物代谢活性;一份置于-80℃低温冰箱冷冻保存,在一周内用于土壤微生物磷脂脂肪酸的提取和分析,另一部分自然风干后研磨用于土壤各理化指标的测定。
1.3 研究方法
1.3.1 土壤理化性质测定
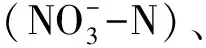
1.3.2 土壤微生物群落功能多样性测定
采用BIOLOG-ECO微平板法测定土壤微生物群落功能多样性。每个板有96个孔,分为3组重复,每组32个孔,包括1个对照孔和31个单一碳源孔。根据碳源的化学官能团及微生物代谢途径的不同,可将31种碳源分为6类:其中碳水化合物类10种、羧酸类7种、氨基酸类6种、多聚物类4种、胺类2种和酚类2种。称取10 g新鲜土壤置于25℃条件下活化24 h后,放入盛有90 mL无菌NaCl溶液(0.85%)的三角瓶中,在4℃摇床上震荡30 min(170 r/min),静置30 min后,将悬浮液稀释1000倍,用排枪取150 μL的样品悬液接种于ECO板的每个孔中,对照孔加入150 μL的无菌水,将接种好的ECO板置于25℃恒温避光培养,分别于0、24、48、72、96、120、144、168、192、216 h和240 h后用Biolog Reader分析仪读取590 nm的光密度值。

表1 不同干扰方式下松江湿地土壤主要理化性质分析
数值为平均值±标准差;同一列中不同字母表示经多重比较检验在a=0.05水平上达到显著水平;TC:total carbon;TN:total nitrogen;TP:total phosphorus;TC/TN:the ratio of total carbon to total nitrogen
用微平板孔中溶液吸光值平均颜色变化率(AWCD)来代表土壤微生物的总体代谢活性,计算公式如下:
式中,Ci为所测定的第i个碳源孔的光密度值;R为对照孔的光密度值。
1.3.3 土壤微生物群落结构多样性测定
采用磷脂脂肪酸(PLFA)法测定土壤微生物群落结构,PLFA的分析和提取采用修正的Bligh-Dyer法[20]。称取8 g冻干土样,加入35 mL氯仿∶甲醇∶磷酸(1∶2∶0.8)缓冲液,避光震荡后离心,上清液加入12 mL氯仿和磷酸缓冲液静置分液,收集氯仿层,N2吹干后转入硅胶柱,过氯仿、丙酮和甲醇洗脱,弃氯仿(含中性脂)和丙酮(含糖脂),收集甲醇(含磷脂)洗提液。经碱性甲醇溶液水解和皂化,N2吹干后得到磷脂脂肪酸甲酯,加入200 μL甲酯化的C19:0,溶解后作为内标物,使用气相色谱仪(7890B GC,Agilent Technologies Co.,USA)进行土壤微生物磷脂脂肪酸测定。不同类群微生物具有独特的PLFA特征谱图,可根据内标C19:0计算土壤微生物PLFA总量和单个PLFA的含量(nmol/g)。本研究中,细菌用14:0、15:0、16:0、17:0、18:0、20:4ω6c、20:0、22:0表征;革兰氏阳性菌(G+)用i14:0、i15:0、a15:0、i16:0、a16:0、i17:1ω9c、i17:0、a17:0、i18:0表征;革兰氏阴性菌(G-)用16:1ω9c、16:1ω7c、16:1ω5c、17:1ω8c、cy17:0ω7c、18:1ω7c、18:1ω5c、cy19:0ω7c表征;放线菌用10Me16:0、10Me17:0、10Me18:0、10Me20:0表征;真菌用18:2ω6c、18:1ω9c、20:1ω9c表征[21- 25]。
1.4 数据分析
土壤微生物群落多样性采用Shannon指数、Simpson指数和McIntosh指数表征,运用BIO-DAP程序进行计算。采用SPSS 19.0进行单因素方差分析(显著性水平为α=0.05)。主成分分析(Principal components analysis,PCA)和冗余分析(Redundancy analysis,RDA)在多元统计分析软件Canoco 5.0中进行。
2 结果与分析
2.1 松江湿地土壤微生物群落功能多样性
2.1.1 平均颜色变化率(AWCD)分析

图2 不同干扰方式下松江湿地土壤微生物群落平均颜色变化率 Fig.2 AWCD of soil microbial community in Songjiang wetland under different interference patterns
平均颜色变化率(Average well color development,AWCD)能够表征土壤微生物的碳源利用能力,也是指示土壤微生物代谢活性的重要指标。如图2所示,不同干扰方式下松江湿地土壤微生物AWCD值随培养时间的增加逐渐上升,表明土壤微生物群落活性不断提高且对碳源的利用能力均呈增加趋势。在0—24 h培养期内,除保护类型(BJG)外其他干扰方式的湿地土壤微生物群落AWCD值均变化不明显,说明在24 h内微生物对碳源的利用程度较低。培养24 h后各干扰方式下湿地土壤微生物群落AWCD值呈现指数型增长趋势,表明微生物群落活性增强,碳源被大幅度利用,其中,受保护的湿地(BJG)土壤微生物群落AWCD值增长最快,而受工业干扰的湿地(ASH)增长最慢;培养144 h后各干扰方式下湿地土壤微生物群落AWCD值增速减缓并趋于稳定。测定结果表明,不同干扰方式下松江湿地土壤微生物对碳源的利用能力存在显著差异,由强到弱依次为:滨江湿地(BJG)>金河湾湿地(JHW)>白鱼泡湿地(BYP)>太阳岛湿地(TYD)>呼兰河口湿地(HLH)>阿什河湿地(ASH)。
2.1.2 土壤微生物对碳源利用水平分析
不同干扰方式下松江湿地土壤微生物对6类碳源的利用程度存在显著差异,其中羧酸类、糖类和氨基酸类为主要利用碳源,而对多聚物类、酚类和胺类的利用程度相对较低(图3)。
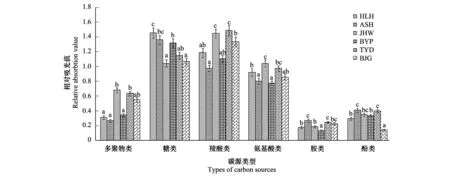
图3 不同干扰方式下松江湿地土壤微生物对不同碳源的利用水平Fig.3 The level of different carbon utilization by soil microbial in Songjiang wetland under different interference patterns
农业干扰(HLH)、工业干扰(ASH)和旅游干扰(BYP)的湿地土壤微生物对糖类利用水平皆为最高,分别占总碳源的33.46%、33.38%和32.98%;其次为羧酸类,分别为27.33%、23.9%和27.63%;胺类最低,分别为4.01%、6.54%和3.23%。旅游干扰的JHW和TYD土壤微生物对羧酸类的利用水平最高,分别占总碳源的30.48%和30.41%;其次为糖类,分别为21.97%和23.48%;胺类最低,为3.9%和5.06%。保护类型的BJG土壤微生物对羧酸类的利用水平最高,占总碳源的31.96%;其次为糖类,25.55%;酚类最低,为3.4%。总体而言,旅游干扰的TYD和JHW土壤微生物对羧酸类碳源的利用水平显著高于工业干扰的ASH(P<0.05);对糖类碳源的利用水平在农业干扰的HLH显著高于保护类型的BJG和旅游干扰的JHW,但BJG和JHW间差异不显著(P>0.05);对氨基酸类碳源的利用水平在旅游干扰的JHW显著高于工业干扰的ASH和旅游干扰的BYP(P<0.05)。
2.1.3 土壤微生物碳源利用的主成分分析

图4 不同干扰方式下松江湿地土壤微生物碳源利用的主成分分析Fig.4 PCA of carbon utilization by soil microbial in Songjiang wetland under different interference patterns
研究土壤微生物对不同碳源利用能力的差异,将有助于更全面地了解湿地微生物群落代谢功能特征[26]。对不同干扰方式下松江湿地土壤微生物群落代谢功能多样性进行主成分分析,其中第1主成分(PC1)和第2主成分(PC2)分别解释方差变量的74.9%和14.1%,两个主成分的累计方差贡献率达到89%,能够较好的反映微生物对碳源利用效率的变化特征(图4)。结果表明,不同干扰方式下6个湿地的微生物群落代谢功能分异明显。农业干扰的HLH、工业干扰的ASH和旅游干扰的TYD位于PC1的正端,空间距离较近,说明湿地间土壤微生物群落代谢功能差异不显著,但与旅游干扰的JHW、BYP和保护类型的BJG分异明显;旅游干扰的JHW和BYP集中分布于PC1和PC2的负端,说明两湿地间土壤微生物群落代谢功能较为相似,但与其他湿地差异较为明显;保护类型的BJG位于PC1的负端和PC2的正端,与其他湿地存在显著差异;其中羧酸类和糖类是影响松江湿地微生物群落代谢功能的敏感碳源。
2.2 松江湿地土壤微生物群落结构多样性
2.2.1 土壤微生物磷脂脂肪酸类型及含量
不同干扰方式下松江湿地土壤样品中共检测出47种PLFA,选取大于0.01 nmol/g的32种PLFA进行分析,其中代表细菌的PLFA 8种、革兰氏阳性菌9种、革兰氏阴性菌8种、放线菌4种、真菌3种(表2)。松江湿地中含量较高的PLFA主要有18:1ω7c、16:0、18:1ω9c、i17:1ω9c、cy19:0ω7c和16:1ω7c,各湿地的优势PLFA种类基本相同,但不同类型的PLFA含量存在显著差异。旅游干扰的TYD F/B最高为0.34,旅游干扰的JHW最低为0.11;旅游干扰的BYP G+/G-最高为0.98,旅游干扰的TYD最低为0.54;旅游干扰的BYP一般饱和脂肪酸/单烯不饱和脂肪酸(Sat/Mon)最高为0.52且显著高于其他湿地(P<0.05)。
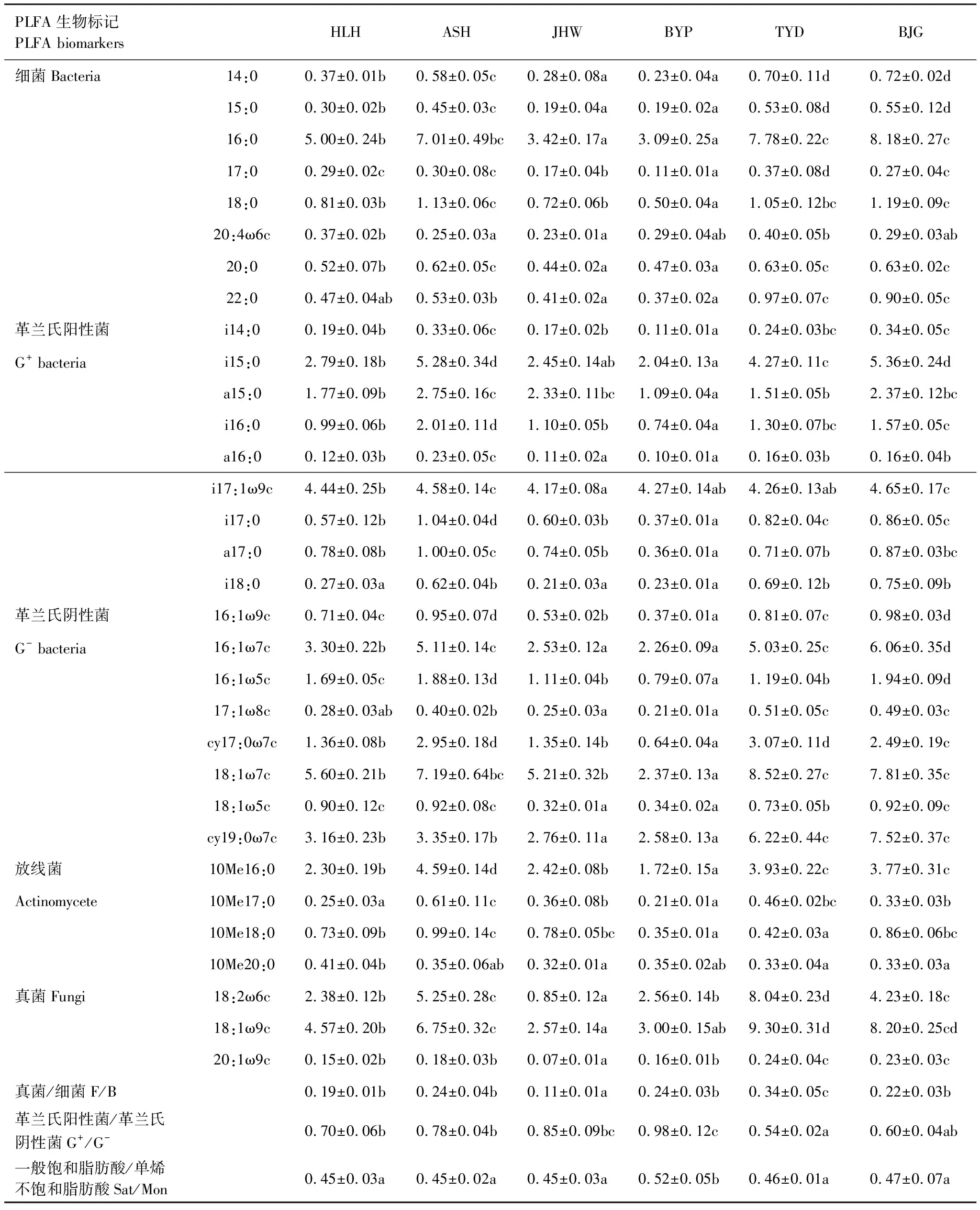
表2 不同干扰方式下松江湿地土壤微生物磷脂脂肪酸类型及含量
数值为平均值±标准差;同一行中不同字母表示经多重比较检验在a=0.05水平上达到显著水平;i:异丙基,isopropyl;a:反异丙基,anti isopropyl;Me:甲基分支脂肪酸,methyl branched fatty acids;cy:环丙基,cyclopropyl;ω:脂肪酸端,fatty acid side;c:顺式空间构型,cis space configuration;t:反式空间构型,Trans space configuration
不同干扰方式下松江湿地不同类群土壤微生物磷脂脂肪酸含量具有明显差异,各湿地土壤细菌(含G-和G+)含量最高,占总PLFA的69.72%—80.97%,显著高于真菌(9.20%—23.51%)和放线菌(6.77%—9.82%),这说明细菌是松江湿地土壤微生物的主要类群(图5)。保护类型的BJG总PLFA、BPLFA和G-PLFA含量最高,分别为65.48、58.77 nmol/g和28.44 nmol/g,而旅游干扰的BYP含量最低,分别为28.26、24.30 nmol/g和9.59 nmol/g;工业干扰的ASH G+PLFA含量最高为19.36 nmol/g,旅游干扰的BYP含量最低为9.95 nmol/g;旅游干扰的TYD FPLFA最高为17.89 nmol/g,显著高于其他湿地(P<0.05);工业干扰的ASH APLFA最高为6.54 nmol/g,与其他湿地存在显著差异(P<0.05)。

图5 不同干扰方式下松江湿地土壤微生物磷脂脂肪酸总含量 Fig.5 Total content of soil microbial PLFA in Songjiang wetland under different interference patternsBPLFA:细菌PLFA(含G-和G+),bacterial PLFA(include G- and G+);G-PLFA:革兰氏阴性菌PLFA,Gram-negative bacterial PLFA;G+PLFA:革兰氏阳性菌PLFA,Gram-positive bacterial PLFA;FPLFA:真菌PLFA,fungal PLFA;APLFA:放线菌PLFA,Actinomycete PLFA
2.2.2 多样性指数分析
Shannon指数、Simpson指数和McIntosh指数是评价微生物群落多样性的常用指标,能够表征湿地土壤中微生物群落结构的多样性、优势度和均匀度。结果表明,保护类型的BJG土壤微生物群落具有最高的多样性指数(2.994)、均匀度指数(19.464)和最低的优势度指数(0.037);工业干扰的ASH多样性指数最低(2.881),而优势度指数最高(0.069)且与其他湿地间差异显著(P<0.05)。农业干扰的HLH均匀度指数最低,为9.068(表3)。

表3 不同干扰方式下松江湿地土壤微生物群落多样性指数
数值为平均值±标准差;同一行中不同字母表示经多重比较检验在a=0.05水平上达到显著水平
2.2.3 微生物群落结构与环境因子的相关性分析

图6 不同干扰方式下松江湿地土壤微生物群落结构与环境因子的RDA分析Fig.6 RDA analysis of soil bacterial community structure and environmental factors in Songjiang wetland under different interference patterns

3 讨论
人类在城市湿地中的干扰活动十分频繁,是改变湿地生态系统服务功能最重要的直接驱动力,研究微生物利用不同碳源的能力,可以深入揭示不同干扰方式下湿地土壤微生物群落代谢水平的差异[27- 28]。本研究结果表明,不同干扰方式下松江湿地土壤微生物利用碳源的能力存在差异,其中保护类型的BJG土壤微生物利用单一碳源的能力最强,代谢活性最高,说明较好的湿地生态环境为微生物代谢与繁殖提供了有利条件。而工业干扰的ASH AWCD值最低,土壤微生物群落代谢能力最弱,这可能由于该湿地毗邻城区和工业区,受工业废水及固体废弃物等外源污染较多,土壤中总碳和总氮含量较高,虽然ASH与BJG都具有较高的总PLFA含量,但各优势微生物的PLFA含量间存在显著差异(表2),从而使其微生物群落功能出现相应变化。工业干扰破坏原有土壤的稳定性,减小可利用底物的丰度和均匀度,进而降低了微生物的代谢功能。对6类碳源利用率分析结果显示,松江湿地土壤微生物群落代谢以羧酸类、糖类和氨基酸类碳源为主,而对多聚物类、酚类和胺类碳源的利用率相对较低,羧酸类和糖类是湿地土壤微生物功能多样性表现出空间异质性的主要碳源类型。
主成分分析(PCA)是一种数学降维的方法,能够更为直观的反映不同干扰方式下松江湿地土壤微生物功能多样性的综合差异和相似状况。分析结果表明,受农业干扰(HLH)、工业干扰(ASH)和旅游干扰(TYD)的土壤微生物代谢功能差异不显著,造成这种现象的原因可能与3个湿地皆位于松花江中游河段人为干扰强度最大,外源污染物输入导致土壤总碳和总氮含量较高,进而形成适应特殊环境的优势菌群。杜萍等[29]对椒江口沉积物的研究结果也表明,微生物群落代谢特征与有机质含量关系密切。虽然干扰方式不同但土壤微生物代谢功能差异不大,其原因可用“功能冗余”来解释,即同一群落中的某些物种在生态功能上有一定程度的重叠。PLFA研究结果表明,不同干扰方式能够明显驱动湿地土壤微生物群落结构组成发生较大变化,显著影响微生物群落中优势种群的丰度(表2)。因此,在同一干扰条件下,湿地微生物群落结构和代谢功能所表现出的响应程度并不一致。这是由于人为干扰导致湿地土壤微生物群落中优势种群发生变化,但由于功能的冗余性,其变化程度反应到代谢功能上可能会被稀释。湿地微生物群落结构对外界干扰条件变化的反应比代谢功能更为敏感,这一结论也与Berga等[30]和王楠楠等[31]的研究结果相一致。虽然JHW和BYP同样受旅游干扰但开发时间相对TYD较晚,距离市区较远,受人类旅游干扰强度和频率相对较弱,因而表现为两湿地间微生物群落代谢功能相似但与TYD差异明显。保护类型的BJG受人为干扰较少,与其他湿地微生物代谢功能表现出较大差异。旅游干扰的JHW土壤微生物群落AWCD值较高,但其总PLFA含量相对较低,土壤理化性质又与保护类型的BJG差异不大。这可能是因为旅游干扰带来大量外源微生物和污染物,显著影响该湿地土壤微生物群落结构,而微生物代谢功能和土壤理化性质对外界环境变化表现出明显的滞后性。本研究结果也进一步证明土壤微生物群落结构可以作为快速预警和早期指示城市湿地生态环境健康状况的敏感生物指标。由于BIOLOG微平板技术具有一定局限性,31种碳源并不能全部反映自然条件下土壤微生物所处的复杂底物环境。因此,本研究通过BIOLOG微平板和PLFA技术相结合,以期更为全面、深入地阐释不同干扰方式对松江湿地土壤微生物的影响。
在湿地生态系统中,土壤微生物群落结构和多样性受湿地生物、水文和土壤等多种因素的交互影响[32]。本研究发现松江湿地中好氧微生物真菌和放线菌PLFA量显著低于细菌,说明湿地水淹环境减少了土壤中溶解氧的含量,导致放线菌和真菌的生长受到抑制,从而降低其在微生物总量中的比例。一般饱和脂肪酸(Sat)和单烯不饱和脂肪酸(Mon)是PLFA的重要组成部分[33],Carrasco等[34]认为Sat/Mon值小于1,则表明该区域有较高的有机质含量和有机碳输入,这也印证了对人为干扰引起营养物质的输入量较大导致土壤有机质含量增高,造成松江湿地Sat/Mon值较小的结论。G+细菌对环境胁迫的适应和生存能力强于G-细菌[35],其比值可以表征细菌群落受营养胁迫的程度,松江湿地G+/G-值均小于1,表明湿地生态系统稳定性较差,受到一定的 营养环境胁迫。

4 结论
不同干扰方式下松江湿地土壤理化性质、微生物代谢功能及微生物 PLFA均存在显著差异。土壤微生物碳源利用能力表现为:滨江湿地(保护)>金河湾湿地(旅游)>白鱼泡湿地(旅游)>太阳岛湿地(旅游)>呼兰河口湿地(农业)>阿什河湿地(工业)。微生物利用率最高的碳源是羧酸类,其次是糖类和氨基酸类,其中羧酸类和糖类也是不同干扰方式下松江湿地微生物功能多样性表现出异质性的主要碳源。保护类型的BJG 总PLFA、BPLFA和G-PLFA含量显著高于其他湿地,农业、工业和旅游干扰改变了土壤微生物群落组成和结构,显著降低了微生物生物量和多样性,导致湿地生态系统稳定性较差。RDA分析初步揭示了不同干扰方式下松江湿地微生物群落对土壤理化性质变化的响应情况,其中氮素和pH是影响湿地土壤微生物群落组成的关键环境因子。
——松江二中(集团)初级中学校歌

