进境西葫芦种子蔓枯病菌的分离与鉴定
文朝慧,尤 佳,王溪桥,何苏琴
(1.甘肃出入境检验检疫局 兰州 730010; 2.甘肃省农业科学院植物保护研究所 兰州 730070)
瓜类蔓枯病又称“油秧”、“污根”、“茎部流胶病”等,是一种由Didymella bryoniae(Auersw.)Rehm[无性态为Phoma cucurbitacearum(Fr.:Fr.)Sacc.,异名Stagonosporopsis cucurbitacearum(Fr.)Aveskamp,Gruyter & Verkley][1]引起的危害瓜类作物的世界性病害,可侵染甜瓜、西瓜、南瓜、黄瓜、哈密瓜等多种葫芦科作物[2-4]。蔓枯病菌自1869年在德国发现以来,美国、加拿大、荷兰、瑞典、日本、印度以及我国台湾等均有该病为害瓜类作物的报道[5-7]。我国新疆、甘肃、上海、浙江、江苏、陕西等省市自治区的哈密瓜和西瓜甜瓜产区有蔓枯病发生,且大田发病率普遍在20%~30%,连作地和温室中高达80%[3,8-10]。蔓枯病在瓜类作物的整个生育期都能发生,可为害植株的茎、蔓、叶、花、果实等各部位,造成瓜秧长势衰弱,果实品质下降,减产15%~30%[2-4,11-12]。瓜类蔓枯病具有发病迅速、防治困难的特点,病原菌可通过种子进行长距离传播[12],形成异地扩散和蔓延,进行种子健康检测是防止该病害发生发展的重要手段。
甘肃省河西地区是我国最大的对外繁育种子基地,国外种子流入多,种子调运频繁,只有加强种子健康检测才能防范外来有害生物的传入风险。在一批进境的意大利西葫芦(Cucurbita pepoL.)种子中发现颜色不正常籽粒,对种子进行检测后,证实其携带病原菌。经过病原物的分离培养,通过观察分离菌株形态特征和培养性状,结合PCR检测、致病性测定及rDNA ITS序列分析,对该菌株进行了鉴定。
1 材料和方法
1.1 材料
试验于2015年在甘肃出入境检验检疫局检验检疫综合技术中心进行。供试西葫芦样品为进境的意大利西葫芦种子,样品编号为125。瓜类蔓枯病菌特异性引物DB17F:5′-GCAGTCAATCCTTATCC-3′, DB17R: 5′-CGAAAGATTGTGTGACC-3′[13]由金唯智生物科技有限公司合成。
1.2 方法
1.2.1 样品初检 挑取颜色不正常西葫芦籽粒用于DNA提取和PCR初检。籽粒病组织液氮研磨后取0.1 g,利用植物基因组提取试剂盒(天根生化科技有限公司)提取总DNA。用引物DB17F/DB17R进行PCR检测,预期扩增产物为556 bp。PCR反应体系总体积 25 μL:10×PCR buffer 2.5 μL,MgCl2(1.5 mmol·L-1)2 μL,dNTP(2.5 mmol·L-1)1 μL,引物(10 μmol·L-1)各 0.5 μL,Taq酶(5 U·μL-1)0.3 μL,DNA模板2 μL,无菌去离子水16.2 μL。反应程序为 94℃预变性 3 min;94℃ 30 s,55℃ 45 s,72℃ 1 min,30个循环;72℃延伸 10 min,4℃保存。PCR产物在1.0%(w,后同)的琼脂糖上凝胶电泳,SYBR Safe染色,凝胶成像仪下拍照。
1.2.2 西葫芦种子中病原菌的分离 取送检西葫芦种子中变色的种子及健康种子,1%的次氯酸钠(NaClO)表面消毒处理5~8 min,无菌水冲洗3次后,在灭菌吸水纸上晾干。于无菌条件下将种子置于PDA培养基平板上,每平板均匀放置2粒,在(25±1)℃培养箱中黑暗培养,长出的真菌及时转出,并挑取菌丝尖端纯化。分离纯化得到的菌株接种到PDA斜面培养基上,置4℃冰箱中保存。
1.2.3 病原菌形态学观察和鉴定 纯化的菌株接种于PDA培养基,(25±1)℃培养,观察菌落特征,在显微镜下观察菌丝和孢子形态。
1.2.4 致病性测定 将分离获得的菌株接种于PDA平板中央,(25±1)℃培养4 d,打孔器切取直径5 mm的菌丝;健康西葫芦种子用1%的次氯酸钠(NaClO)表面消毒处理5~8 min,无菌水冲洗3次后,置于27℃温箱催芽,约24 h后,挑选胚根长约5 mm的发芽种子移入直径15 cm的含水滤纸培养皿中,在胚根上贴接直径5 mm的菌丝块。每皿放10粒种子,每处理3皿,以贴接不含病原菌的PDA培养基块的种子为对照;置(25±1)℃温箱培养,观察发病症状。对接种发病部位进行组织分离与培养,确认致病菌是否与原接种菌株相同。
1.2.5 病原菌的PCR鉴定 将纯化的菌株在PDA培养基上培养5~7 d,无菌水洗下菌落表面菌丝,转接到PD液体培养基中,在25℃、150 r·min-1恒温水浴摇床上培养3~4 d后,真空抽滤收集菌丝,液氮保存备用。采用试剂盒(E.Z.N.A.Fungal DNA Kit)提取菌丝的基因组DNA。采用特异性引物DB17F/DB17R对病原菌进行PCR检测,同时采用真菌的通 用 引 物 ITS4:5′-TCCTCCGCTTATTGATATGC-3′, ITS5: 5′-GGAAGTAAAAGTCGTAACAAGG-3′[14],对病原菌进行PCR扩增,扩增产物采用天根DP204-02型纯化试剂盒纯化回收,对获得的扩增产物进行测序(由金唯智生物科技有限公司完成),序列采用双向测定。将测得的序列在Gen-Bank数据库中进行BLAST分析,通过同源性比对对病原菌进行分子水平鉴定。
2 结果与分析
2.1 样品初检

图1 西葫芦种子样品的PCR扩增结果
引物扩增西葫芦种子125的DNA,扩增产物为556 bp(图1),初检结果表明西葫芦种子125为蔓枯病菌阳性。
2.2 病菌分离与鉴定
在PDA平板上,受感染的西葫芦种子表面长出灰黑色霉层,种子带菌率达到2%,且带菌种子未发芽。
纯化的菌株ZuSc-1(图2-A)在PDA培养基上(25±1)℃黑暗下培养,菌落背面初为白色,后期变为灰黑色,基生菌丝深褐色(图2-B);气生菌丝发达,絮状,中间稠密,略隆起,初为白色,老化后为灰白色,不形成子囊座和分生孢子器。
2.3 致病性测定
菌株ZuSc-1对供试的西葫芦具有强致病性。接种20 h后,西葫芦胚根被害率100%;受害胚根发黄变褐、皱缩腐烂,胚根生长明显受到抑制,未接种对照无病症(图2-C);7 d后在胚根病组织表面产生许多分散的黑色小点,即蔓枯病菌的分生孢子器(图2-D)。剪取西葫芦幼苗病健交界处的发病组织进行病原菌的重新分离,表面消毒后在PDA培养基上恒温培养,获得与原分离菌形态一致的菌株,且所有发病幼苗均能分离到接种病原菌,表明分离获得的菌株是西葫芦的病原菌。
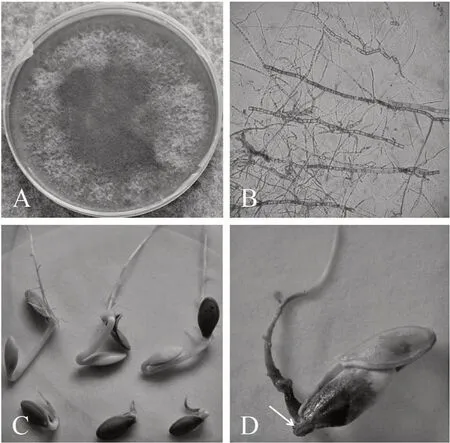
图2 蔓枯病菌的形态特征及致病性
2.4 分离物PCR检测
引物DB17F/DB17R在菌株ZuSc-1中扩增出约556 bp的单一条带,扩增产物测序后(序列号:MG872824),与GenBank中已公布菌株序列进行比对,该序列与Stagonosporopsis cucurbitacearum(异名:Didymella bryoniae)菌株 GSB10(序列号:GQ872462)、菌株 GSB23(序列号:GQ872461)序列同源性为 97%~99%。引物 ITS4/ITS5在菌株ZuSc-1中扩增出约600 bp的单一条带,扩增产物测序后,将待测真菌ITS序列(序列号:KM816641)与GenBank中已公布菌株ITS序列进行比对,该序列与Stagonosporopsis cucurbitacearum菌株CBS 233.52(序列号:EU167573)、菌株 R-T2(序列号:GU045304)、Didymella bryoniae菌株(序列号:AY293804)序列同源性为100%。结合其形态学特征,确定菌株ZuSc-1为Didymella bryoniae。
3 讨论与结论
传统真菌系统分类是以形态学特征为主要依据,尤其是子实体的形态和结构被用作分类鉴定的典型性状,但有些种类真菌需较长时间才能获得其有性或无性器官,有些种类真菌不易形成繁殖结构,以至于不能满足快速、准确鉴定的需求;目前,rDNA ITS序列分析和特异性引物PCR扩增是真菌鉴定中使用较多的分子生物学方法[5]。笔者分离获得的菌株ZuSc-1在PDA培养基上没有产孢,因此有必要借助特异性引物、病菌rDNA ITS序列进行鉴定。检测结果表明,菌株ZuSc-1的rDNA ITS序列与GenBank中瓜类黑腐球壳菌的相应序列具有100%的一致性;而特异性引物扩增产生的序列与GenBank中瓜类黑腐球壳菌的相应序列具有97%~99%的一致性。同时,采用特异性引物进行PCR扩增,还可直接在受侵染植株中检测病原菌,比常规检测缩短时间。
甜瓜蔓枯病菌划分为 A、As、B-a、B-la、B-b 共5种类型[2]。菌株ZuSc-1与Chiu等[2]描述的A型菌株相似,通常不产孢。但将菌株ZuSc-1接种在西葫芦胚根组织上,诱导其产生了分生孢子器,该结果同王晓东等[15]在黄瓜、打瓜和葫芦等果实上诱导得到蔓枯病菌的无性子实体具有一致性。
笔者通过分子生物学检测和致病性测定,从进境西葫芦种子中检测到致病菌瓜类黑腐球壳菌Didymella bryoniae,证实了进境西葫芦种子上携带瓜类黑腐球壳菌,该菌可造成西葫芦种子萌发率降低以及幼苗死亡[12]。蔓枯病是瓜类蔬菜生产中一种毁灭性病害,目前,高效的抗病品种和防治药剂较少[3,16-17],进口种子携带病原物可成为初侵染源,在温度、湿度适宜的条件下造成病害的发生、流行,威胁当地蔬菜生产,因此应加强对境外繁育种子的进境检测,以阻止外来病害的传入、蔓延。

