低频重复经颅磁刺激对血管性痴呆大鼠认知功能的影响
王金华 柯博熙 陈云 张丹红
血管性痴呆是由各种心、脑血管疾病导致的一种常见的临床综合征,主要表现为认知水平的下降[1]。近年来血管性痴呆发病率逐渐上升,已成为仅次于阿尔茨海默病第二常见的痴呆类型[2]。然而,对于血管性痴呆目前仍没有特效的治疗方法。重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)是一种无创的治疗方法,其利用磁场影响脑内的各种神经电生理活动和代谢途径,目前主要用于神经和精神疾病的治疗[3-4]。有研究报道了rTMS对于阿尔茨海默病和血管性痴呆认知功能方面的改善作用[5-7]。本研究观察L-rTMS对血管性痴呆大鼠认知功能的影响并探讨其神经保护的机制,现将研究结果报道如下。
1 材料和方法
1.1 实验动物分组 选取雄性健康SPF级SD大鼠45只,体重220~260g,由河北医科大学实验动物中心提供。动物饲养在屏障环境内,动物房环境噪音低于60dB,室温控制在20~25℃,相对湿度50%~70%,给予大鼠12h光照/12h黑暗交替的环境,自由获取食物与饮用水。所有动物操作均严格遵守国际动物保护与使用指南的相关规定。采用随机数字表法将45只大鼠分为3组(模型组、治疗组、假手术组),每组15只。模型组和治疗组利用双侧颈总动脉闭塞法(bilateral common carotid artery occlusion,BCCAO)制作血管性痴呆模型,假手术组给予同样的麻醉和操作处理,但不进行BCCAO操作。治疗组大鼠于造模后给予L-rTMS治疗,连续治疗14d,假手术组和模型组大鼠同时给予假刺激处理。
1.2 主要仪器与实验试剂 水迷宫检测系统(上海欣软),经颅磁刺激仪(丹麦 Mag Pro30,MagVenture,Farum);主要试剂:丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒,β-actin抗体、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、B-细胞淋巴瘤-2(B-cell lymphoma 2,Bcl-2)及半胱氨酸天冬氨酸蛋白酶3(Cysteine aspartic acid protease 3,Caspase-3)抗体。
1.3 大鼠血管性痴呆建模 采用BCCAO,具体操作方法如下:所有大鼠于手术前12h开始禁食,可进水。利用10%水合氯醛腹腔注射麻醉大鼠,麻醉剂发挥效果后将大鼠固定于操作台上,消毒后沿颈部正中切开皮肤,显露大鼠双侧颈总动脉,分离周围组织后双侧颈总动脉结扎。术后缝合皮肤并消毒,将动物放入笼中室温下自然苏醒,正常进食水。假手术组大鼠只分离颈总动脉不进行结扎。
1.4 L-rTMS方案 血管性痴呆大鼠造模成功后,将治疗组大鼠固定于一个圆柱型塑料管内,暴露大鼠头部,置于MC-B70蝶形线圈下,线圈内径20mm,外径100mm,4.2T的最大输出场强。L-rTMS参数为1.5Hz,1.5T,每个序列300脉冲,连续刺激3个序列,每个序列之间间隔2min冷却磁头。L-rTMS于14:00-17:00进行,1次/d,连续14d。假手术组和模型组大鼠给予磁头反面(无磁刺激影响)刺激,以消除声音对各组大鼠的影响。
1.5 行为学检测 采用水迷宫测试检测各组大鼠空间学习记忆能力的差异。本实验用水迷宫水池壁高为50cm,水深为 40cm,水温维持在 20~24°C,水池直径为150cm。在水迷宫的目标象限正中心位置放置一直径为10cm的水下隐性平台,平台上表面位于水下1cm处。前5d进行定位航行实验,4次/d,每次从不同入水点放入大鼠。大鼠面朝水池壁放入池中,记录逃避潜伏期,即大鼠寻找平台的时间。若大鼠120s内未到达水下平台,则将大鼠小心引导至平台上,并让其逗留15s,该大鼠逃避潜伏期记录为120s。第6天,撤去水下平台,记录每组大鼠目标象限时间。
1.6 海马MDA、SOD含量及Bax、Bcl-2、Caspase-3蛋白表达量测定 行为学实验后,采用随机数字表法在每组中选取5只大鼠测定MDA、SOD含量,每组中选取5只大鼠测定Bax、Bcl-2、Caspase-3蛋白,其余5只大鼠不做处理。麻醉后取脑组织,取海马备用,利用SOD和MDA试剂盒进行两者含量的检测。采用RIPA裂解液进行蛋白裂解,在4°C条件下使用离心机将匀浆离心5min(12 000×g),随后采用BCA法测定蛋白浓度。取裂解液在室温下电泳3h,随后转膜,TTBS处理1h。再与以下抗体相结合:β-actin抗体(浓度 1∶1 000)、抗 Bax抗体(1∶1 000)、抗 Bcl-2 抗体(1∶1 000)、抗 Caspase-3 抗体(浓度1∶1 000),4°C过夜。洗膜,然后利用二抗于室温下孵育1h。最后红外成像系统进行曝光显影。Bax、Bcl-2、Caspase-3蛋白与β-actin的光密度值比值作为其相对蛋白表达量。
1.7 统计学处理 采用SPSS 19.0统计软件。符合正态分布的计量资料以表示,多组之间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠造模后与治疗后的逃避潜伏期与目标象限时间比较 见表1。
由表1可见,3组造模后与治疗后的逃避潜伏期与目标象限时间比较,差异均有统计学意义(均P<0.01)。与假手术组比较,模型组、治疗组造模后及治疗后的逃避潜伏期均延长,目标象限停留时间减少,差异均有统计学意义(均P<0.05);模型组与治疗组造模后上述指标比较,差异均无统计学意义(均P>0.05)。与模型组比较,治疗组大鼠治疗后逃避潜伏期缩短、目标象限时间延长,差异有统计学意义(P<0.05)。
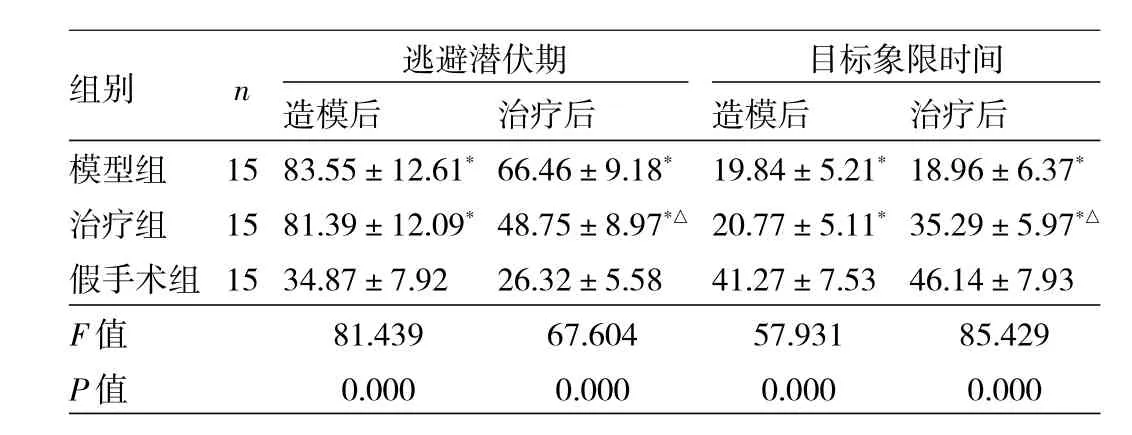
表1 3组大鼠造模后与治疗后的逃避潜伏期与目标象限时间比较(s)
2.2 3组大鼠海马部位MDA和SOD含量比较 见表2。
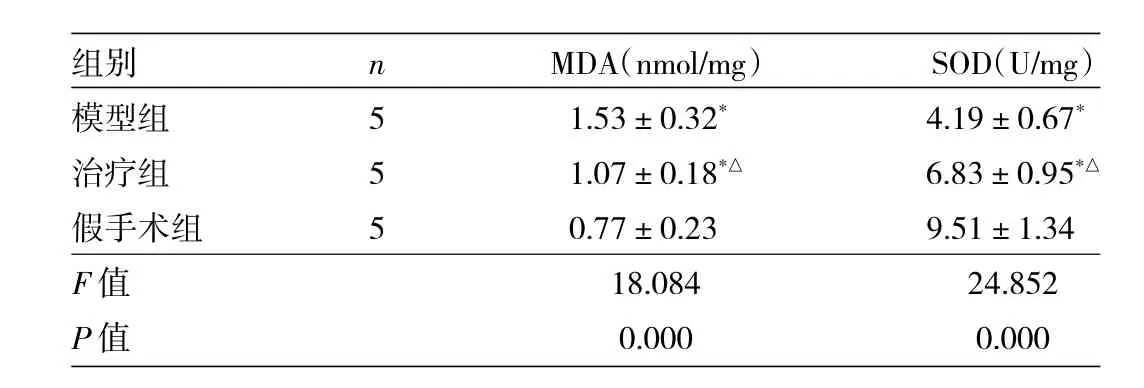
表2 3组大鼠海马部位MDA和SOD含量比较
由表2可见,3组大鼠MDA、SOD含量比较,差异均有统计学意义(均P<0.01)。模型组、治疗组大鼠MDA均高于假手术组,SOD均低于假手术组,差异均有统计学意义(均P<0.05)。与模型组比较,治疗组大鼠MDA降低,SOD升高,差异均有统计学意义(P<0.05)。
2.3 3组大鼠海马Bax、Bcl-2及Caspase-3蛋白的表达比较 见表3。
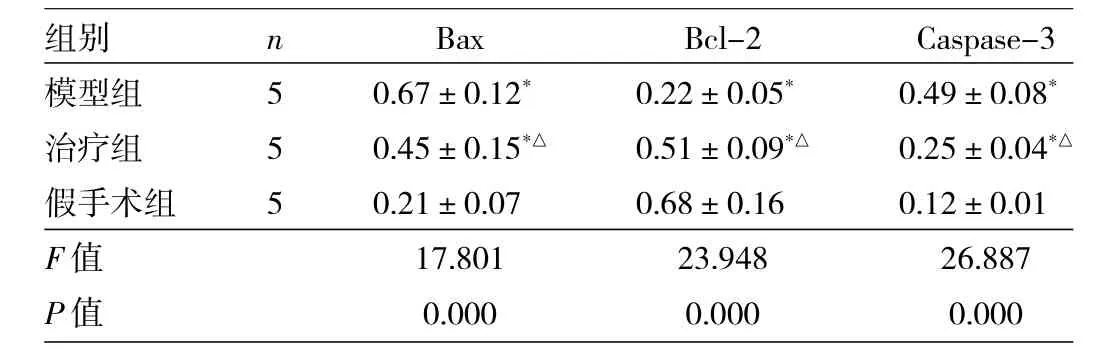
表3 3组大鼠海马Bax、Bcl-2及Caspase-3蛋白的表达比较
由表3可见,3组Bax、Bcl-2、Caspase-3比较,差异均有统计学意义(均P<0.01)。模型组、治疗组Bax、Caspase-3均高于假手术组,差异有统计学意义(P<0.05)。治疗组Bax、Caspase-3均低于模型组,差异有统计学意义(P<0.05)。模型组、治疗组Bcl-2均低于假手术组,治疗组Bcl-2高于模型组,差异均有统计学意义(均P<0.05)。
3 讨论
L-rTMS是一种有效改善认知功能且无创的治疗方法,其关键特性在于它能够在短时间内产生刺激神经元的电场。L-rTMS不仅对线圈直接刺激部位的神经回路产生兴奋或抑制作用,对大脑其它远隔部位也同样发挥作用[8-9]。L-rTMS已被广泛用于研究各种类型脑功能紊乱,如抑郁症和痴呆[10-11]。L-rTMS不仅在治疗神经精神疾病方面临床疗效明显,还能促使这些患者在认知行为方面获得更好的表现,如单词回忆、言语记忆、联想记忆、选择性注意、语言功能和其他执行功能[12]。许多研究表明,认知能力的改善可维持至L-rTMS治疗后的8周到3个月[13]。本研究发现经过2周的L-rTMS治疗后,血管性痴呆大鼠的认知功能得到了明显的改善。
血管性痴呆是老年人群痴呆的第二常见病因,患者的记忆和执行功能出现严重受损[14]。高血压、糖尿病、高胆固醇血症和高同型半胱氨酸血症是血管性痴呆的重要风险因素。氧化应激是体内氧化与抗氧化平衡的变化产生的,这种平衡有利于产生氧自由基或活性氧自由基,而非各种抗氧化剂防御机制[15]。氧化应激是与脑卒中相关的神经损伤和认知功能障碍的调节剂,在大鼠脑梗死灶周围可发生氧化DNA损伤[16-18]。氧化应激不仅与血管性痴呆有关,与血管性痴呆的危险因素也相关。MDA和SOD在很多研究中都被广泛地用来代表氧化应激能力[19-20]。血管性痴呆患者MDA含量明显升高[21]。本实验结果发现血管性痴呆大鼠海马MDA表达增多、SOD活性降低,说明血管性痴呆大鼠模型出现了氧化应激损伤,这与之前的研究结果相一致。L-rTMS治疗后MDA和SOD水平发生了逆转,证实了L-rTMS治疗改善血管性痴呆大鼠空间学习记忆功能可能与其抗氧化应激损伤密切相关。
凋亡是一种程序性的细胞死亡,在细胞死亡的众多不同机制中,细胞凋亡被提出用于解释许多神经障碍中所观察到的细胞缺失,如阿尔茨海默病、血管性痴呆、帕金森病、肌萎缩侧索硬化、脑卒中等等[22]。Bcl-2和Bax是负责调控细胞凋亡的两个主要基因。Bcl-2是抗凋亡Bcl-2家族的关键成员,其对调节线粒体介导的细胞凋亡至关重要[23-24]。Bcl-2的过度表达已经被证明可以保护神经细胞免受神经毒素的伤害[25]。Bax属于促生存子家族中的一员,其通过转移到线粒体膜上,促进细胞色素C的释放,从而促进下游的细胞凋亡过程[26]。Caspase是一种半胱氨酸蛋白酶,是细胞凋亡的重要介质。Caspase参与凋亡过程主要通过两种不同的途径:死亡受体途径和线粒体途径。无论涉及何种途径,Caspase-3都扮演着凋亡执行者的作用。Caspase-3是一种促凋亡酶[27-28],通过激活DNA分裂因子,进而激活内切酶分裂核DNA,最终导致细胞凋亡。凋亡已经被证实是与血管性痴呆相关的重要分子生物学机制,大量动物实验也涉及相关研究[29]。本研究利用免疫印记方法检测Bax、Bcl-2及Caspase-3的表达,观察发现血管性痴呆大鼠海马Caspase-3和Bax的表达增多,而Bcl-2降低,同样证实了血管性痴呆大鼠海马凋亡途径的激活。L-rTMS治疗组大鼠海马Caspase-3和Bax的表达减少,Bcl-2的表达增多,提示L-rTMS治疗在治疗血管性痴呆大鼠认知障碍过程中发挥了明显的抗凋亡特性。
总之,L-rTMS治疗可明显改善血管性痴呆大鼠认知功能,降低MDA水平,升高SOD的活性,抑制了血管性痴呆大鼠海马凋亡相关蛋白的表达,其对血管性痴呆大鼠发挥神经保护作用的机制可能与抑制缺血损伤后凋亡途径和氧化应激损伤有关。本研究结果证实了L-rTMS治疗对于血管性痴呆大鼠的神经保护作用,这为血管性痴呆或其它类型痴呆的基础和临床治疗提供一定的理论基础。但本研究发现L-rTMS治疗未使血管性痴呆大鼠的认知功能得到完全改善,也显示了其治疗的局限性,今后我们将会对其机制作进一步深入研究。(致谢:感谢河北医科大学神经内科、河北省脑老化与认知障碍重点实验室硕士生导师、副主任医师王华龙对大鼠造模及水迷宫试验提供的帮助。)

