无梗五加果黄酮的提取及其提取物的自由基清除活性比较
冯 颖, 赫子涵
(沈阳农业大学食品学院,辽宁沈阳 110866)
无梗五加(AcanthopanaxsessiliflorusSeem)别称短梗五加,卫生部于2008年第12号公告批准其为新资源食品,是一种药食同源的食品[1]。研究表明,无梗五加的果实具有降血脂[2]、抗肿瘤[3]、抗血小板[4-5]、清除自由基、耐缺氧、抗疲劳等作用[6-8]。近些年来,国内外不断有将无梗五加果制成果汁、果酒、果干等的报道[9],其作为新型营养健康食品也受到越来越多的关注。已有研究表明,无梗五加果的主要活性成分包括黄酮、皂苷、香豆素、三萜、酚酸、多糖等[6,10-11],其中黄酮类化合物是研究的热点。安琪研究了无梗五加果中总黄酮含量的测定方法[10]。李春芳等建立了无梗五加果提取物中总黄酮含量及金丝桃苷含量的测定方法[12]。李林在对无梗五加果实化学成分的研究中,以金丝桃苷及东莨菪内酯为指标,建立了无梗五加果的质量控制方法[13]。笔者所在课题组通过前期试验,建立了无梗五加果中黄酮类化合物含量的测定方法、乙醇回流提取及大孔树脂纯化工艺参数,并通过烘箱高温诱导法、化学发光法及滤纸片法测定表明,无梗五加果黄酮类化合物具有抗油脂氧化、清除羟自由基和超氧自由基的能力,并具有一定的抑菌活性[8,14]。本研究在前期试验的基础上,进一步采用超声波法提取无梗五加果黄酮类化合物,用响应面法优化其提取工艺参数,以提高其提取效率和提取量,并对提取物的各种自由基的清除活性进行测定和比较,旨在促进无梗五加果黄酮类化合物在食品及保健品领域的应用步伐。
1 材料与方法
1.1 材料与设备
无梗五加干果,购自辽宁省丹东农业科学院。芸香苷标准品、金丝桃苷标准品、槲皮素标准品、1,1-二苯基-2-三硝基苯肼(DPPH)、三羟甲基氨基甲烷(Tris),均购自北京鼎国生物技术有限责任公司;乙醇、硝酸铝、亚硝酸钠、氢氧化钠、盐酸、邻苯三酚、水杨酸、硫酸亚铁、过氧化氢等均为分析纯;甲醇、乙腈为色谱纯。
高速中药粉碎机,浙江省温岭市创力药材器械厂;电子天平,北京赛多利斯仪器系统有限公司;KQ-250A型超声反应器,昆山市超声仪器有限公司;UV-1600型紫外可见分光光度计,北京瑞利分析仪器公司;高效液相色谱,日本岛津公司;微量移液器,上海求精生化试剂仪器有限公司;RE-52型旋转蒸发仪,上海博通经贸有限公司;SHZ-ⅢB型循环水真空泵,上海化琦科学仪器有限公司;LG0.2型真空冷冻干燥机,新阳速冻设备制造有限公司。
1.2 方法
1.2.1 无梗五加果黄酮类化合物的提取工艺
1.2.1.1 单因素试验 将无梗五加果干燥果实粉碎,过40目筛,准确称取1 g无梗五加果粉末,置于100 mL三角瓶中,加入不同体积、一定体积分数的乙醇溶液,用玻璃纸密封好后置于超声波反应器中,在超声功率250 W、室温(设定为 25 ℃)下超声提取一定时间。待超声处理完毕后,真空过滤取滤液,用相应提取溶剂定容至100 mL。取适量体积的溶液,测定其中黄酮类化合物含量。
1.2.1.2 响应面试验设计 在单因素试验的基础上,以乙醇浓度、超声提取时间、提取剂用量为自变量,采用Design Expert 8.0软件中的中心组合(Box-Behnken)试验设计原理进行3因素3水平的响应面试验设计(表1)。采用Design Expert 8.0软件中的响应优化器进行优化分析,得到回归模型和优化的工艺参数。
1.2.2 黄酮类化合物含量的测定方法[14]用移液管吸取1.0 mL 样品溶液于10 mL试管中,加入0.3 mL 5% NaNO2溶液,混匀后,静置6 min,再加入0.3 mL 10% Al(NO3)3,摇匀后放置6 min。加入4.0 mL质量分数为4%的NaOH溶液,用浓度为30%的乙醇定容,摇匀,放置10 min。用紫外-可见分光光度计在500 nm处测定吸光度。同时以不加样品液的试剂作为空白参比液。将吸光度值代入以芸香苷为标准品制作的回归方程中,计算黄酮的含量。

表1 试验因素水平及编码值
1.2.3 高效液相色谱分析条件 标准品溶液的配制:用甲醇水溶液(甲醇、水的体积比为1 ∶1)溶解配制成金丝桃苷、芸香苷、槲皮素浓度分别为0.046、0.057、0.051 mg/mL的混合标准品溶液。
样品溶液的配制:将超声提取得到的无梗五加果黄酮提取液经旋转蒸发仪真空浓缩后冻干,用甲醇水溶液(甲醇、水的体积比为 1 ∶1)配制成浓度为1.3 mg/mL的样品溶液,混合均匀即得待测样品溶液。
将上述标准品溶液与样品溶液分别过0.4 μm滤膜,进样后依据保留时间定性,确定无梗五加果黄酮类化合物组成。高效液相色谱条件:色谱柱为Agilent TC-C18,柱温为25 ℃,检测波长为360 nm,进样量为10 μL。梯度程序设定见表2。

表2 液相梯度条件
1.2.4 自由基清除活性的测定 将超声提取得到的无梗五加果黄酮提取液,经旋转蒸发仪真空浓缩后冻干,用50%乙醇配制成不同浓度的样品溶液,进行自由基清除活性的测定。
1.2.4.1 DPPH自由基清除活性的测定[15]取3.3 mL样品溶液,加入配制好的0.5 mL浓度为1.0×10-5mol/L的DPPH无水乙醇溶液,摇匀,室温避光反应30 min后于520 nm测定吸光度。自由基清除率计算公式如下:
清除率=[1-(Ds-Db)/Dc]×100%。
式中:Dc为对照吸光度;Ds为样品吸光度;Db为样品空白吸光度。
样品活性的测定:将1 mL样品溶液、3.2 mL蒸馏水、4.5 mL pH值为8.2的50 mmol/L Tris-HCl缓冲溶液混匀,然后按照上述相同的方法测定325 nm处的吸光度。自由基清除率计算公式如下:
清除率=(Dc-Ds)/Dc×100%。
式中:Dc为加入样品前的吸光度;Ds为加入样品5 min后的吸光度。
1.2.4.3 羟自由基(·OH)清除活性的测定[17]取浓度为60 mmol/L的FeSO4溶液、水杨酸-乙醇溶液各2 mL,摇匀混合,加入1.0 mL样品溶液,加蒸馏水定容至20 mL,加入2 mL 6 mmol/L H2O2,反应10 min,在520 nm处测定吸光度。自由基清除率计算公式如下:
[1-(Ds-Db)/Dc]×100%。
式中:Dc为对照吸光度;Ds为样品吸光度;Db为样品空白吸光度。
2 结果与分析
2.1 超声波法提取无梗五加果黄酮单因素试验
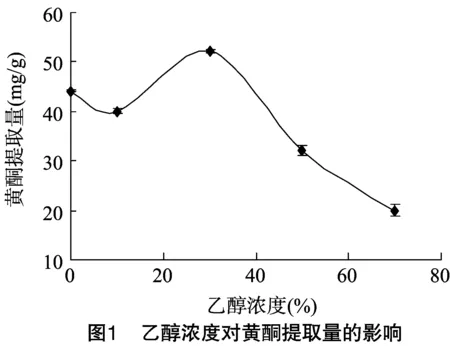
2.1.1 乙醇浓度对黄酮提取的影响 从图1中可看出,随着乙醇浓度的升高,黄酮提取量增加,当乙醇浓度为30%时,提取量达到最大值;随着乙醇浓度继续增加,水溶性黄酮溶解性降低,黄酮提取量随之下降。
2.1.2 超声提取时间对黄酮提取的影响 从图2可以看出,随着提取时间的增加,黄酮提取量逐渐增加,在40 min时达到最大值;随着提取时间继续增加,提取量反而下降,原因可能是提取出的黄酮在超声波的作用下被逐渐分解。

2.1.3 提取剂用量对黄酮提取的影响 从图3可以看出,随着提取剂用量的不断增加,黄酮的提取量也不断增加,当提取剂用量为50 mL/g时,黄酮提取量达到最大值;随着提取剂用量继续增加,黄酮提取量有所下降,当提取剂用量在50~90 mL/g 范围内时,提取量较高。
2.2 超声波法提取无梗五加果黄酮响应面试验设计与结果
将表3试验结果进行回归拟合,得到回归方程如下:Y=40.85+0.59A+2.40B-9.32C-0.99AB-0.15AC-1.43BC-3.19A2-1.77B2+2.15C2。


表3 响应面分析试验设计及结果
由表4方差分析及显著性检验结果可知,该回归方程模型影响极显著(P<0.000 1),回归模型的R2=0.984 6,说明该模型能够解释98.46%的变化,回归方程失拟项检验不显著(P=0.064 5>0.05),说明所得回归方程有较好的准确度和可靠性,拟合度良好,可用该模型分析和预测无梗五加果黄酮超声提取的结果。回归方程系数的显著性分析结果表明,各因素对黄酮提取量的影响程度排序为提取剂用量>超声提取时间>乙醇浓度(C>B>A),方程的一次项提取时间(B)、料液比(C)对响应值的影响极显著;二次项A2对总黄酮含量的影响极显著,二次项B2、C2对响应值的影响显著。综上所述,单个试验因素对黄酮提取量的影响并非只是线性关系。
2.3 超声波法提取无梗五加果黄酮响应曲面图与等高线图分析
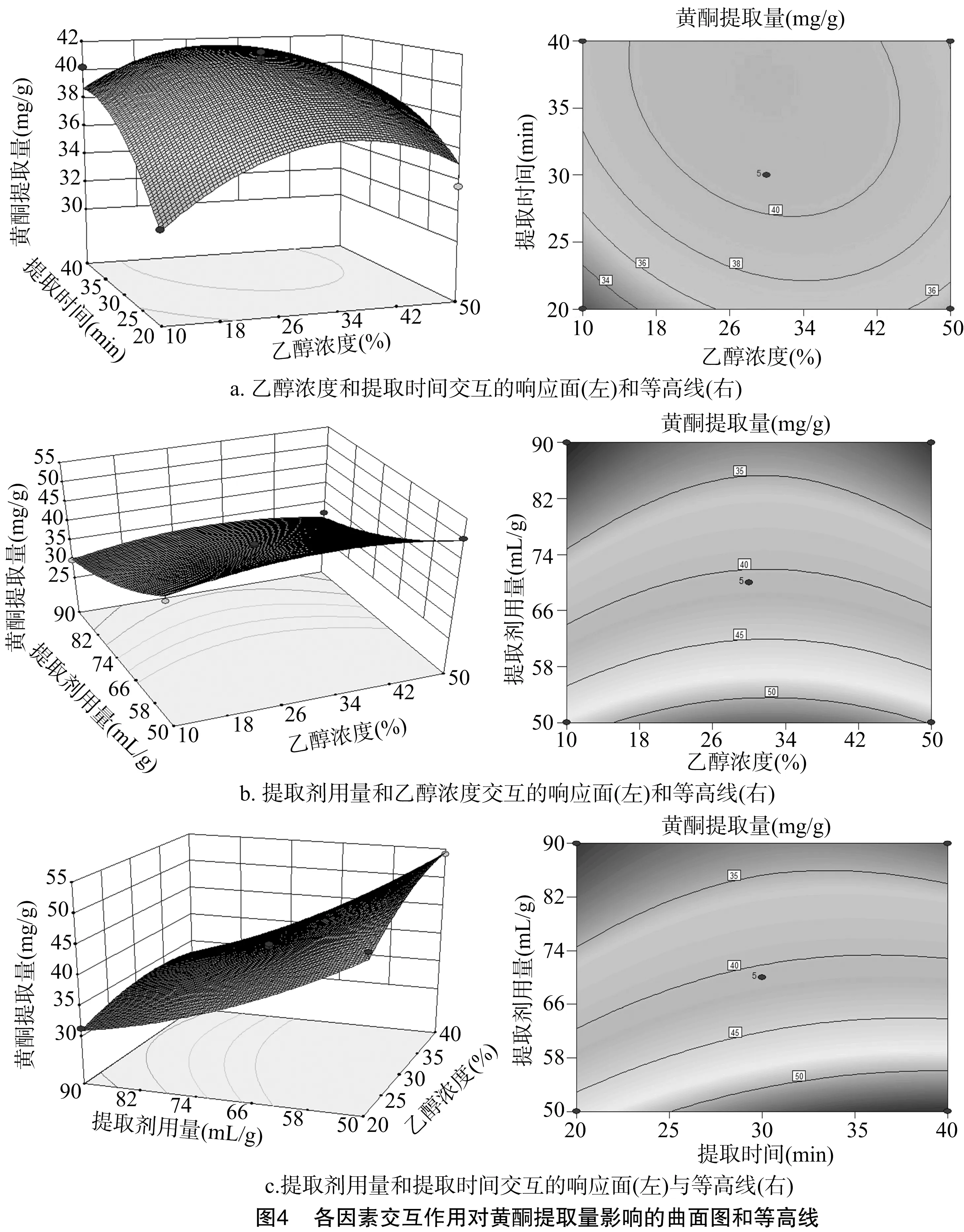
由图4可知,随乙醇浓度的不断增大,黄酮提取量先增高后下降(图4-a、图4-b);而当提取剂用量不断增加时,黄酮提取量不断下降(图4-b、图4-c); 黄酮提取量随着超声提取时间的不断增加,则呈现先增加后趋于平稳的趋势(图 4-a、图4-c)。由此可见,各因素之间没有明显的交互作用。如果某个响应曲面坡度非常陡峭,则表明响应值对于处理条件的改变非常敏感[14]。从响应曲面坡度来看,黄酮提取量对于提取剂用量的改变最敏感,其次是超声提取时间,而黄酮提取量对乙醇浓度的改变不敏感,与表4回归模型方差分析结果一致。

表4 回归模型方差分析
注:“*”表示在0.05水平影响显著;“**”表示在0.01水平影响显著。
利用响应面分析得到最佳提取工艺预测值,即乙醇浓度为29.21%,提取时间为40 min,料液比为1 g ∶50 mL,此时黄酮提取量理论值可达54.37 mg/g。将此提取工艺运用到实际操作当中,优化参数,即提取浓度为30%,提取时间为 40 min,料液比为1 g ∶50 mL,时,实际的黄酮提取量为 54.21 mg/g,达到预期值的99.71%。
2.4 无梗五加果黄酮提取物组成的高效液相色谱分析
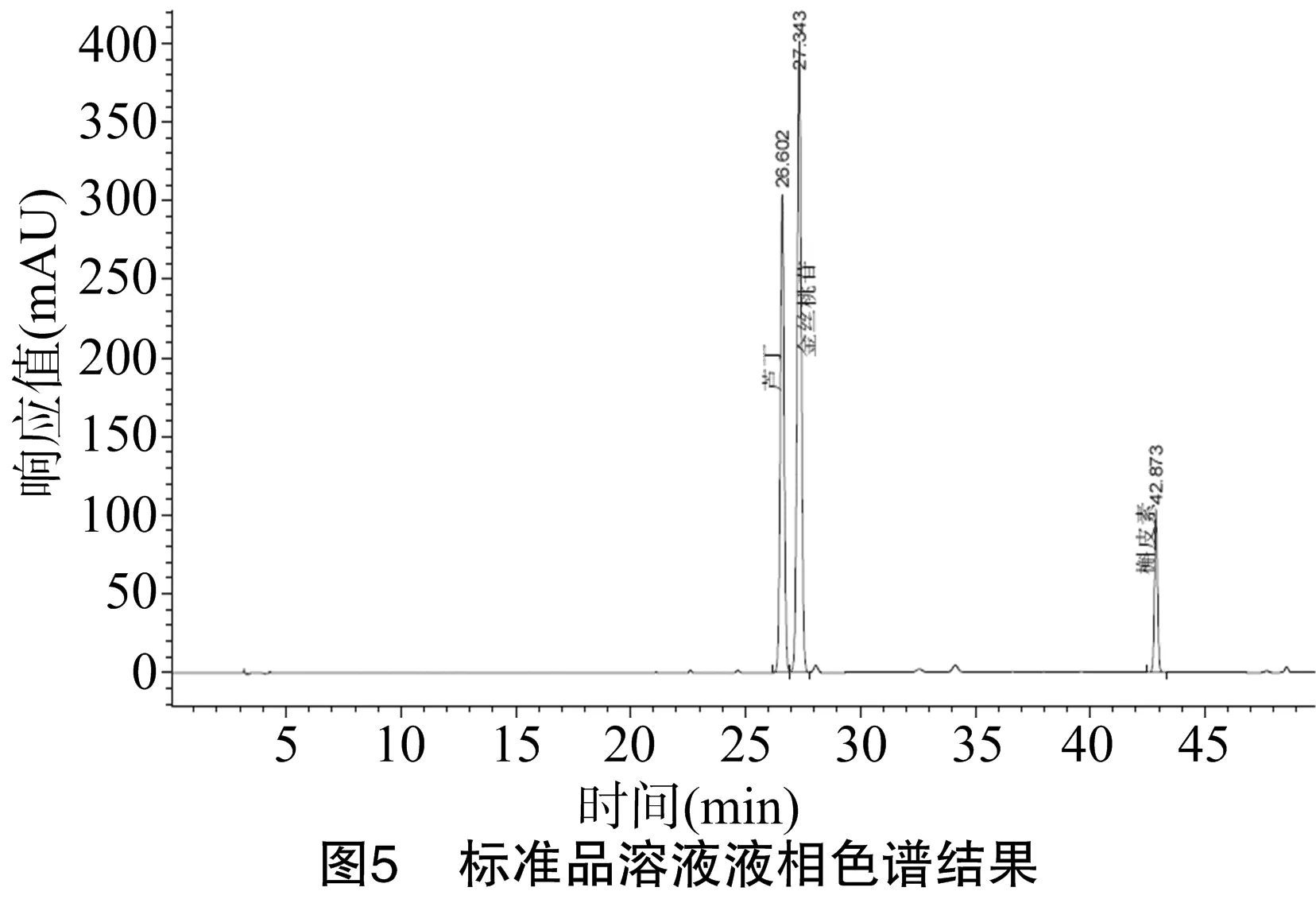
本试验采用梯度洗脱条件对无梗五加果黄酮组分进行了分离。图5显示,标准品芸香苷、金丝桃苷、槲皮素的出峰保留时间分别为26.602、27.343、42.873 min。由图6可以看出,样品在保留时间分别为26.704、27.450、42.977 min处出峰,与标准品芸香苷、槲皮素、金丝桃苷出峰时间基本一致。冯胜等采用单一成分测定的高效液相色谱法分别对无梗五加果中的芸香苷、槲皮素和金丝桃苷含量进行了测定,结果表明,无梗五加果中含有金丝桃苷、芸香苷、槲皮素,但后两者的含量较低[18], 从本试验的液相色谱图出峰结果看, 与其研究结果相同。

2.5 无梗五加果黄酮提取物的自由基清除活性的测定和比较
由图7可以看出,在所考察浓度范围内,无梗五加果黄酮提取物对羟自由基的清除活性最强,对DPPH自由基的清除活性则随其浓度增加而明显增强,当浓度较低时,其自由基清除活性为三者中最弱的,但当浓度接近0.4 mg/mL时,其自由基清除活性已超过对超氧阴离子自由基的清除活性。

3 结论
本研究在单因素试验基础上,采用响应面法对无梗五加果黄酮类化合物超声波提取工艺进行了参数的优化,并结合实际试验操作条件,最终确定最优的操作工艺参数为乙醇浓度30%,料液比1 g ∶50 mL,提取时间40 min,实际提取量为54.21 mg/g,达到预期值的99.71%。
对于提取后的无梗五加果黄酮提取物,通过与标准品(对照)保留时间进行比较,利用高效液相色谱法进行定性分析,确定其黄酮类组成包括芸香苷、金丝桃苷、槲皮素。
在所考察浓度范围内(0.05~0.4 mg/mL),无梗五加果黄酮提取物对羟基自由基的清除活性最强,对DPPH自由基的清除活性随浓度增加而增强的趋势最为明显。

